黑木耳多糖对胰脂肪酶活性的抑制作用
2017-12-06苟小
, , , , , ,苟小,
(药食同源植物资源开发四川省高校重点实验室,成都大学四川抗菌素工业研究所,四川成都 610052)
黑木耳多糖对胰脂肪酶活性的抑制作用
冉琳,何钢*,梁立,邱露,杨晨,颜军,苟小军,刘嵬*
(药食同源植物资源开发四川省高校重点实验室,成都大学四川抗菌素工业研究所,四川成都 610052)
目的:以月桂酸4-硝基苯酯为底物,考察黑木耳多糖对胰脂肪酶活性的抑制作用,确定最佳抑制条件、抑制类型及抑制常数。方法:采用水提醇沉的方法制备黑木耳多糖,阴离子交换树脂分离多糖,考察不同反应条件(浓度、pH、温度、时间)下黑木耳多糖各组分对胰脂肪酶活性的抑制效果;通过紫外吸收光谱研究黑木耳多糖与胰脂肪酶构象之间的关系;测定不同浓度底物时的反应吸光度值,初步确定黑木耳多糖对胰脂肪酶抑制作用的机理。结果:分离获得6个组分,其中中性多糖组分a对胰脂肪酶抑制效果较好。当pH为7.5、温度37 ℃、反应时间为60 min时抑制效果最佳,此时中性多糖组分a抑制率最高达到46.93%;反应类型为非竞争性抑制,米氏常数Km为17.68 mg/mL,最大反应速率Vmax为1.43 μmol/min,抑制常数Ki为30.32 mg/mL。通过紫外吸收光谱测定,胰脂肪酶最大吸收波长发生红移,说明黑木耳多糖改变了胰脂肪酶的构象,致使其酶催化活性受到抑制。结论:黑木耳多糖对胰脂肪酶活性具有抑制作用,表明黑木耳多糖降血脂作用可能与胰脂肪酶的活性抑制有关,为降血脂功能性产品的开发奠定理论基础。
黑木耳,多糖,胰脂肪酶,抑制作用
肥胖造成血脂异常,脂代谢紊乱,最终引起高血压、动脉粥样硬化等一系列疾病日益严峻。哺乳动物进食的脂肪一般会通过胰脂肪酶(porcine pancreatic lipase,PPL)水解后消化吸收,胰脂肪酶是脂肪水解过程的关键酶,可以催化天然底物油脂水解为甘油和脂肪酸[1-2],抑制其活性可以有效抑制脂肪的水解和吸收,从而达到控制和治疗肥胖的作用。
近年来,胰脂肪酶抑制剂已经用于肥胖病的临床治疗,如半合成的胰脂肪酶抑制剂类药物Orlistat,但患者服用后易产生腹胀、腹泻、脂肪性大便等副作用[3-4]。天然无毒副作用的胰脂肪酶抑制剂是一类重要的减肥物质,已被广泛关注。已有研究表明黑木耳具有降血脂、降血糖等功能,多糖是黑木耳的主要功效成分,黑木耳多糖能够显著降低高血脂动物体内的甘油三脂、胆固醇的含量[5-7],但其作用机理还不清楚。为了进一步研究黑木耳多糖降血脂活性的功效关系及有效防治肥胖问题,本文以通江黑木耳为材料,提取分离纯化黑木耳多糖,研究黑木耳多糖在不同条件下对胰脂肪酶活性的影响,通过紫外吸收光谱研究黑木耳多糖对胰脂肪酶构象变化的影响。并阐述黑木耳多糖对胰脂肪酶活性抑制的作用机理,对探讨黑木耳多糖降血脂和治疗肥胖病的机理具有重要意义,同时也为黑木耳多糖降血脂功能性产品的开发奠定理论基础。
1 材料与方法
1.1材料与仪器
黑木耳子实体产地 四川通江,四川裕德源生态农业科技有限公司提供;脂肪酶(猪胰) 酶活≥30000U/g,上海金穗生物科技有限公司;月桂酸4-硝基苯酯(4-Nitrophenyl Laurate) 东京化成工业株式会社;聚乙二醇辛基苯基醚(Triton X-100)、无水葡萄糖、95%乙醇、乙酸钠、浓硫酸、苯酚 均为分析纯,成都科龙化学试剂公司。
阴离子交换柱料(DEAE-Sepharose Fast Flow) 美国GE Healthcare 公司;FA2004B分析天平 上海越平科学仪器有限公司;HH-4数星恒温水浴锅 常州澳华仪器有限公司;A560型双光束紫外可见光分光光度 计翱艺仪器(上海)有限公司;YB-1000A型高速多功能粉碎机 永康市速锋工贸有限公司;RT-600酶标仪 深圳雷杜生命科学股份有限公司;GTISRT台式离心机、H1650-W台式高速离心机 湖南湘仪离心机仪器有限公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂。
1.2实验方法
1.2.1 黑木耳多糖制备
1.2.1.1 黑木耳粗多糖提取 按照实验室前期建立的黑木耳多糖提取工艺,将黑木耳子实体烘干、粉碎2 min,过16目筛,按料液比1∶40(黑木耳粉末:纯水,g/mL)沸水浸提2 h,冷却后纱布过滤,10000 r/min离心10 min,取上清,残渣反复浸提2次,离心后合并上清,得多糖浸提液,60 ℃浓缩后加入4倍体积95%乙醇过夜沉淀多糖,10000 r/min离心10 min,收集沉淀,冻干,即得黑木耳粗多糖[8]。
1.2.1.2 黑木耳多糖分离 称取黑木耳多糖冻干粉末100 mg,加入10 mL水,60 ℃水浴溶解2 h,10000 r/min离心5 min,取上清液备用。采用阴离子交换柱(DEAE-Sepharose Fast Flow)静态吸附分离黑木耳多糖,多糖溶液倒入柱料搅拌均匀,静态吸附1 h后装柱,弃去未吸附多糖溶液,再分别用蒸馏水及浓度为0.05、0.1、0.15、0.2、0.5 mol/L的NaCl溶液各500 mL洗脱得到不同的多糖组分,依次命名为组分a、b、c、d、e、f,洗脱液浓缩至50 mL,透析24 h后,冻干备用。
1.2.2 多糖含量测定 按照文献方法[9-10],配制0.4 mg/mL的标准葡萄糖母液,并稀释成浓度为0.125、0.100、0.075、0.050、0.025 mg/mL的葡萄糖工作液,各取1 mL葡萄糖工作液于试管,再加入5 mL硫酸-苯酚显色液,沸水浴1 h,冷却后测定490 nm吸光度值,绘制标准曲线。分别称取黑木耳多糖样品组分0.02 g于100 mL容量瓶中,按同样方法测定吸光度,代入标准曲线即得待测样品浓度。
1.2.3 胰脂肪酶活性的测定 胰脂肪酶酶活力单位定义为在37 ℃下保温3 min,每分钟释放出1 μmol对硝基苯酚所需要的酶量为一个酶活力单位,U;酶活力(药食同源植物资源开发四川可直接用405 nm处的吸光度值表示。
胰脂肪酶活性的测定参照Gordon[18]等报道的方法,并稍加改进。在试管中加入pH7.5(0.025 mol/L)的磷酸缓冲溶液(phosphate buffer saline,PBS)350 μL、450 μL pNP Laurate底物、样品溶液50 μL,37 ℃预热10 min后加入150 μL胰脂肪酶(0.2 mg/mL),混匀,37 ℃避光反应60 min,16000 r/min离心3 min,取上清于405 nm波长测吸光度。对照组用缓冲溶液代替样品液,每组实验重复三次,按公式(1)计算抑制率[11-14]。
抑制率(%)=(A1-A2)/A1
式(1)
其中,A1、A2分别为对照组和不同样品溶液在405 nm处的吸光度。
1.2.4 不同反应条件下黑木耳多糖对胰脂肪酶活力的抑制作用
1.2.4.1 不同浓度的黑木耳多糖对胰脂肪酶活力的抑制作用 参照1.2.2方法分别测定黑木耳多糖各分离组分溶液的多糖浓度,并进行2倍稀释法稀释成6个浓度梯度。中性多糖组分a浓度为0.25、0.05、0.10、0.20、0.40、0.80 mg/mL;多糖组分b、e浓度为0.02、0.04、0.08、0.16、0.32、0.64 mg/mL;多糖组分c、f浓度为0.016、0.032、0.064、0.128、0.256、0.512 mg/mL;多糖组分d浓度为0.022、0.044、0.088、0.176、0.352、0.704 mg/mL。按照1.2.3方法,在各反应体系中加入50 μL多糖溶液,于pH7.5,反应温度37 ℃条件下,反应60 min,测定各反应溶液的吸光度值,计算抑制率。以浓度为横坐标,抑制率为纵坐标,绘制抑制曲线。
1.2.4.2 不同pH下黑木耳多糖对胰脂肪酶活力的抑制作用 按1.2.3方法并结合1.2.4.1实验结果,以浓度为0.40 mg/mL的中性多糖组分a、0.32 mg/mL组分b、0.256 mg/mL组分c、0.704 mg/mL组分d、0.32 mg/mL组分e、0.256 mg/mL组分f为样品,各取50 μL分别加入各反应体系中,在温度为37 ℃,pH分别为6.0、6.5、7.0、7.5、8.0条件下反应时间60 min,测定各反应溶液的吸光度值,计算抑制率。以pH为横坐标,抑制率为纵坐标,绘制抑制曲线。
1.2.4.3 不同反应温度下黑木耳多糖对胰脂肪酶活力的抑制作用 按1.2.3方法并结合1.2.4.1实验结果,以浓度为0.40 mg/mL的中性多糖组分a、0.32 mg/mL组分b、0.256 mg/mL组分c、0.704 mg/mL组分d、0.32 mg/mL组分e、0.256 mg/mL组分f为样品,各取50 μL分别加入各反应体系中,在选择的最佳pH和反应时间条件下,分别在27、32、37、42、47 ℃的条件下反应后,测定各反应溶液的吸光度值,计算抑制率。以温度为横坐标,抑制率为纵坐标,绘制抑制曲线。
1.2.4.4 不同反应时间下黑木耳多糖对胰脂肪酶活力的抑制作用 按1.2.3方法并结合1.2.4.1实验结果,以浓度为0.40 mg/mL的中性多糖组分a、0.32 mg/mL组分b、0.256 mg/mL组分c、0.704 mg/mL组分d、0.32 mg/mL组分e、0.256 mg/mL组分f为样品,各取50 μL分别加入各反应体系中,在选择的最佳pH条件下,反应温度37 ℃,分别反应15、30、45、60、75 min后,测定各反应溶液的吸光度值,计算抑制率。以时间为横坐标,抑制率为纵坐标,绘制抑制曲线。
1.2.5 抑制作用类型的研究 根据抑制剂与酶结合的方式和特点不同,抑制类型可分为可逆抑制和不可逆抑制两种类型,可逆性抑制分为竞争性、非竞争性、反竞争性抑制。
按1.2.3方法及1.2.4.1的实验结果,选择最佳胰脂肪酶抑制率的条件(pH7.5,60 min,37 ℃),以0.40 mg/mL的中性黑木耳多糖a为多糖样品,设置样品组与对照组(不加样品),测定在胰酶浓度为0.00、0.50、1.00、1.50、2.00 mg/mL时的吸光度值,导入Hyper 32软件求得胰脂肪酶分解脂肪的反应速度,以胰脂肪酶质量浓度为横坐标,反应速率的倒数为纵坐标作图,以此推导抑制作用类型。
按1.2.3方法及1.2.4.1的实验结果,选择最佳胰脂肪酶抑制率的条件,以抑制率最高的多糖组分为例,pNP Laurate底物溶液的质量浓度分别为4、8 mg/mL,测定黑木耳多糖浓度在0.2、0.8、1.6 mg/mL下胰脂肪酶分解底物的吸光度值,将吸光度值导入软件Hyper 32得反应速率,以反应速率的倒数为纵坐标,以黑木耳多糖浓度为横坐标,做Dixon图,可得出抑制常数Ki;选择最佳胰脂肪酶抑制率的条件,以抑制率最高的多糖组分及其最佳浓度为例,改变pNP Laurate底物溶液的质量浓度(0、2、4、6、8 mg/mL),测定不同底物浓度下样品组与对照组的吸光度值,将吸光度值及不同的底物浓度导入软件Hyper32得最大反应速率及米氏常数Km值,按Lineweaver-Burk双倒数作图法,以底物质量浓度的倒数(1/[S])为横坐标,反应速率的倒数(1/v)为纵坐标,绘制双倒数曲线图。
1.2.6 黑木耳多糖对胰脂肪酶紫外吸收光谱的影响 取4 mL浓度为0.20 mg/mL的胰脂肪酶溶液,根据1.2.3方法及1.2.4.1的实验结果,以0.40 mg/mL的中性黑木耳多糖a为多糖样品,向胰酶中加入黑木耳多糖0、0.04、0.08、0.16、0.32 mL。混合均匀后于室温放置30 min,检测200~350 nm的吸光度[14-16]。
1.3数据处理
采用Hyper 32及Origin Pro8软件进行数据处理。
2 结果与分析
2.1多糖含量测定
以标准葡萄糖浓度为横坐标,490 nm处的吸光度为纵坐标,通过回归处理得线性回归方程y=4.72x+0.135,R2=0.9992。

图1 葡萄糖标准曲线
在490 nm处测得待测样品吸光度,由标准曲线y=4.72x+0.135得多糖组分a浓度为0.20 mg/mL,组分b为0.16 mg/mL,组分c为0.13 mg/mL,组分d为0.18 mg/mL,组分e为0.16 mg/mL,组分f为0.13 mg/mL。
2.2不同反应条件下黑木耳多糖对胰脂肪酶活力的抑制作用
2.2.1 不同浓度的黑木耳多糖对胰脂肪酶活力的抑制作用 由图2可得出,在一定范围内,黑木耳多糖对胰脂肪酶的抑制率随着多糖浓度的增加而增加,当浓度达到一定水平时,抑制率变化不明显,说明此时两者结合达到饱和。因此多糖组分a的最佳浓度为0.40 mg/mL,组分b的最佳浓度为0.32 mg/mL,组分c的最佳浓度为0.26 mg/mL,组分d的最佳浓度为0.70 mg/mL,组分e的最佳浓度为0.32 mg/mL,组分f的最佳浓度为0.26 mg/mL。

图2 黑木耳多糖浓度对胰脂肪酶活性的影响
2.2.2 不同pH下黑木耳多糖对胰脂肪酶活力的抑制作用 pH能改变酶分子活性部位有关基团的解离,在最适pH时,酶分子部位活性基团与最适底物结合,或低或高时则会改变酶构象,使酶活性丧失。从图3可知,抑制率随着pH增大而增大,当pH达到7.5时,抑制率达到最大值,之后随着pH增大而减小,因此最适pH为7.5。而人体肠道的pH为4.8~8.2,偏酸或偏碱都会影响黑木耳多糖对胰脂肪酶的抑制率。因此黑木耳多糖在人体肠道内可以通过抑制机体内胰脂肪酶的活性,减少对食物中脂类物质的消化吸收,从而降低肥胖病的风险。

图3 不同pH下黑木耳多糖对胰脂肪酶活力的抑制作用
2.2.3 不同反应温度下黑木耳多糖对胰脂肪酶活力的抑制作用 温血动物来源的酶最适温度一般为 35~40 ℃,接近体温,如高于最适温度,继续提高温度则会引起酶分子构象改变,致使酶催化活性大幅度下降。由图4可知,当反应温度在27~37 ℃时,抑制率随着温度的升高而增大,当温度高于37 ℃时,抑制率逐渐下降。此时随着温度的升高酶分子的构象改变,使酶催化活力大幅度下降。因此反应的最佳温度为37 ℃。

图4 不同反应温度下黑木耳多糖对胰脂肪酶活力的抑制作用
2.2.4 不同反应时间下黑木耳多糖对胰脂肪酶活力的抑制作用 由图5可知,黑木耳多糖与胰脂肪酶反应初期抑制率增长幅度较快,随着反应时间延长而增加。反应时间为60 min 时,抑制率达到最大,进一步延长时间后,多糖与胰脂肪酶的作用趋于饱和状态,其抑制率呈下降趋势。其中中性多糖组分a抑制率最高达到46.93%。
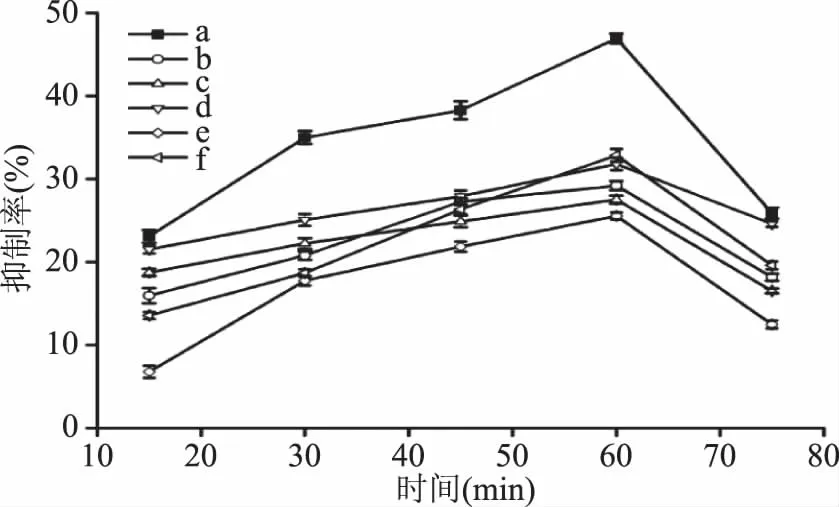
图5 不同反应时间下黑木耳多糖对胰脂肪酶活力的抑制作用
2.3抑制作用类型的测定
根据2.2.1的实验结果,中性多糖组分a抑制效果最好,其最佳抑制浓度为0.40 mg/mL。当反应体系中加入中性多糖组分a时,其速率直线通过原点,如图6所示,为可逆抑制的作用特点。由此可推断黑木耳多糖作为可逆性抑制剂抑制胰脂肪酶的活性[17]。

图6 黑木耳多糖对胰脂肪酶的抑制类型

图7 黑木耳多糖对胰脂肪酶的双倒数曲线图
以1/[S]和1/V进行双倒数作图,由图7的Lineweaver-Burk图可知,两直线交于横轴,为非竞争性抑制作用的特点,因此判断该反应的抑制类型为非竞争性抑制,多糖和底物可以随机同胰脂肪酶结合,不存在竞争关系[18],通过软件Hyper 32得出黑木耳多糖的Vmax为1.43 μmoL/min,Km为17.68 mg/mL;以黑木耳多糖浓度为横坐标,1/V为纵坐标进行Dixon作图,由图8所示,两条直线延长线的横坐标交点即为Ki值30.32 mg/mL。由此推断黑木耳多糖对胰脂肪酶的抑制类型为非竞争性可逆抑制。

图8 黑木耳多糖对胰脂肪酶抑制 Dixon 图
2.4黑木耳多糖对胰脂肪酶紫外吸收光谱的影响
不同浓度的中性黑木耳多糖a作用于胰脂肪酶的紫外吸收图谱如图9。由图可知,胰脂肪酶蛋白质分子在 220 nm 左右有一个强吸收峰,是由于肽键的 C=N 的π-π*跃迁引起的,与蛋白质的α-螺旋含量有关。随着中性多糖组分a含量的增加,最大吸收光谱向右移动,即发生红移,说明黑木耳多糖能使胰脂肪酶的构象发生改变,从而抑制酶的活性[19]。

图9 黑木耳中性多糖对胰脂肪酶的紫外吸收光谱影响
3 结论
本文提取并分离纯化出黑木耳多糖组分,研究了各多糖组分对胰脂肪酶活性的影响以及初步探讨多糖对胰脂肪酶的抑制作用机制。结果表明黑木耳多糖对胰脂肪酶具有抑制作用;抑制作用类型为非竞争性可逆抑制,即黑木耳多糖和底物能随机同胰脂肪酶结合从而抑制胰脂肪酶的活性。紫外吸收光谱分析,发现最大吸收光谱向右移动,即发生红移,初步推测黑木耳多糖能使胰脂肪酶的构象发生改变,从而抑制或降低其活性,为黑木耳多糖的降血脂作用机理补充数据。而胰脂肪酶在生物体消化吸收脂肪的过程中起着非常重要的作用,因此,黑木耳多糖作为胰脂肪酶抑制剂开发为保健食品或者药品的前景较大,它可通过影响人体脂肪代谢调节,从而可能在肥胖、高血脂等领域起到较大作用。
[1]耿杰,张洪梅,周泉城.文冠果壳皂苷抑制胰脂肪酶活性的研究[J].现代食品科技,2014,30(11):89-92.
[2]Kwon H J,AmadaK,HarukiM,et al.Identification of the histidine and aspartic acid residues essential for enzymatic activity of a family I.3 lipase by site-directed mutagenesis[J].FEB Letters,2000,483(2-3):139-142.
[3]Garza A L,Milagro F I,Boque N N,et al.Natural inhibitors of pancreatic lipase as new players in obesity treatment[J].Planta Medica,2011,77(8):773-785.
[4]Marrelli M,LoizzovM R,NicolettiM,etal.Invitroinvestigation of the potential health benefits of wild mediterranean dietary plants as anti-obesity agents withα-amylase and pancreatic lipase inhibitory activities[J].Journal of the Science of Food and Agriculture,2014,94(11):2217-2224.
[5]王献友,陈培云,吴广臣,等.黑木耳多糖提取及其药理活性的研究进展[J].南方农业学报,2012,43(5):683-687.
[6]赵爽,刘宇,许峰,等.毛木耳多糖降血脂功效研究[J].食品科技,2013,38(6):192-195.
[7]刘荣,栾淑莹,程萍,等.酸性黑木耳多糖降血脂功能的实验研究[J].营养学报,2016,(4):408-410.
[8]陆雯,蔡振优,鲜乔,等.黑木耳多糖提取工艺条件的研究[J].中国食品添加剂,2010(6):99-102.
[9]赵美峰,魏超妮,剡建华.硫酸-苯酚法测定黑果枸杞中多糖的含量[J].中医药信息,2015,32(2):58-59.
[10]茆广华,吴向阳,仰榴青,等.苯酚-硫酸法测定银杏外种皮多糖的含量[J].食品科技,2008(6):97-199.
[11]褚盼盼,侯冬敏,杨卫民.苦荞麦多糖对胰脂肪酶抑制作用的研究[J].中国食品添加剂,2015(6):78-82.
[12]Gordon J,Nimish N K,Derek S.Berry polyphenols inhibit pancreatic lipase activityinvitro[J].Food Chemistry,2009,115(1):193-199.
[13]张忠.茶多酚对胰脂肪酶活性的抑制作用[J].食品工业,2013,34(8):168-170.
[14]刘天囡,徐梦佳,胡冰,等.茯砖茶多酚类物质对胰脂肪酶活性的抑制作用[J].食品科学,2015,36(21):46-49.
[15]杨鹏,李艳琴.荞麦黄酮和荞麦糖醇对胰脂肪酶的抑制作用[J].食品科学,2015,36(11):60-63.
[16]吴子健,王吰,郑俊清,等.葡萄籽浸提物对胰脂肪酶活性抑制的研究[J].食品研究与开发,2009,30(9):83-86.
[17]尹瑞卿,丁玉,陈明达,等.黄芩苷对胰脂肪酶的抑制机理研究[J].安徽农业科学,2009,37(24):11534-11536.
[18]张丹,姚正颖,侯北伟,等.霜桑叶提取物对胰脂肪酶活性抑制作用的研究[J].食品工业科技,2017,38(3):52-56.
[19]黎春怡,黄卓烈,何平异,等.异丙醇对猪胰脂肪酶催化动力学和分子光谱的影响[J].化学与生物工程,2007,24(9):46-49.
InhibitoryeffectofAuriculariaauriculapolysaccharidesonpancreaticlipaseactivity
RANLin,HEGang*,LIANGLi,QIULu,YANGChen,YANJun,GOUXiao-jun,LIUWei*
(The Key Laboratory of Medicinal and Edible Plants Resources Development of Sichuan Education Department,Sichuan Industrial Institute of Antibiotics,Chengdu University,Chengdu 610052,China)
Objective:The inhibitory effect ofAuriculariaauriculapolysaccharides on the activity of pancreatic lipase was investigated.4-nitrophenyl laurate was used as a substrate. To screening optimum conditions ofAuriculariaauriculapolysaccharides inhibited of the pancreatic lipaseactivity,the types of inhibition and inhibition of constant. Methods:Auriculariaauriculapolysaccharides were obtained through hot water extraction and alcohol precipitation. Polysaccharides were separated by anion exchange resin. The effects ofAuriculariaauriculapolysaccharides were studied under different conditions(concentrate,pH,temperature,time)on pancreatic lipase activity. The relation betweenAuriculariaauricularpolysaccharides and conformation of pancreatic lipase were researched through ultraviolet absorption spectrometry. The reaction mechanism of betweenAuriculariaauriculapolysaccharides and pancreatic lipase through testing absorbance values was ensured when added different concentrate substrates. Results:Six components were obtained,and the neutral polysaccharide had the best suppression effect. When the pH was 7.5,temperature was 37 ℃,and time was 60 minutes,the inhibition rate reached the maximum value 46.93%. And the reaction was a noncompetitive inhibition. The Michaelis constant was 17.68 mg/mL. The maximum reaction rate was 1.43 μmol/min. The Ki was 30.32 mg/mL. By ultraviolet absorption spectrometry it showed that pancreatic lipase maximum absorption wavelength ultraviolet absorption spectrum redshift,which meant theAuriculariaauriculapolysaccharide changed the conformation of pancreatic lipase,leading to the restriction of enzyme catalytic activity. Conclusion:Auriculariaauriculapolysaccharides had suppression effect on pancreatic lipase activity. It indicated that the antihyperlipidemic effect ofAuriculariaauriculapolysaccharide was related with the inhibiton of the activity of pancreatic lipase,which lay a theoretical foundation for the development of the functional products of reducing blood lipid.
Auriculariaauricula;polysaccharides;pancreatic lipase;inhibition
2017-04-28
冉琳(1995-),女,硕士研究生,研究方向:多糖生物化学,E-mail:1783441838@qq.com。
*
刘嵬(1974-),女,硕士,副研究员,研究方向:多糖生物化学,E-mail:liuwei@cdu.edu.cn。
何钢(1982-),男,博士,副教授,研究方向:多糖生物化学,E-mail:hegang@cdu.edu.cn。
四川省科技厅应用基础计划项目(2015JY0117);四川省教育厅基础计划项目(17ZA0089);四川省高校重点实验室开放课题(10Y201501)。
TS201.2
A
1002-0306(2017)22-0056-05
10.13386/j.issn1002-0306.2017.22.012
