黑穗醋栗果实多糖的制备、结构鉴定及生物活性研究
2017-09-03徐雅琴王跃鹏牛小杰倪耀成王丽波
徐雅琴,王跃鹏,牛小杰,倪耀成,王丽波*,杨 昱,周 涛
(东北农业大学理学院,黑龙江 哈尔滨 150030)
黑穗醋栗果实多糖的制备、结构鉴定及生物活性研究
徐雅琴,王跃鹏,牛小杰,倪耀成,王丽波*,杨 昱,周 涛
(东北农业大学理学院,黑龙江 哈尔滨 150030)
以黑穗醋栗果实为原料,采用超声波法提取黑穗醋栗果实粗多糖。利用大孔树脂D4006,阴离子交换剂Q-Sepharose FF和葡聚糖凝胶Sephadex G-100对粗多糖进行分离纯化,得到均一黑穗醋栗多糖(black currant polysaccharide,BCP)。高效液相色谱法测定BCP的重均分子质量为16 329 kD。气相色谱法测定BCP单糖组成及物质的量比为:n(半乳糖醛酸)∶n(鼠李糖)∶n(阿拉伯糖)∶n(木糖)∶n(甘露糖)∶n(葡萄糖)∶n(半乳糖)=0.31∶0.66∶1.63∶0.36∶0.23∶0.31∶1.00。傅里叶变换红外光谱分析表明BCP含有多糖的特征吸收峰,紫外光谱和定性实验表明BCP不含花色苷、蛋白质、核酸和淀粉。刚果红实验表明BCP不具有三螺旋结构。生物活性研究结果表明:在0.2~1.2 mg/mL范围内,BCP对1,1-二苯基-2-三硝基苯肼自由基、•OH、超氧阴离子自由基(O2-•)均有较明显的清除作用,随着质量浓度增大,清除率明显升高。BCP对糖基化反应3 个阶段产物(Amadori产物、二羰基化合物和糖基化终产物)的形成均表现出良好的抑制作用,抑制率高于阳性对照氨基胍,且随质量浓度的增加,抑制率升高。BCP对α-淀粉酶具有一定的抑制活性,但抑制效果低于阳性对照阿卡波糖。
黑穗醋栗果实;多糖;提取分离;结构表征;生物活性
多糖是一类生物大分子物质,广泛分布于自然界,具有重要的生理活性[1-3],且对机体几乎无毒性。近年来,多糖已逐渐成为当前关注焦点和研究热点。研究较多地集中在药用植物多糖和真菌多糖[4],而对于日常食用的果蔬中含有的多糖的研究相对较少。
黑穗醋栗(Ribes nigrum L.),又名黑加仑、黑豆果、黑夏果,属虎草科(Saxifragace)茶麓子属(Ribes),起源于亚洲北部和欧洲,是多年生小灌木,在我国种植区主要分布在黑龙江、吉林、辽宁、新疆等地。黑穗醋栗果实含有丰富的花色苷、黄酮、多糖、维生素等多种活性物质[5-6],具有免疫调节、抗肿瘤、降血压、降血脂等活性[7]。在亚洲和欧洲,黑穗醋栗果实和叶片已作为中药,用于治疗多种疾病[8]。目前对于黑穗醋栗果实活性物质研究主要集中在花色苷、黄酮等组分[9],对于黑穗醋栗果实多糖研究报道较少。已有研究表明黑穗醋栗果实多糖是重要的活性成分,具有抗氧化、抗肿瘤、抗炎等活性,并且黑穗醋栗果实中含有不同组分的多糖,提取方法不同得到的多糖组分也不同[10]。目前对于黑穗醋栗果实多糖的研究主要集中在粗多糖提取及活性研究[11]。本课题组前期研究结果表明,超声波法提取黑穗醋栗果实粗多糖体外具有清除自由基和降血糖的功效[12]。本实验在前期研究基础上,通过超声波法提取得到粗多糖,采用色谱方法纯化,制备均一多糖,利用仪器分析方法对多糖结构初步表征,并且研究均一多糖体外清除自由基和降血糖活性。为深入开展黑穗醋栗果实多糖生物活性及构效关系的研究奠定实验基础。
1 材料与方法
1.1 材料与试剂
黑穗醋栗(黑丰)果实 黑龙江省农业科学院牡丹江农业科学研究所。
3,5-二硝基水杨酸 西昊精细化工有限公司;大孔吸附树脂D4006 南开大学化工厂;Q-Sepharose FF杭州费乐尔生物科技有限公司;Sephadex G-100 瑞典Pharmacia公司;D-半乳糖醛酸 上海源叶生物科技有限公司;葡聚糖T-10、T-40、T-70、T-110、T-2000北京拜尔迪生物公司;D-葡萄糖、D-半乳糖、D-鼠李糖美国Sigma公司;α-淀粉酶 北京奥博星生物技术责任公司。
1.2 仪器与设备
JY92-2D超声波细胞粉碎机 宁波新芝生物科技股份有限公司;TU-1901双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;FTS135型傅里叶变换红外光谱仪 美国Bio-Rad公司;LC-10AVP高效液相色谱仪、气相色谱仪 日本Shimadzu公司。
1.3 方法
1.3.1 黑穗醋栗果实多糖的制备
称取一定量黑穗醋栗果实匀浆,按液料比20∶1(V/m)加入去离子水,超声功率400 W,超声波提取25 min,提取液过滤、浓缩,用4 倍体积的无水乙醇沉淀,于4 ℃冰箱静置过夜,所得沉淀冻干,得到粉红色黑穗醋栗果实粗多糖。
选取大孔树脂D4006对黑穗醋栗果实粗多糖进行初步纯化,上样质量浓度4.00 mg/mL,洗脱流速1.0 mL/min,洗脱剂为去离子水,所得多糖溶液浓缩、冻干。将该多糖配制成20 mg/mL溶液,利用阴离子交换剂Q-Sepharose FF(2.0 cm×30 cm)进一步分离,上样量为5.00 mL,洗脱流速2.00 mL/min,洗脱剂为去离子水。苯酚-硫酸法跟踪检测,收集多糖洗脱液,浓缩冻干。将得到的多糖配制成15 mg/mL溶液,再利用葡聚糖凝胶Sephadex G-100(1.8 cm×40 cm)分离纯化,上样量为1.00 mL,洗脱流速0.60 mL/min,洗脱剂为去离子水,每1.00 mL为一管,收集洗脱液,苯酚-硫酸法跟踪检测至无糖检出。分别以洗脱管数(个)和吸光度为横纵坐标来绘制曲线。收集多糖主要组分,冻干,命名为(black currant polysaccharide,BCP),苯酚-硫酸法测其纯度。1.3.2 BCP的理化性质测定
BCP加于去离子水、乙醇、乙醚、乙酸乙酯、丙酮、氯仿等溶剂中,观察其溶解性。BCP化学特性测定利用茚三酮实验、碘-碘化钾实验、菲林试剂反应、三氯化铁反应。糖醛酸含量通过咔唑-硫酸法测定[13]。
1.3.3 BCP的分子质量测定
1.3.3.1 色谱条件
高效液相色谱仪;色谱柱:Ultrahydroge 2000(7.8 mm×300 mm,2 000 Å);洗脱剂:超纯水;检测器:RID-10A示差折光检测器;数据处理工作站:Shimadzu CLASS-Vp;进样量:10 µL;流速:1.0 mL/min,压力:2.3 MPa。
1.3.3.2 分子质量测定
精密称取各葡聚糖标准品(T-10、T-40、T-70、T-110、T-2000)及多糖BCP配制成2.0 mg/mL溶液,0.45 μm微孔滤膜过滤后进样,体积10 μL,测定色谱峰保留时间,GPC分析软件计算得到多糖分子质量。
1.3.4 BCP单糖组成分析
1.3.4.1 色谱条件
石英毛细管色谱柱;检测器:氢火焰离子化检测器(flame ionization detector,FID);程序升温:180 ℃(5 ℃/min)至220 ℃(保持5 min),220 ℃(10 ℃/min)至280 ℃(保持20 min);气化温度280 ℃;检测器280 ℃;载气:高纯氮气。
1.3.4.2 BCP的单糖组成分析
按照聂永心等[14]的方法,将多糖BCP进行酸水解和衍生化后进样,各单糖标准品也进行衍生化后混合进样,气相色谱仪进行分析检测(肌醇作为内标),计算BCP的单糖组成。
1.3.5 BCP的傅里叶变换红外光谱和紫外光谱分析
采用溴化钾压片法,在4 000~500 cm-1波数范围内进行傅里叶变换红外光谱扫描,鉴定主要官能团。用去离子水将多糖BCP配成0.5 mg/mL的溶液,采用双光束紫外-可见分光光度计在波长190~550 nm范围内进行光度扫描。
1.3.6 刚果红实验
[15]的方法,将BCP和刚果红试剂配制成不同浓度NaOH溶液,紫外-可见光谱扫描,测量样品溶液的最大吸收波长。
1.3.7 BCP的生物活性研究
1.3.7.1 BCP清除自由基活性测定
按照文献[16-18]方法,测定不同质量浓度(0.20、0.40、0.60、0.80、1.00、1.20 mg/mL)BCP溶液的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基清除能力、•OH清除能力、O2-•清除能力,以VC为阳性对照。
1.3.7.2 BCP抗糖基化反应活性测定
参考文献[17]的方法,建立牛血清白蛋白-葡萄糖糖基化反应体系,以氨基胍作为阳性对照,测定不同质量浓度(0.40、0.20、0.05 mg/mL)BCP溶液对Amadori产物、二羰基化合物、糖基化终产物(advanced glycation end products,AGEs)的抑制作用。
1.3.7.3 BCP对α-淀粉酶抑制活性测定
根据文献[19]的方法,测定不同质量浓度(0.20、0.40、0.60、0.80、1.00、2.00、4.00 mg/mL)BCP溶液对α-淀粉酶溶液的抑制活性,以阿卡波糖作为阳性对照。
1.4 数据处理
所有实验均进行3 次重复,数据均以表示。SPSS软件进行差异显著性分析,以P<0.05作为显著性差异标准。
2 结果与分析
2.1 BCP的制备

图1 BCP的洗脱曲线Fig. 1 Elution curve of BCP
超声波法得到的黑穗醋栗果实多糖粗提物,经过大孔树脂、阴离子Q-Sepharose FF和葡聚糖凝胶Sephadex G-100纯化后,得到主要组分BCP,洗脱曲线见图1。洗脱峰为单一吸收峰,峰形狭窄并对称,且无拖尾现象,说明BCP为均一组分,苯酚-硫酸法测其纯度为(90.70±1.25)%。
2.2 BCP的理化性质
BCP外观为白色疏松状(棉花糖状)固体,易溶于水,难溶于乙醇、乙醚、乙酸乙酯等有机溶剂。BCP与茚三酮反应呈阴性,表明不含有氨基酸、蛋白质;与碘-碘化钾试剂作用后不显蓝色,表明不含淀粉;与三氯化铁反应呈阴性,表明不含多酚类物质;与菲林试剂反应后,无砖红色沉淀氧化亚铜生成,表明不含有游离还原糖。硫酸-咔唑法测定BCP中糖醛酸含量为(20.72±0.72)%。
2.3 BCP分子质量

图2 BCP的高效液相色谱图Fig. 2 HPLC chromatogram of BCP
由图2可知,保留时间TR为8.558 min,GPC分析软件分析得到BCP的重均分子质量mw为16 329 kD,数均分子质量mn为14 439 kD,mw/mn为1.131,表明分子质量分布均一且较为集中。
2.4 BCP的单糖组成

图3 单糖标准品(a)和BCP(b)的气相色谱图Fig. 3 GC prof i les of mixed monosaccharide standards (a) and BCP (b)
在相同色谱条件下,保留时间可作为定性分析的依据,通过与标准单糖的保留时间相比较,可确定多糖样品中的单糖组分。各标准品和BCP的气相色谱图见图3。
依据保留时间和峰面积,分析计算得到BCP是由7 种单糖组成的杂多糖,各单糖组成的物质的量比为:n(半乳糖醛酸)∶n(鼠李糖)∶n(阿拉伯糖)∶n(木糖)∶n(甘露糖)∶n(葡萄糖)∶n(半乳糖)=0.31∶0.66∶1.63∶0.36∶0.23∶0.31∶1.00。
2.5 BCP傅里叶变换红外光谱和紫外光谱分析

图4 BCP的红外光谱图Fig. 4 Fourier transform infrared spectrum of BCP
红外光谱如图4所示,BCP在4 000~500 cm-1范围内具有明显的多糖特征吸收峰。3 418.56 cm-1处和2 974.26 cm-1处分别为O—H的伸缩振动峰和C—H伸缩振动峰,1 733.36 cm-1为酯化羰基C=O伸缩振动峰[20],1 608.23 cm-1处为酯化羧基COO-的伸缩振动峰,此外在1 418.32 cm-1处有吸收峰,表明BCP中含有糖醛酸,这与硫酸-咔唑测定结果一致。1 100~1 010 cm-1范围内存在3 个吸收峰,表明BCP为吡喃糖[21]。914.92 cm-1处和826.50 cm-1处均有吸收峰,表明存在吡喃环α-和β-两种端基差向异构体[22-23]。

图5 BCP的紫外光谱图Fig. 5 Ultraviolet spectrum of BCP
紫外光谱扫描结果如图5,BCP仅在201 nm波长处有多糖的紫外末端吸收峰。在260、280 nm波长处无吸收,表明不含蛋白质、核酸、花色苷[24]。
2.6 BCP刚果红实验结果
BCP与在不同浓度NaOH溶液条件下刚果红复合物最大吸收波长λmax的变化如图6。在一定NaOH浓度范围内,BCP与刚果红混合溶液与对照溶液的λmax变化相近,表明多糖BCP不具有三股螺旋结构[25]。

图6 不同NaOH浓度条件下BCP与刚果红络合物λmax的变化Fig. 6 Effect of NaOH concentration on maximum absorption wavelength (λmax) of Congo red-BCP complex
2.7 BCP清除自由基活性
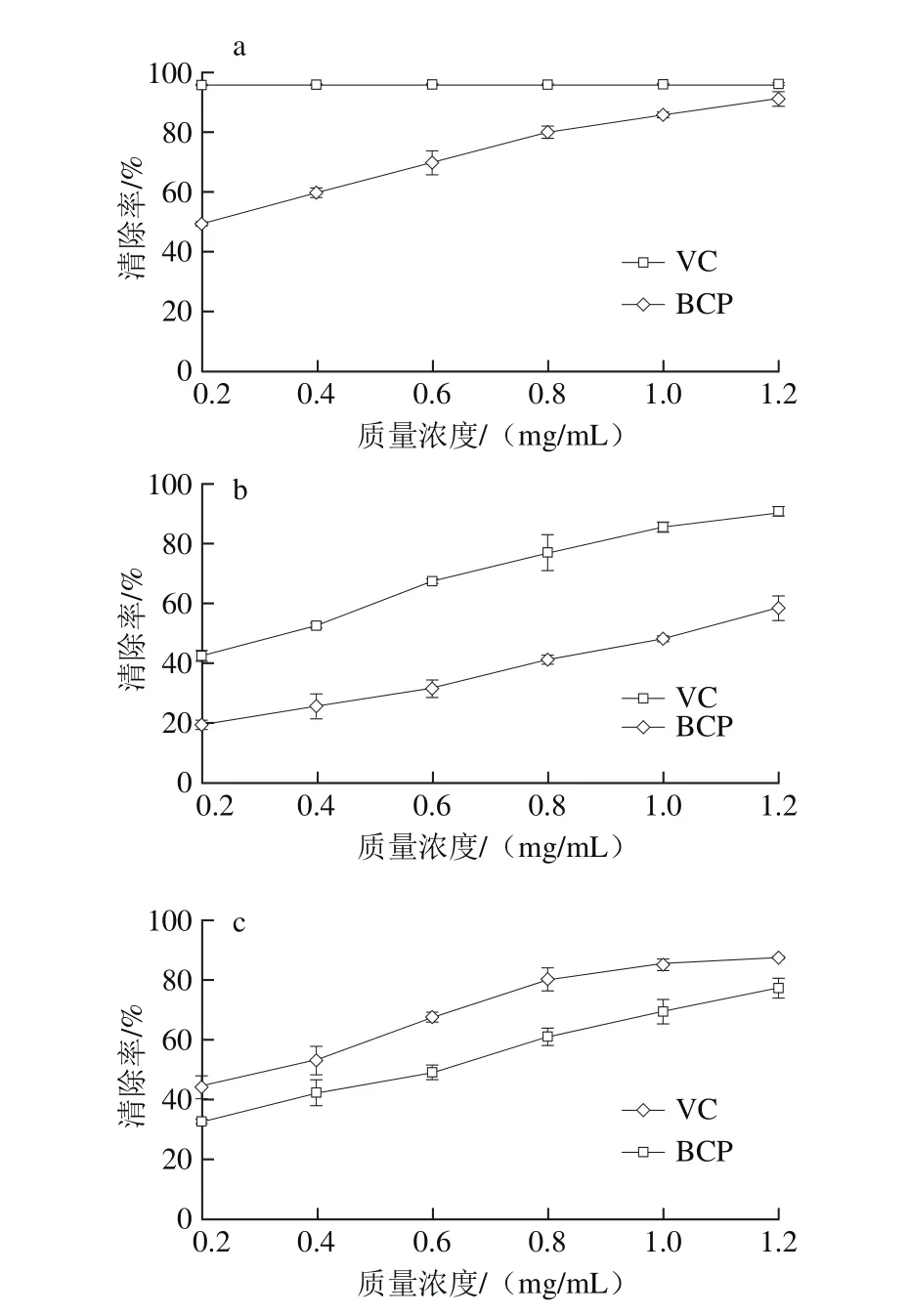
图7 BCP及VC对DPPH自由基(a)、•OH(b)、的清除作用Fig. 7 Scavenging effects of BCP and VC on radical DPPH (a), hydroxyl (b) and superoxide anion (c) radicals
由图7a可以看出,BCP具有较强的清除DPPH自由基的能力,在质量浓度为1.2 mg/mL时,清除率最大,为(91.01±2.41)%,与阳性对照VC(95.91±0.39)%接近,半抑制浓度(half maximal inhibitory concentration,IC50)为0.22 mg/mL。
由图7b可知,BCP具有一定清除•OH的能力,最高清除率为(58.48±4.24)%,IC50为1.11 mg/mL;弱于同等质量浓度下的VC清除能力,VC最高清除率达到(90.66±1.37)%,其IC50为0.33 mg/mL。
图7c结果表明,多糖具有较明显的清除O2-•的能力。BCP和VC最高清除率分别为(77.50±3.37)%和(87.74±0.18)%,IC50分别为0.64 mg/mL和0.30 mg/mL。
综上所述,多糖BCP对DPPH自由基、•OH、O2-•均有一定的清除作用。目前关于多糖清除自由基的活性机理还处于探讨阶段,可能的机理主要有以下两大类型:1)多糖分子直接作用于自由基。多糖中含有活性羟基提供活泼氢(•H),可以和自由基结合生成稳定的化合物,起到清除自由基的作用[26]。2)多糖分子间接作用于自由基。一是通过提高体内超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等抗氧化酶的活性,减少体内脂质过氧化,达到抑制自由基的目的[27];二是多糖分子络合产生活性自由基所必需的金属离子,如Fe2+、Cu2+等,使•OH、O2-•等的产生受到抑制[28]。对黑穗醋栗果实多糖清除自由基的活性机理鲜见报道,有待于进一步深入探讨。
2.8 BCP抗糖基化能力
蛋白质游离氨基与还原糖的羰基经过一系列反应可以产生稳定的AGEs,AGEs在糖尿病患者体内蓄积,可引起多种慢性糖尿病并发症。糖基化反应主要包括反应初期Amodori产物形成阶段、反应中期二羰基化合物形成阶段和反应末期终产物AGEs形成阶段。能抑制任何过程的抑制剂可以减轻AGEs的形成,有利于治疗糖尿病的慢性并发症[29]。
2.8.1 BCP对Amadori产物形成的影响

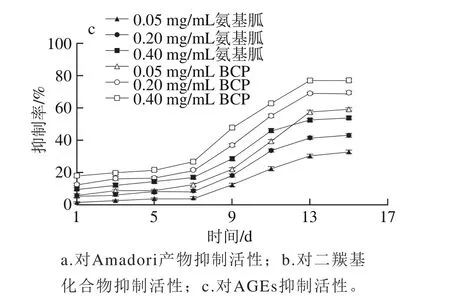
图8 BCP和氨基胍抗糖基化作用Fig. 8 Antiglycated activities of BCP and aminoguanidine
由图8a可知,在0~13 d内,不同质量浓度的多糖在糖基化体系中,对Amadori产物的产生都有一定抑制作用,而且随着多糖质量浓度的增加抑制作用逐渐增加。0.40、0.20、0.05 mg/mL BCP对Amadori产物最大抑制率分别为(42.82±1.14)%、(39.19±0.99)%、(29.64±0.81)%;而氨基胍的最大抑制率分别为(26.53±0.98)%、(20.34±1.10)%和(16.92±0.92)%。BCP对Amadori产物的抑制效果明显高于阳性对照氨基胍。
BCP和氨基胍对二羰基化合物生成的抑制作用如图8b所示。在1~7 d,BCP和氨基胍对二羰基化合物的抑制作用较平稳,7 d后,随着时间的延长,抑制效果逐渐增强。在第15天,抑制率达到最大,且质量浓度越高,抑制作用越强。当质量浓度为0.40 mg/mL时,BCP最大抑制率为(73.24±0.99)%,高于阳性对照氨基胍(63.41±0.99)%。
BCP和氨基胍对糖基化终产物AGEs的抑制作用见图8c。在1~7 d,多糖BCP对AGEs的抑制作用较平稳;7~13 d,随着时间的延长,对AGEs的抑制效果逐渐增强;13 d后,抑制效果趋于稳定。高质量浓度的BCP或氨基胍对AGEs的抑制作用较低质量浓度的抑制效果明显,且BCP的抑制作用强于阳性对照氨基胍。在质量浓度为0.40 mg/mL时,BCP和氨基胍最大抑制分别为(76.84±0.95)%、(53.63±0.93)%。
上述结果可知BCP对糖基化反应3 个阶段产物的形成均表现出良好的抑制作用,且效果要优于阳性对照氨基胍。此外,多糖BCP对反应中期二羰基化合物和末期AGEs终产物的抑制率均高于对反应初期Amadori产物的抑制率,表明多糖BCP对蛋白质非酶糖基化反应的抑制作用主要发生在反应中期和反应末期。这一实验结果与阳性对照组氨基胍的实验结果一致。综上所述,黑穗醋栗果实多糖可作为较好的糖基化反应抑制剂。
2.9 多糖BCP对α-淀粉酶活性抑制实验
α-淀粉酶抑制剂能有效抑制唾液淀粉酶和胰液淀粉酶活性,阻碍食物中碳水化合物的代谢,降低机体的血糖和血脂水平,防止餐后高血糖的发生,对于预防并改善糖尿病并发症的发生和发展有重要作用[30]。

图9 BCP对α-淀粉酶的抑制作用Fig. 9 Inhibitory effect of BCP on the activity of α-amylase
BCP和阿卡波糖对α-淀粉酶活性的抑制作用如图9所示。在0.0~1.2 mg/mL范围内,二者对α-淀粉酶的抑制率迅速增大,且清除作用均表现出剂量依赖关系。在1.2~4.0 mg/mL范围内,抑制率变化不明显,基本趋于稳定。BCP和阿卡波糖最大抑制率分别为(36.67±1.10)%和(62.07±1.67)%。可见BCP对α-淀粉酶具有一定的抑制作用,但抑制效果不如阿卡波糖。
3 结 论
多糖BCP是均一组分的杂多糖,重均分子质量为16 329 kD,单糖组成及物质的量比为:n(半乳糖醛酸)∶n(鼠李糖)∶n(阿拉伯糖)∶n(木糖)∶n(甘露糖)∶n(葡萄糖)∶n(半乳糖)=0.31∶0.66∶1.63∶0.36∶0.23∶0.31∶1.00。BCP具有多糖的特征吸收,不含蛋白、核酸和多酚类物质,不具有三股螺旋结构。多糖BCP对DPPH自由基、•OH、O2-•均有明显的清除作用;对糖基化反应3 个阶段产物的形成均表现出良好的抑制作用,效果强于阳性对照氨基胍;对α-淀粉酶活性有一定的抑制活性,但抑制效果弱于阳性对照阿卡波糖。
参考文献:
[1] ZONG A Z, CAO H Z, WANG F S. Anticancer polysaccharides from natural resources: a review of recent research[J]. Carbohydrate Polymers, 2012, 90(4): 1395-1410. DOI:10.1016/j.carbpol.2012.07.026.
[2] MAZAREI F, JOOYANDEH H, NOSHADM, et al. Polysaccharide of caper (Capparis spinosa, L.) leaf: extraction optimization, antioxidant potential and antimicrobial activity[J]. International Journal of Biological Macromolecules, 2016, 95: 224-231. DOI:10.1016/ j.ijbiomac.2016.11.049.
[3] LIU J, WILLFÖR S, XU C L. A review of bioactive plant polysaccharides: biological activities, functionalization, and biomedical applications[J]. Bioactive Carbohydrates & Dietary Fibre, 2015, 5(1): 31-61. DOI:10.1016/j.bcdf.2014.12.001.
[4] KAMARUDIN F, GAN C Y. Molecular structure, chemical properties and biological activities of pinto bean pod polysaccharide[J]. International Journal of Biological Macromolecules, 2016, 88: 280-287. DOI:10.1016/j.ijbiomac.2016.04.003.
[5] 赵玉红, 贾琳娜, 赵铁楠, 等. 黑加仑果汁中花色苷的贮藏稳定性[J].食品科学, 2014, 35(20): 301-307.
[6] 周立华, 牟德华, 李艳. 7 种小浆果香气物质的GC-MS检测与主成分分析[J]. 食品科学, 2017, 38(2): 184-190. DOI:10.7506/spkx1002-6630-201702030.
[7] KHOO G M, CLAUSEN M R, PEDERSEN H L, et al. Bioactivity and chemical composition of blackcurrant (Ribes nigrum) cultivars with and without pesticide treatment[J]. Food Chemistry, 2012, 132(3): 1214-1220. DOI:10.1016/j.foodchem. 2011.11.087.
[8] BISHAYEE A, MBIMBA T, THOPPIL R J, et al. Anthocyaninrich black currant (Ribes nigrum L.) extract affords chemoprevention against diethylnitrosamine-induced hepatocellular carcinogenesis in rats[J]. Journal of Nutritional Biochemistry, 2011, 22(11): 1035-1046. DOI:10.1016/j.jnutbio.2010.09.001.
[9] JIA N, XIONG Youling L., KONG B H, et al. Radical scavenging activity of black currant (Ribes nigrum L.) extract and its inhibitory effect on gastric cancer cell proliferation via induction of apoptosis[J]. Journal of Functional Foods, 2012, 4(1): 382-390. DOI:10.1016/ j.jff.2012.01.009.
[10] TAKATA R, YANAI T, YAMAMOTO R, et al. Improvement of the antitumor activity of black currant polysaccharide by an enzymatic treatment[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(5): 1342-1344. DOI:10.1271/bbb.60725.
[11] TAKATA R, YAMAMOTO R, YANAI T, et al. Immunostimulatory effects of a polysaccharide-rich substance with antitumor activity isolated from black currant (Ribes nigrum L.)[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(11): 2042-2050. DOI:10.1271/bbb.69.2042.
[12] 于泽源, 任中杰, 徐雅琴, 等. 黑穗醋栗多糖抗氧化及抑制非酶糖基化活性的研究[J]. 东北农业大学学报, 2012, 43(10): 73-78.
[13] KINTNER P K, BUREN J P. Carbohydrate interference and its correction in pectin analysis using the m-hydroxydiphenyl method[J]. Journal of Food Science, 1982, 47(3): 756-759.
[14] 聂永心, 姜红霞, 苏延友, 等. 黄伞子实体多糖的提取纯化及单糖组成分析[J]. 食品与发酵工业, 2010, 136(4): 198-200.
[15] XU Y Q, LIU G J, YU Z Y, et al. Purification, characterization and antiglycation activity of a novel polysaccharide from black currant[J]. Food Chemistry, 2016, 199(18): 694-701. DOI:10.1016/ j.foodchem.2015.12.078.
[16] WANG J L, GUO H Y, ZHANG J, et al. Sulfated modification, characterization and structure-antioxidant relationships of Artemisia sphaerocephala, polysaccharides[J]. Carbohydrate Polymers, 2010, 81(4): 897-905. DOI:10.1016/j.carbpol.2010.04.002.
[17] ZHANG L S, WANG X, DONG L L. Antioxidation and antiglycation of polysaccharides from Misgurnus Anguillicaudatus[J]. Food Chemistry, 2011, 124(1): 183-187. DOI:10.1016/ j.foodchem.2010.06.006.
[18] JIANG C X, WANG M C, LIU J, et al. Extraction, preliminary characterization, antioxidant and anticancer activities in vitro of polysaccharides from Cyclina sinensis[J]. Carbohydrate Polymers, 2011, 84(3): 851-857. DOI:10.1016/j.carbpol.2010.11.027.
[19] CHEN S H, CHEN H X, TIAN J G, et al. Chemical modification, antioxidant and α-amylase inhibitory activities of corn silk polysaccharides[J]. Carbohydrate Polymers, 2013, 98(1): 428-437. DOI:10.1016/j.carbpol.2013.06.011.
[20] YU Z Y, LIU L, XU Y Q, et al. Characterization and biological activities of a novel polysaccharide isolated from raspberry (Rubus idaeus L.) fruits[J]. Carbohydrate Polymers, 2015, 132(68): 180-186. DOI:10.1016/j.carbpol.2015.06.068.
[21] 王丽波, 程龙, 徐雅琴, 等. 南瓜籽多糖热水提取工艺优化及其抗氧化活性[J]. 农业工程学报, 2016, 32(9): 284-290.
[22] GNANASAMBANDAM R, PROCTOR A. Determination of pectin degree of esterif i cation by diffuse ref l ectance fourier transform infrared spectroscopy[J]. Food Chemistry, 2000, 68(3): 327-332. DOI:10.1016/ S0308-8146(99)00191-0.
[23] WANG Z B, PEI J J, MA H L, et al. Effect of extraction media on preliminary characterizations and antioxidant activities of Phellinus linteus, polysaccharides[J]. Carbohydrate Polymers, 2014, 109(13): 49-55. DOI:10.1016/j.carbpol.2014.03.057.
[24] YU Z Y, LIU L, XU Y Q, et al. Characterization and biological activities of a novel polysaccharide isolated from raspberry (Rubus idaeus L.) fruits[J]. Carbohydrate Polymers, 2015, 132(25): 180-186. DOI:10.1016/j.carbpol.2015.06.068.
[25] WANG K P, WANG J, LI Q, et al. Structural differences and conformational characterization of five bioactive polysaccharides from Lentinus Edodes[J]. Food Research International, 2014, 62(8): 223-232. DOI:10.1016/j.foodres.2014.02.047.
[26] JIANG J Y, KONG F S, LI N S, et al. Purification, structural characterization and in vitro antioxidant activity of a novel polysaccharide from Boshuzhi[J]. Carbohydrate Polymers, 2016, 147(43): 365-371. DOI:10.1016/j.carbpol.2016.04.001.
[27] WANG Z Y, ZHAO Y Y, SU T T, et al. Characterization and antioxidant activity in vitro and in vivo of polysaccharide purified from Rana chensinensis skin[J]. Carbohydrate Polymers, 2015, 126(3): 17-22. DOI:10.1016/j.carbpol.2015.03.031.
[28] FAN J L, WU Z W, ZHAO T H, et al. Characterization, antioxidant and hepatoprotective activities of polysaccharides from Ilex latifolia Thunb.[J]. Carbohydrate Polymers, 2014, 101(1): 990-997. DOI:10.1016/j.carbpol.2013.10.037.
[29] WANG X, ZHANG L S, DONG L L. Inhibitory effect of polysaccharides from pumpkin on advanced glycation end-products formation and aldose reductase activity[J]. Food Chemistry, 2012, 130(4): 821-825. DOI:10.1016/j.foodchem.2011.07.064.
[30] WANG Y F, YANG Z W, WEI X L. Sugar compositions, α-glucosidase inhibitory and amylase inhibitory activities of polysaccharides from leaves and flowers of Camellia sinensis, obtained by different extraction methods[J]. International Journal of Biological Macromolecules, 2010, 47(4): 534-539. DOI:10.1016/ j.ijbiomac.2010.07.007.
Preparation, Structural Identif i cation and Bioactivities of Polysaccharides from Black Currant Fruits
XU Yaqin, WANG Yuepeng, NIU Xiaojie, NI Yaocheng, WANG Libo*, YANG Yu, ZHOU Tao
(College of Science, Northeast Agricultural University, Harbin 150030, China)
A homogeneous polysaccharide (BCP) from black currant fruits was obtained by ultrasound-assisted extraction followed by successive purif i cation using macroporous resin D4006, anion-exchange Q-Sepharose FF and Sephadex G-100 columns. The molecular weight of BCP was determined as 16 329 kD by HPLC. BCP consisted of galacturonic acid, rhamnose, arabinose, xylose, mannose, glucose, and galactose at a molar ratio of 0.31:0.66:1.63:0.36:0.23:0.31:1.00 as determined by gas chromatography (GC). Fourier transform infrared (FTIR) spectra revealed that BCP had the characteristic absorption peaks of polysaccharides. Qualitative tests and UV spectra indicated the absence of protein, nucleic acid, starch, and pigment. Congo red test showed that BCP lacked triple helix structure. In the concentration range of 0.2–1.2 mg/mL, BCP presented high scavenging activities toward 1,1-diphenyl-2-trinitrophenylhydrazine (DPPH), hydroxyl, superoxide anion radicals in a concentration-dependent manner. BCP exhibited a signif i cant ability to inhibit the formation of glycation products at three stages which was in a concentration-dependent manner and higher than that of the control aminoguanidine. Moreover, BCP showed inhibitory activity against α-amylase lower than that of the control acarbose.
black currant fruit; polysaccharides; extraction and separation; structure characterization; biological activities
10.7506/spkx1002-6630-201715002
TS218
A
1002-6630(2017)15-0007-07
徐雅琴, 王跃鹏, 牛小杰, 等. 黑穗醋栗果实多糖的制备、结构鉴定及生物活性研究[J]. 食品科学, 2017, 38(15): 7-13.
DOI:10.7506/spkx1002-6630-201715002. http://www.spkx.net.cn
XU Yaqin, WANG Yuepeng, NIU Xiaojie, et al. Preparation, structural identif i cation and bioactivities of polysaccharides from black currant fruits[J]. Food Science, 2017, 38(15): 7-13. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715002. http://www.spkx.net.cn
2016-06-29
国家自然科学基金青年科学基金项目(31600276);黑龙江省自然科学基金面上项目(C2015004);黑龙江省SITP计划项目(201610224112)
徐雅琴(1964—),女,教授,硕士,主要从事天然产物提取及活性研究。E-mail:xu-yaqin@163.com
*通信作者:王丽波(1979—),女,副教授,博士,主要从事天然产物提取及活性研究。E-mail:wanglibo99166@163.com
