抗纤维化短肽Ac-SDKP对Ang Ⅱ诱导肺泡Ⅱ型上皮细胞向肌成纤维细胞分化的调控作用与机制
2017-08-07靳馥宇张丽娟
靳馥宇, 张 惠, 李 倩, 徐 洪, 杨 方, 张丽娟
抗纤维化短肽Ac-SDKP对Ang Ⅱ诱导肺泡Ⅱ型上皮细胞向肌成纤维细胞分化的调控作用与机制
靳馥宇, 张 惠, 李 倩, 徐 洪, 杨 方, 张丽娟
目的 探讨抗纤维化短肽N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸(Ac-SDKP)对血管紧张素Ⅱ(Ang Ⅱ)诱导肺泡Ⅱ型上皮细胞向肌成纤维细胞分化的调控作用与机制。 方法 采用AngⅡ诱导肺泡Ⅱ型上皮细胞向肌成纤维细胞分化,并予以缬沙坦、Ac-SDKP和PD98059预处理。免疫组织化学染色法检测E-钙黏蛋白(E-cad)的表达,激光共聚焦扫描显微镜检测α-平滑肌肌动蛋白(α-SMA)和磷酸化细胞外信号调节激酶(P-ERK)1/2的共定位表达。Western-blot法检测E-cad、α-SMA、Ⅰ型胶原、血管紧张素受体1(AT1)、P-ERK1/2及ERK1/2的定量表达。 结果 与对照组比较,Ang Ⅱ刺激组细胞E-cad表达下降,α-SMA、Ⅰ型胶原、AT1和P-ERK1/2的表达增高;而缬沙坦、Ac-SDKP、PD98059预处理后,均降低Ang Ⅱ诱导的A549细胞α-SMA、Ⅰ型胶原、AT1的表达升高及E-cad表达下降(P<0.05)。 结论 AngⅡ-AT1-ERK1/2通路介导肺泡Ⅱ型上皮细胞向肌成纤维细胞分化,而Ac-SDKP可通过AngⅡ-AT1-ERK1/2通路介导抑制肺泡Ⅱ型上皮细胞向肌成纤维细胞分化。
脯氨酸; 氨; 肺泡/细胞学; 成纤维细胞; 肾素-血管紧张素系统; 血管紧张素Ⅱ; 矽肺; 纤维化
近年来研究发现,在长期受到致纤维化因素的刺激时,上皮细胞和成纤维细胞将会发生表型转变并分化为肌成纤维细胞,其收缩、迁移和合成细胞外基质的能力远远大于成纤维细胞,被认为是器官纤维化形成过程中的主要效应细胞[1-3]。而肾素-血管紧张素系统(renin-angiotensin systems, RAS)稳态失衡可能与矽肺的发生、发展有关,其关键调节肽,即血管紧张素转化酶(angiotensin converting enzyme,ACE)在矽肺患者血清中表达上调,但其机制有待进一步探讨[4-5]。N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸(N-acetyl-seryl-aspartly-lysyl-proline,Ac-SDKP)是近年来发现的一种具有抗器官纤维化作用的短肽,在体内可被ACE的N端所清除,其含量下降与纤维化形成有关[6]。因此,本研究拟以人肺泡Ⅱ型上皮细胞株A549为研究对象,观察Ac-SDKP能否通过对ACE-血管紧张素Ⅱ(AngⅡ)-血管紧张素受体1(AT1)轴的调控,抑制人肺泡Ⅱ型上皮细胞向肌成纤维细胞的转化及胶原蛋白的合成,探讨Ac-SDKP抗矽肺纤维化的作用及其机制。
1 材料与方法
1.1 试剂与材料 人肺泡Ⅱ型上皮细胞株A549(中科院上海细胞库);Ham’s-F12培养基,胎牛血清(美国Gibco公司);AngⅡ,PD98059(美国Sigma公司);缬沙坦(日本东京化成株式会社);兔抗Ⅰ型胶原(武汉博士德公司);兔抗E-钙黏蛋白(E-cad,美国Abcam公司);兔抗α-平滑肌肌动蛋白(α-SMA),鼠抗ERK1/2及鼠抗磷酸化-ERK1/2(美国BD公司);兔抗GAPDH(美国Santa Cruz公司);二步法通用型免疫组织化学试剂盒(北京中杉金桥生物技术有限公司,PV6000);ECL显色试剂盒(美国GE公司);Rhodamine-山羊抗兔IgG/FITC-山羊抗小鼠IgG(03-1506/02-1806,美国KPL公司)。
1.2 方法
1.2.1 细胞培养与实验分组 人肺泡Ⅱ型上皮细胞株A549用含10%胎牛血清的Ham’s-F12培养基在37 ℃、体积分数为0.05的CO2孵育箱中培养,待细胞生长达次融合状态时,以无血清培养基同步化24 h后进行诱导分组:(1)对照组:无血清Ham’s-F12培养基培养48 h;(2)AngⅡ刺激组:无血清培养条件下,给予AngⅡ(10-7mol/L)诱导刺激48 h;(3)AngⅡ+AT1抑制剂(缬沙坦)处理组:无血清培养条件下,先给予缬沙坦(10-6mol/L)作用1 h后,再给予AngⅡ(10-7mol/L)共同孵育48 h;(4)AngⅡ+Ac-SDKP处理组:无血清培养条件下,先给予Ac-SDKP(10-8mol/L)作用1 h后,再给予AngⅡ(10-7mol/L)共同孵育48 h;(5)AngⅡ+ERK1/2通路Ⅰ抑制剂(PD98059)处理组:无血清培养条件下,先给予PD98059(10-5mol/L)作用1 h后,再给予AngⅡ(10-7mol/L)共同孵育48 h。
1.2.2 免疫细胞化学染色法检测E-cad的表达 对数生长期的细胞爬片培养至次融合状态时进行同步化处理,按照实验分组分别加入相应试剂(n=3),培养48 h后收集细胞,以4%多聚甲醛固定。染色步骤按免疫细胞化学试剂说明书进行,DAB显色,其中E-cad抗体稀释度为1∶100。采用显微数码相机(DP80,奥林巴斯有限公司)进行图像采集。
1.2.3 免疫荧光化学染色法检测α-SMA和P-ERK1/2的共表达 各组细胞按实验分组进行给药刺激后,以4%多聚甲醛固定。染色前细胞水化10 min,高压修复20 s,PBS洗3次后,正常山羊血清封闭20 min,滴加α-SMA(1∶200)和P-ERK1/2(1∶300)混合一抗,4 ℃过夜,洗去一抗后,滴加荧光二抗(1∶200),37 ℃孵育1 h,DAPI复染,采用显微数码相机进行图像采集。
1.2.4 Western-blot法检测E-cad、α-SMA、Ⅰ型胶原、AT1、P-ERK1/2及ERK1/2的定量表达 按照文献[6]方法提取并测定蛋白浓度,每孔90 μg上样,SDS-PAGE电泳并转膜。一抗(E-cad抗体1∶300稀释;α-SMA、Ⅰ型胶原、AT1、GAPDH抗体1∶500稀释;P-ERK1/2及ERK1/2 按1∶800稀释)4 ℃孵育过夜;二抗(1∶5 000稀释)37 ℃孵育30 min;ECL显色。图像扫描后,以Image J软件对蛋白表达条带进行吸光度(OD)值的定量分析,目的蛋白条带OD值经内参平衡后进行组间比较。
2 结 果
2.1 免疫细胞化学染色法检测各组细胞E-cad的表达 AngⅡ刺激后,部分细胞体积增大,由原来的铺路石状变为长梭形或者纺锤形,细胞E-cad表达较对照组显著减弱或缺失。予以缬沙坦、Ac-SDKP、PD98059预处理后,均明显减弱了AngⅡ对E-cad表达的抑制作用(图1)。
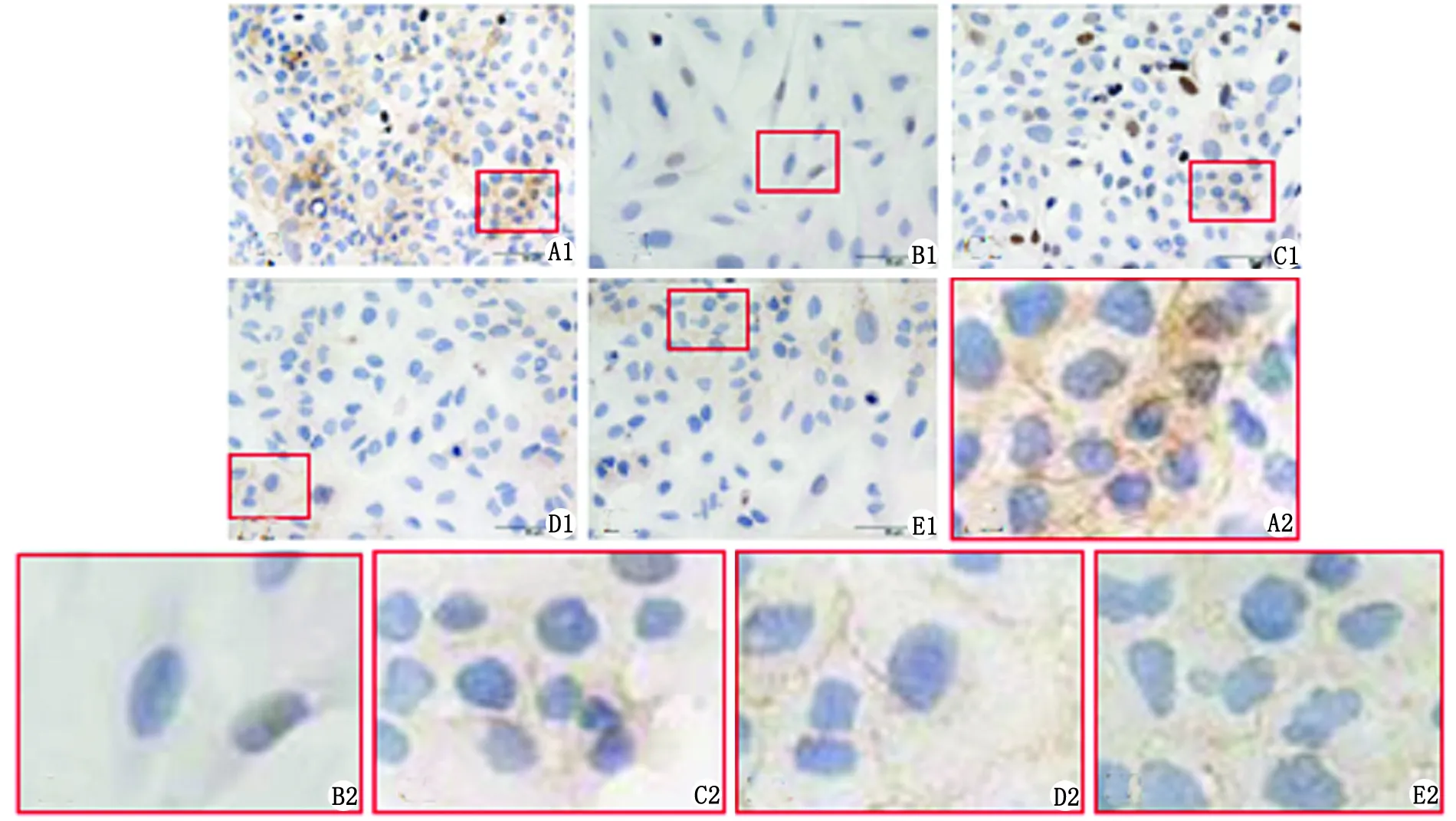
A:对照组细胞呈铺路石状,E-cad阳性表达;B:AngⅡ刺激组细胞变为长梭形或者纺锤形,E-cad阴性或弱阳性表达;C(AngⅡ+缬沙坦处理组)、D(AngⅡ+Ac-SDKP处理组)和E(AngⅡ+PD98059处理组):细胞形态较对照组变化不明显,偶见长梭形或者纺锤形细胞,细胞E-cad表达呈弱阳性. A2~E2为A1~E1的局部放大.图1 人肺泡Ⅱ型上皮细胞E-cad的表达Fig 1 The expression of E-cad in human type Ⅱ alveolar epithelial cells
2.2 免疫荧光细胞化学染色法检测各组细胞α-SMA及P-ERK1/2的共定位表达 AngⅡ刺激后,大部分细胞P-ERK1/2表达呈阳性,同时细胞胞体内出现了平行或交叉排列的肌丝样微结构,即α-SMA表达显著增强。予以缬沙坦、Ac-SDKP或PD98059的预处理明显抑制了AngⅡ诱导的A549细胞P-ERK1/2和α-SMA表达(图2)。
2.3 Western-blot法检测各组细胞E-cad、α-SMA、Ⅰ型胶原、AT1、P-ERK1/2及ERK1/2的定量表达 AngⅡ刺激48 h后,上皮标志物E-cad蛋白表达下调,是对照组的39.4%;而AngⅡ刺激下α-SMA、Ⅰ型胶原、AT1和P-ERK1/2的表达显著增高,分别是对照组的19.04,8.67,1.76及5.39倍,差别具有统计学意义(P<0.05)。而缬沙坦、Ac-SDKP、PD98059均能够显著降低AngⅡ诱导的A549细胞α-SMA、Ⅰ型胶原、AT1的表达升高,降低AngⅡ诱导的E-cad表达下降。其中,缬沙坦、Ac-SDKP、PD98059预处理组的α-SMA蛋白表达分别为AngⅡ诱导组的16.2%,15.1%及51.1%;Ⅰ型胶原分别为AngⅡ诱导组的52.0%,27.6%及62.2%;AT1蛋白表达分别为AngⅡ诱导组的65.2%,33.6%及33.4%;P-ERK1/2蛋白表达分别为AngⅡ诱导组的41.3%,58.2%及19.7%;E-cad蛋白表达分别为AngⅡ诱导组的2.37,1.63及1.96倍,差别具有统计学意义(P<0.05,表1,图3)。
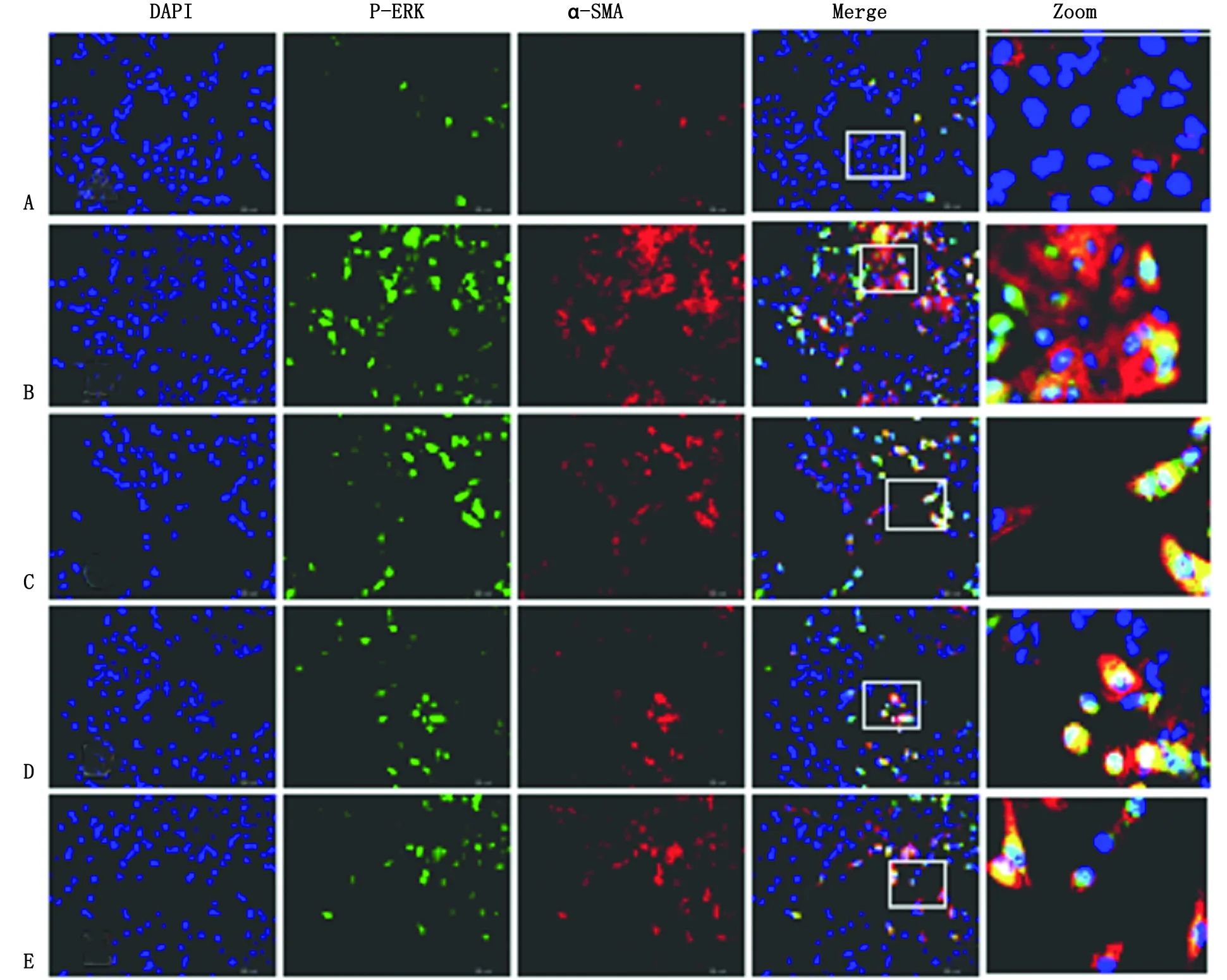
A:对照组细胞内α-SMA、P-ERK1/2表达阴性;B:AngⅡ刺激组大部分细胞胞体内出现了平行或交叉排列的肌丝样微结构,P-ERK1/2阳性表达;C(AngⅡ+缬沙坦处理组)、D(AngⅡ+Ac-SDKP处理组)和E(AngⅡ+PD98059处理组):3组少数细胞α-SMA、P-ERK1/2共阳性表达.图2 人肺泡Ⅱ型上皮细胞α-SMA及P-ERK1/2的共定位表达Fig 2 The co-expression of α-SMA and P-ERK1/2 in human type Ⅱ alveolar epithelial cells
3 讨 论
矽肺是常见的、危害严重的职业性尘肺病。尽管国内外在矽肺的防治方面做了大量工作,但是由于矽肺发病的具体机制尚不十分明确,所以目前控制或减少矽肺病发生的工作重点仍放在如何采取有效的防护措施上,而针对矽肺患者仍缺乏有效的治疗手段和药物来阻抑矽肺纤维化带来的肺部病变和损伤。因此,探讨矽肺的发病机制和寻求有效的抑制矽肺纤维化治疗措施一直是职业病防治研究领域中的重要课题。
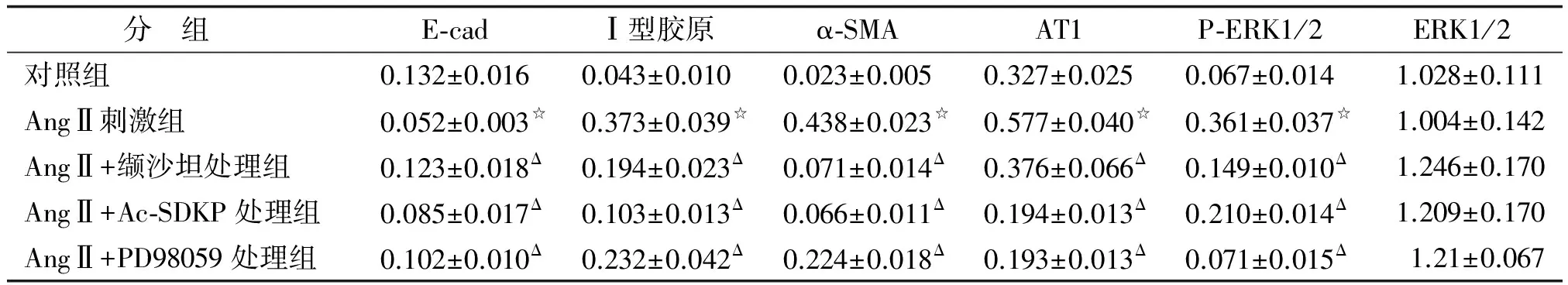
表1 人肺泡Ⅱ型上皮细胞E-cad、α-SMA、Ⅰ型胶原、AT1、P-ERK1/2及ERK1/2的定量表达
AngⅡ:血管紧张素Ⅱ; E-cad:E-钙黏蛋白; α-SMA:α-平滑肌肌动蛋白; AT1:血管紧张素受体1; P-ERK:磷酸化细胞外信号调节激酶. 与对照组比较,☆:P<0.05;与AngⅡ刺激组比较,Δ:P<0.05.

AngⅡ:血管紧张素Ⅱ; E-cad:E-钙黏蛋白; α-SMA:α-平滑肌肌动蛋白; AT1:血管紧张素受体1; P-ERK:磷酸化细胞外信号调节激酶. 1:对照组;2:AngⅡ刺激组;3:AngⅡ+缬沙坦处理组;4:AngⅡ+Ac-SDKP处理组;5:AngⅡ+PD98059处理组.图3 人肺泡Ⅱ型上皮细胞E-cad、Ⅰ型胶原、α-SMA、AT1、P-ERK1/2及ERK1/2的定量表达Fig 3 The expressions of E-cad, collagen typeⅠ, α-SMA, AT1, P-ERK1/2 and P-ERK1/2 in human type Ⅱ alveolar epithelial cells
Ac-SDKP是1989年首次从胎牛骨髓中提取的四肽,它广泛存在于人体的血液和组织中,近年来的研究证实,Ac-SDKP具有抗器官纤维化作用,能够通过抑制靶器官胶原的沉积,减轻致病因素导致的器官纤维化的程度,具有潜在的药用开发价值[7-10]。本课题组首次报道了Ac-SDKP具有抗矽肺纤维化的作用,证实矽肺纤维化发生过程中,存在上皮细胞向肌成纤维细胞的转化,Ac-SDKP能够通过抑制上皮细胞向肌成纤维细胞分化而发挥其抗矽肺纤维化的作用,然而其具体机制仍需进一步研究探讨[11-13]。
已有研究表明,RAS在多种器官(如肝、肾、肺等)的纤维化形成过程中具有重要作用[14-16]。Ac-SDKP是RAS重要的生理性调节肽,在体内可被ACE的N端清除,而肺又是RAS的靶器官之一。基于以上研究,推测RAS系统在Ac-SDKP抗矽肺纤维化作用中可能发挥着重要作用。本研究发现,AngⅡ刺激后,A549细胞形态由原来的铺路石状变为长梭形或者纺锤形,上皮细胞标记蛋白E-cad表达下调,同时出现Ⅰ型胶原以及肌成纤维细胞标记物α-SMA的表达,提示在AngⅡ刺激下,Ⅱ型肺泡上皮细胞发生了向肌成纤维细胞的转化。此外,在AngⅡ诱导上皮-间质转化发生的同时,A549细胞AT1以及P-ERK1/2的表达出现上调,而采用AT1抑制剂(缬沙坦)和ERK1/2信号阻断剂(PD980589)预处理后再给予AngⅡ刺激,则AngⅡ的上述作用减弱,提示AngⅡ能够通过其受体AT1蛋白活化ERK1/2通路,从而诱导上皮-间质转化的发生。另一方面,采用Ac-SDKP对A549细胞进行预处理后再给予AngⅡ刺激,结果发现Ac-SDKP具有类似缬沙坦和ERK1/2信号阻断剂的作用,即Ac-SDKP抑制AngⅡ诱导的上皮-间质转化的同时,抑制了AT1蛋白的表达以及ERK1/2通路的活化。本研究结果提示,Ac-SDKP可通过对AngⅡ-AT1-ERK1/2通路的调控而抑制肺泡Ⅱ型上皮细胞向肌成纤维细胞的分化,进而抑制胶原的合成而发挥抗矽肺纤维化作用。这为将Ac-SDKP开发为一种有效的抗矽肺纤维化药物提供了进一步的理论与实验依据。
[1] Falke L L, Shima G, Roel G,etal. Diverse origins of the myofibroblast implications for kidney fibrosis[J].NatRevNephrol, 2015,11(4):233-244.
[2] Hong X, Fang Y, Ying S,etal. A new antifibrotic target of Ac-SDKP: inhibition of myofibroblast differentiation in rat lung with silicosis[J].PloSOne, 2012,7(7):e40301-e40301.
[3] Franco K, Boris H, White E S. The myofibroblast matrix: implications for tissue repair and fibrosis[J].JPathol, 2013,229(2):298-309.
[4] Zielonka T M, Zycinska K, Chorostowska-Wynimko J,etal. Angiogenic activity of sera from interstitial lung disease patients in relation to angiotensin-converting enzyme activity[J].AdvExpMedBiol, 2013,756:213-221.
[5] 尹 刚, 朱为勇, 张 华, 等. 坎地沙坦对染尘大鼠肺纤维化的影响[J]. 中华劳动卫生职业病杂志, 2012,30(4):250-254.
[6] Danilov S M, Wade M S, Schwager S L,etal. A novel angiotensin I-converting enzyme mutation (S333W) impairs N-domain enzymatic cleavage of the anti-fibrotic peptide, Ac-SDKP[J].PloSOne, 2014,9(2):e88001.
[7] Yang F, Yang X P, Liu Y H,etal. Ac-SDKP reverses inflammation and fibrosis in rats with heart failure after myocardial infarction [J].Hypertension,2004, 43(2):229-236.
[8] Worou M E, Liao T D, D’Ambrosio M,etal. Renal protective effect of N-acetyl-seryl-aspartyl-lysyl-proline in Dahl salt-sensitive rats [J].Hypertension, 2015, 66(4):816-822.
[9] Zhang L, Xu L M, Chen Y W,etal. Antifibrotic effect of N-acetyl-seryl-aspartyl -lysyl-proline on bile duct ligation induced liver fibrosis in rats [J].WorldJGastroenterol, 2012,18(37):5283-5288.
[10] Conte E, Iemmolo M, Fruciano M,etal. Effects of thymosin β4 and its N-terminal fragment Ac-SDKP on TGF-β-treated human lung fibroblasts and in the mouse model of bleomycin-induced lung fibrosis [J].ExpertOpinBiolTher, 2015, 15 (Suppl 1):211-221.
[11] Sun Y, Yang F, Yan J B,etal. New anti-fibrotic mechanisms of N-acetyl-seryl-aspartyl-lysyl-proline in silicon dioxide-induced silicosis [J].LifeSciences, 2010, 87(7-8):232-239.
[12] 张丽娟, 李 倩, 徐 洪, 等. PDGF/ROCK通路在AcSDKP抑制大鼠矽肺纤维化形成中的作用[J]. 吉林大学学报:医学版, 2015,41(3):496-500.
[13] Deng H J, Yang F, Xu H,etal. Ac-SDKP suppresses epithelial mesenchymal transition in A549 cells via HSP27 signaling[J].ExpMolPathol, 2014,97(1):176-183.
[14] Kim G, Kim J, Lim Y L,etal. Renin angiotensin system inhibitors and fibrosis in chronic liver disease: a systematic review[J].HepatolInt, 2016:1-10.
[15] Gopallawa I, Uhal B D. Angiotensin-(1-7)/mas inhibits apoptosis in alveolar epithelial cells through upregulation of MAP kinase phosphatase-2[J].AmJPhysiolLungCellMolPhysiol, 2016,310(3):240-248.
[16] Simões E Silva A C, Teixeira M M. ACE inhibition, ACE2 and angiotensin-(1-7) axis in kidney and cardiac inflammation and fibrosis[J].PharmacolRes, 2016,107:154-162.
(编辑:何佳凤)
Effect and Mechanism of the Anti-fibrotic Tetrapeptide Ac-SDKP on the Differentiation of Human Type Ⅱ Alveolar Epithelial Cell into Myofibroblasts Induced by AngⅡ
JIN Fuyu, ZHANG Hui, LI Qian, XU Hong, YANG Fang, ZHANG Lijuan
Medical Experiment Research Center, North China University of Science and Technology, Tangshan 063000, China
Objective To investigate the regulation effect and mechanism of the anti-fibrotic tetrapeptide (N-acetyl-seryl-aspartly-lysyl-proline, Ac-SDKP) on the differentiation of human type Ⅱ alveolar epithelial cell into myofibroblasts induced by angiotensin(Ang Ⅱ). Methods Expressions of E-cad and α-SMA cells were detected by immunohistochemistry. Coexpression of SMA and P-ERK1/2 was detected by confocal laser scanning microscopy. Expressions of E-cad, α-SMA, collagen type Ⅰ, AT1, P-ERK1/2 and ERK1/2 were quantitatively analyzed by Western-blot method. Results Compared with the control group, the expression of E-cad in Ang Ⅱ induced cells decreased. At the same time, expressions of α-SMA, type Ⅰ collagen, AT1 and P-ERK1/2 were increased compared with that in control group. However, Ac-SDKP, Valsartan and PD98059 reduced expressions of α-SMA, type Ⅰ collagen, AT1 and P-ERK1/2 which were induced by Ang Ⅱ, while increased the expression of E-cad expression. Conclusion Ang Ⅱ -AT1-ERK1/2 pathway mediates the differentiation of alveolar type Ⅱ epithelial cells into myofibroblasts, and Ac-SDKP can inhibit the differentiation of alveolar type Ⅱ epithelial cells into myofibroblasts by Ang Ⅱ -AT1-ERK1/2 pathway.
proline; ammonia; pulmonary alveoli/cytology; fibroblasts; renin-angiotensin system; angiotensin Ⅱ; silicosis; fibrosis
2016-11-02
国家自然科学基金(81472953);河北省自然科学基金(H201609170);河北省教育厅课题(ZC2016002);华北理工大学大学生创新创业训练计划项目(201414850126)
华北理工大学 医学实验研究中心,唐山 063000
靳馥宇,男,华北理工大学医学实验技术专业2014级本科在读
张丽娟. Email: 664382330@qq.com
R135.2; R329.24; R341.6; R341.7; R916.3
A
1672-4194(2017)02-0092-05
