IL-10对稳定转染HBx基因的HL-7702细胞增殖的影响
2017-08-07郑碧云陈治新王小众
张 洁, 郑碧云, 陈治新, 李 丹, 王小众
IL-10对稳定转染HBx基因的HL-7702细胞增殖的影响
张 洁, 郑碧云, 陈治新, 李 丹, 王小众
目的 探讨白细胞介素-10(IL-10)在稳定转染乙型肝炎病毒X(HBx)基因的HL-7702肝细胞增殖的作用及机制。 方法 CCK-8法测定HBx基因对HL-7702细胞增殖的作用及IL-10对HL-7702/HBx细胞增殖的作用;流式细胞术测定IL-10对HL-7702/HBx细胞凋亡的影响;RT-PCR法测定HBx基因对HL-7702细胞表达CDKN1B蛋白质mRNA的作用及IL-10对HL-7702/HBx表达CDKN1B mRNA的作用。 结果 CCK-8法显示,HL-7702/HBx细胞比HL-7702细胞和HL-7702/MOCK细胞增殖速度明显加快(P<0.05);80 ng/mL的IL-10作用24 h可抑制HL-7702/HBx细胞增殖(P<0.05);流式细胞术显示,80 ng/mL的IL-10作用24 h对HL-7702细胞、HL-7702/HBx细胞及HL7702/MOCK细胞凋亡均无影响;RT-PCR法显示,HL-7702/HBx细胞CDKN1B mRNA表达量较HL-7702细胞和HL-7702/MOCK细胞降低(P<0.05),80 ng/mL的IL-10作用24 h后,HL-7702/HBx细胞较HL-7702/HBx空白组CDKN1B mRNA表达量上调(P<0.05)。 结论 HBx基因可促进HL-7702细胞增殖,IL-10可抑制HL-7702/HBx细胞增殖而对其凋亡无影响。HBx基因可能通过下调HL-7702/HBx细胞CDKN1B mRNA的表达量而促进细胞增殖,IL-10可能通过上调HL-7702/HBx细胞CDKN1B mRNA的表达量而抑制细胞增殖。
病毒蛋白质类; 肝细胞; 肝炎病毒,乙型; 白细胞介素10; *细胞转化,肿瘤; 细胞增殖
乙型肝炎病毒(hepatitis B virus, HBV)基因X区负责编码乙型肝炎病毒X蛋白(HBx)。HBx发挥生物学功能并不通过与HBV DNA的直接作用,而是通过和肝细胞内多种蛋白质相互作用而调节肝细胞的生物学性质[1]。HBx在调节肝细胞增殖和凋亡、细胞周期、基因转录和信号转导等方面均可发挥作用[2],在肝细胞癌(hepatocellular carcinoma, HCC)的发生及发展中起重要作用。白细胞介素-10(interleukin-10, IL-10)在多种肝病的预防和治疗中具有一定的应用前景,如IL-10水平的改变与肝脏损伤相关,水平降低时肝脏受损加重[3];动物模型实验也已证实,IL-10具有抑制肝纤维化的作用[4-5]。因此,本研究拟探讨HBx基因在肝细胞增殖、恶性转变中的作用,以及IL-10对HL-7702/HBx细胞增殖的作用及其可能的分子机制,为临床预防和治疗HBV相关性HCC提供一定的实验基础。
1 材料与方法
1.1 材料 HL-7702/HBx细胞(转染重组HBx慢病毒载体的HL-7702肝细胞)、HL-7702/MOCK细胞(转染慢病毒空载体的HL-7702肝细胞)、HL-7702细胞均为本实验室冻存。人IL-10(美国PeproTech公司);Cell Counting Kit-8(CCK-8, 日本Dojindo公司);Taq DNA聚合酶和MMLV逆转录试剂(美国Thermo公司);100 bp DNA Ladder(加拿大Fermentas公司);Annexin V-PE凋亡检测试剂盒(美国BD公司)。
1.2 方法
1.2.1 细胞培养 HL-7702、HL-7702/MOCK、HL-7702/HBx细胞加入10%胎牛血清的DMEM培养基,置37 ℃、体积分数为0.05的CO2、饱和湿度的培养箱培养,2~3 d换液1次,待细胞融合至70%左右开始传代,经0.25%的胰酶消化并传代,取对数生长期细胞用于实验。
1.2.2 稳定转染HBx基因对HL-7702细胞增殖的影响 取对数期生长的3组细胞,常规消化配成单细胞悬液,以每孔5 000个细胞接种于96孔板,设6个复孔,接3块板,分别培养24,48,72 h后取出,弃去原有培养液,用PBS洗涤后,加入混合液(CCK-8∶培养基=10 μL∶100 μL),继续培养2 h,于450 nm下检测每孔吸光度(OD450 nm)。
1.2.3 IL-10对稳定转染HBx基因的HL-7702细胞增殖的影响 将备用的HL-7702/HBx细胞分成5组:对照组(不加IL-10)及加入20,40,60,80 ng/mL的IL-10组。常规消化配成单细胞悬液,以每孔5 000个细胞接种于96孔板,设6个复孔,接3块板,各相应浓度的药物作用各组细胞,3块板分别作用24,48,72 h后采用CCK-8法检测,选择最佳抑制浓度和时间。另将细胞分为6组:HL-7702空白组及干预组、HL-7702/MOCK空白组及干预组、HL-7702/HBx空白组及干预组。各空白组不加IL-10试剂,各干预组加入最佳抑制浓度的IL-10。取对数期生长的细胞,常规消化,按每孔5 000个细胞接种于96孔板,同步化后各空白组更换培养基,各干预组更换IL-10,作用时间为上述实验得到的IL-10最佳抑制时间,CCK-8法检测。
1.2.4 流式细胞术检测细胞凋亡 实验分为6组,具体分组同1.2.3。各空白组不加IL-10试剂,各干预组加入最佳抑制浓度的IL-10。取对数期生长的细胞,常规消化,单细胞悬液接种于6孔板,细胞密度为5×105mL-1,每孔2 mL。培养贴壁后,空白组更换培养基,干预组加入IL-10,继续培养24 h,收集各组细胞,离心弃去上清,PBS洗涤,用100 μL Buffer将细胞浓度调整为1×105,分别加入5 μL Annexin V-PE和5 μL 7-AAD染液,混匀后避光作用,加入Buffer,流式细胞仪检测细胞凋亡率(早期凋亡细胞与晚期凋亡细胞的总凋亡率之和)。
1.2.5 RT-PCR检测CDKN1B mRNA的表达 实验分为4组:HL-7702细胞空白组、HL-7702/MOCK细胞空白组、HL-7702/HBx细胞空白组、HL-7702/HBx细胞干预组。各空白组不加IL-10试剂,干预组加入最佳抑制浓度的IL-10。Trizol法提取各组细胞总RNA,用酶标仪测RNA浓度,总RNA紫外分光光度计测OD260 nm及OD280 nm,标本总RNA的OD260 nm/OD280 nm均在1.6~1.8。
CDKN1B基因(扩增产物为317 bp):
上游:5’-GGTGCTTGGGAGTTTTGAATG-3’
下游:5’-TCCATACACAGGCAATGAAATAC-3’
人β-actin基因(扩增产物为600 bp):
上游:5’-GCATCGTGATGGACTCCG-3’
下游:5’-GCTGGAAGGTGGACAGCGA-3’
逆转录体系反应条件为42 ℃ 60 min→99 ℃5 min,逆转录产物-20 ℃保存。PCR反应体系反应条件:95 ℃预变性5 min→95 ℃变性45 s→55 ℃退火30 s→72 ℃延伸1 min,共进行30个循环,72 ℃延伸7 min。取PCR扩增产物在琼脂糖凝胶中电泳,在凝胶成像系统中观察结果并拍照记录。用Image J软件分析各条带的灰度值,以CDKN1B与β-actin灰度值比值作为CDKN1B mRNA的相对表达水平,并比较分析各组间的表达量差异。
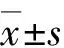
2 结 果
2.1 稳定转染HBx基因对HL-7702细胞增殖的作用 CCK-8法检测结果显示,各时间段(24,48,72 h)HL-7702/HBx细胞组的OD值均高于HL-7702及HL-7702/MOCK细胞组(P<0.05,图1),而HL-7702和HL-7702/MOCK细胞组间差别无统计学意义。HL-7702/HBx细胞组的生长曲线较另外2组细胞明显向左偏移,细胞生长速度明显加快(图2)。
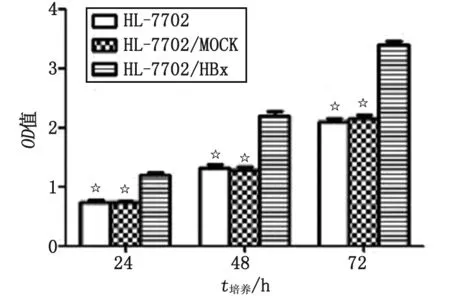
与HL-7702/HBx比较,☆:P<0.05.图1 CCK-8法检测3组细胞增殖Fig 1 Proliferation of three groups of cells detected by CCK-8 assay

图2 细胞生长曲线Fig 2 Cell growth curve
2.2 IL-10对HL-7702/HBx细胞增殖抑制最佳浓度和时间 作用24 h后,随着药物浓度的增加,细胞增殖抑制倾向逐渐加大,在80 ng/mL时有显著差异(P<0.05,表1)。在作用48和72 h后,各浓度均无明显变化(P>0.05)。故以80 ng/mL、作用24 h作为本实验IL-10对HL-7702/HBx细胞增殖抑制的最佳浓度和时间。
表1 不同浓度的IL-10在不同作用时间下对HL-7702/HBx细胞增殖的影响
Tab 1 Effects of IL-10 on the proliferation of HL-7702/HBx cells
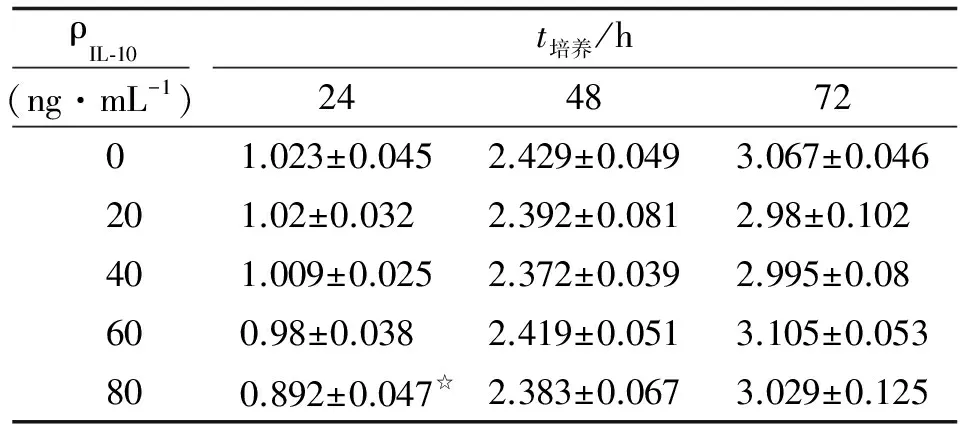
ρIL⁃10(ng·mL-1)t培养/h24487201.023±0.0452.429±0.0493.067±0.046201.02±0.0322.392±0.0812.98±0.102401.009±0.0252.372±0.0392.995±0.08600.98±0.0382.419±0.0513.105±0.053800.892±0.047☆2.383±0.0673.029±0.125
n=6. 表中数据为OD值. IL-10:白细胞介素10. 与0 ng/mL比较,☆:P<0.05.
2.3 IL-10对HL-7702,HL-7702/MOCK,HL-7702/HBx细胞增殖的作用 用CCK-8法检测80 ng/mL的IL-10作用24 h后6组细胞的活力,HL-7702及HL-7702/MOCK细胞的空白组与干预组的OD值差别均无统计学意义(P>0.05,图3),而HL-7702/HBx细胞的干预组比空白组的OD值明显减小(P<0.05,图3),说明IL-10对HL-7702/HBx细胞增殖具有抑制作用,而对HL-7702和HL-7702/MOCK细胞增殖无影响。

HL-7702/HBx空白组与干预组比较,☆:P<0.05.图3 IL-10对HL-7702,HL-7702/Mock及HL-7702/HBx 3组细胞增殖的影响Fig 3 Effects of IL-10 on the proliferation of the 3 groups of cells
2.4 IL-10对HL-7702,HL-7702/MOCK,HL-7702/HBx细胞凋亡的影响 对于HL-7702,HL-7702/MOCK及HL-7702/HBx 3组细胞,各细胞空白组和干预组间的比较差别均无统计学意义(P>0.05,表2,图4),说明IL-10对HL-7702,HL-7702/MOCK及HL-7702/HBx细胞凋亡均无影响。
2.5 IL-10对CDKN1B mRNA相对表达水平的影响 4组细胞均在317 bp处出现CDKN1B的阳性条带(图5)。与HL-7702空白组比较,HL-7702/MOCK空白组的CDKN1B mRNA相对表达量并无明显变化(P>0.05);与HL-7702空白组及HL-7702/MOCK空白组比较,HL-7702/HBx空白组的CDKN1B mRNA相对表达量明显下降(P<0.05),且HL-7702/HBx干预组较HL-7702/HBx空白组明显升高(P<0.05,图6)。
表2 6组细胞凋亡率比较
Tab 2 Compared the apoptosis rates of the six groups of cells
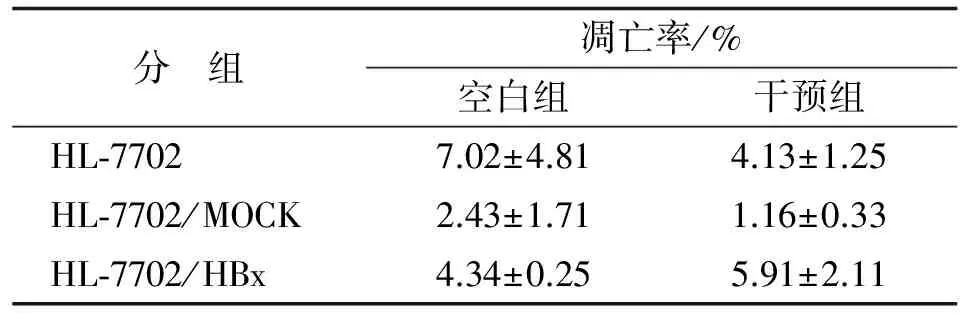
分 组凋亡率/%空白组干预组HL⁃77027.02±4.814.13±1.25HL⁃7702/MOCK2.43±1.711.16±0.33HL⁃7702/HBx4.34±0.255.91±2.11
n=3.
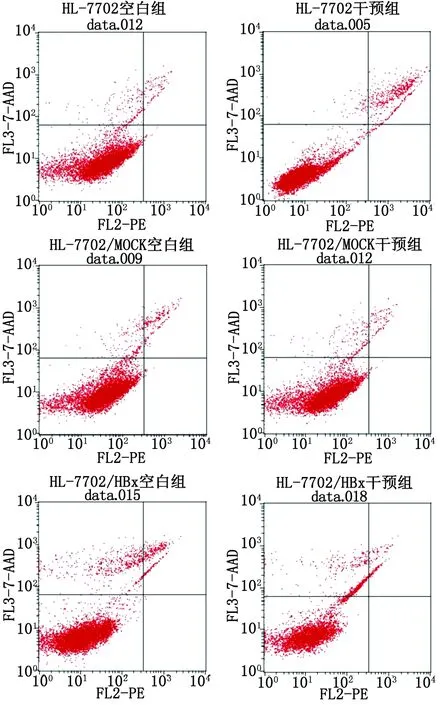
图4 各组细胞即刻凋亡流式细胞图Fig 4 Flow cytometry about apoptosis rates of cells in each group
3 讨 论
HBx可显著加快正常肝细胞的增殖速度,促进肝细胞向恶性增殖细胞发展[6-7],还可通过抑制细胞凋亡途径导致肝细胞凋亡受阻而诱发其恶性转化[8]。表明HBx可能通过介导肝细胞的增殖和凋亡,调节失衡,诱导肝细胞发生恶性转化,在HCC的起病和形成中扮演重要角色。本研究发现,HL-7702/HBx细胞增殖速度明显快于HL-7702细胞和HL-7702/MOCK细胞,进一步支持上述观点。

M:marker; 1,5:HL-7702空白组; 2,6:HL-7702/MOCK空白组; 3,7:HL-7702/HBx空白组; 4,8:HL-7702/HBx干预组.图5 RT-PCR法检测4组细胞CDKN1B mRNA的表达Fig 5 Expression of CDKN1B mRNA in 4 groups of cells as analyzed by RT-PCR
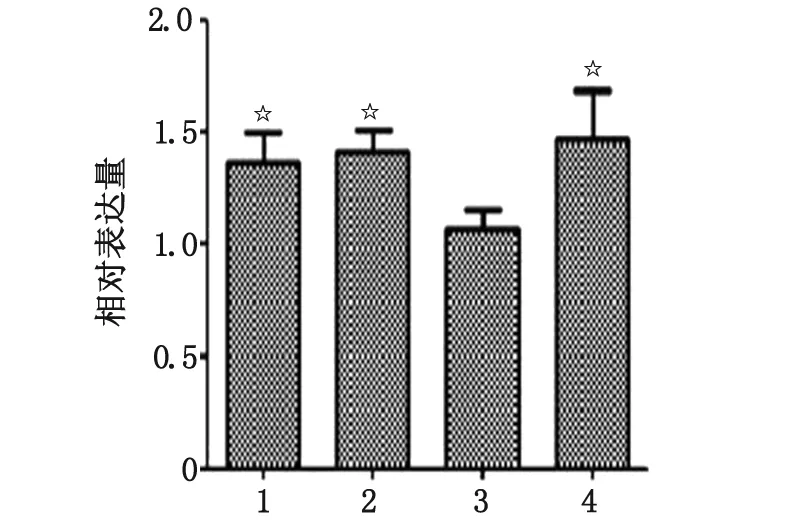
1:HL-7702空白组;2:HL-7702/MOCK空白组;3:HL-7702/HBx空白组;4:HL-7702/HBx干预组. 与HL-7702/HBx空白组比较,☆:P<0.05.图6 RT-PCR检测CDKN1B mRNA相对表达量Fig 6 Relative expression of CDKN1B mRNA analyzed by RT-PCR
IL-10作为一种已知的抑制性细胞因子,广泛参与炎症过程与免疫病理过程的负性调节。近年发现,IL-10的免疫活化功能亦可对肿瘤起到抑制作用[9-10],如在卵巢癌、乳腺癌等肿瘤中表达的IL-10,有利于抗肿瘤效应,表现为抑制肿瘤的生长及侵犯。研究表明,IL-10在肝病的治疗方面有一定的应用前景,如机体可通过刺激枯否氏细胞和肝星状细胞分泌IL-10减轻酒精性肝损害[11];IL-10可通过抑制肝星状细胞活化从而减轻肝纤维化[12]。值得注意的是,在抗HBx抗体阳性的慢性乙型病毒性肝炎、肝硬化及HCC患者体内,IL-10水平均明显升高,提示二者间存在关联,但具体关系尚不明确[13]。本研究发现,在使用20~80 ng/mL的IL-10干预的24 h内,随着药物浓度的增加,IL-10对HL-7702/HBx细胞增殖的抑制作用有加大的倾向,当浓度为80 ng/mL时,与空白组比较差别具有统计学意义,故选择80 ng/mL作用24 h为最佳实验条件。继续测定IL-10对HL-7702细胞和HL-7702/MOCK细胞增殖的影响,结果显示,2种细胞的干预组和空白组的细胞增殖速度并无差别,推测IL-10对HL-7702细胞和HL-7702/MOCK细胞的增殖并无影响。流式细胞术检测则发现,IL-10对HL-7702,HL-7702/HBx及HL-7702/MOCK细胞的凋亡均无明显影响。推测IL-10能抑制稳定转染HBx基因的HL-7702细胞的增殖而无促其凋亡的作用,说明IL-10对阻止HBx基因所致肝细胞增殖失控和恶性转化可能具有一定作用,预示IL-10在防治HBV相关性HCC可能具有潜在临床应用价值。
细胞周期调节失控是导致细胞恶性转变致肿瘤发生的重要环节。CDKN1B是细胞周期中一个重要的负性调控因子,许多恶性肿瘤的发生发展与其表达下调相关[14]。本研究结果显示,HL-7702/HBx细胞的CDNK1B mRNA的表达量较HL-7702细胞和HL-7702/MOCK细胞均下调,说明CDKN1B表达量的减少可能是HBx基因致HL-7702细胞恶性转化的机制之一。有报道指出,IL-10可通过上调细胞周期负调控蛋白P27的水平从而抑制心肌成纤维细胞增殖[15]。本研究结果与之相似,在使用80 ng/mL的IL-10作用24 h后,HL-7702/HBx干预组的CDKN1B mRNA表达量较空白组明显增高,提示IL-10抑制HL-7702/HBx细胞增殖的机制可能与其上调CDKN1B mRNA的表达有关,而具体机制还需运用更为精确的实验方法进一步验证与探讨。
[1] Kew M C. Hepatitis B virus x protein in the pathogenesis of hepatitis B virus-induced hepatocellular carcinoma[J].JGastroenterolHepatol, 2011,26(Suppl 1):144-152.
[2] Motavaf M, Safari S, Saffari J M,etal. Hepatitis B virus-induced hepatocellular carcinoma: the role of the virus x protein[J].ActaVirol, 2013,57(4):389-396.
[3] Jin X Y, Wang Y Q, Yan T,etal. Interleukin-10 gene promoter polymorphisms and susceptibility to liver cirrhosis[J].Hepatogastroenterology, 2014,61(130):442-446.
[4] Zhang L J,Zheng W D,Chen Y X,etal.Antifibrotic effects of interleukin-10 on experimental hepatic fibrosis[J].Hepatogastroenterology,2007,54(79):2092-2098.
[5] Mentink-Kane M M, Cheever A W, Wilson M S,etal. Accelerated and progressive and lethal liver fibrosis in mice that lack interleukin(IL)-10, IL-12p40, and IL-13Rα2[J].Gastroenterology, 201l,141:2200-2209.
[6] Tricia L, Gearhart, Michael J,etal. The hepatitis B virus HBx protein modulates cell cycle regulatory proteins in cultured primary human hepatocytes[J].VirusRes, 2011,155(1):363-367.
[7] Yang B, Bouchard M J. The hepatitis B virus X protein elevates cytosolic calcium signals by modulating mitochondrial calcium uptake[J].JVirol, 2012,86(1):313-327.
[8] Zhao J, Wu G B, Bu F F,etal. Epigenetic silence of ankyrin-repeat-containing, SH3-domain-containing,and proline-rich-region- containing protein 1 (ASPP1) and ASPP2 genes promotes tumor growth in hepatitis B virus-positive hepatocellular carcinoma[J].Hepatology, 2010,51:142-153.
[9] Kicielinska J, Pajtasz-Piasecka E. The role of IL-10 in the modulation of the immune response in normal conditions and the tumor environment[J].PostepyHigMedDosw, 2014,68:879-892.
[10] Mannino M H, Zhu Z, Xiao H,etal. The paradoxical role of IL-10 in immunity and cancer[J].CancerLett, 2015,15:451-456.
[11] Byun J S, Suh Y G, Yi H S,etal. Activation of toll-like receptor 3 attenuates alcoholic liver injury by stimulating Kupffer cells and stellate cells to produce interleukin-10 in mice[J].JHepatol, 2013,58(2):342-349.
[12] Huang Y H, Chen Y X, Zhang L J,etal. Hydrodynamics-based transfection of rat interleukin-10 gene attenuates porcine serum-induced liver fibrosis in rats by inhibiting the activation of hepatic stellate cells[J].IntJMolMed, 2014,34(3):677-686.
[13] Ding A K, Guo L W, Wang Y K,etal. Studies on mutual relationship between anti-HBx and sFas, IL-10 or IL-12 in sera of cases with chronic hepatitis B infection[J].InfectionInternational, 2014,3(2):49-53.
[14] Lee J, Kim S S. The function of P27Kip1during tumor development[J].ExpMolMed, 2009,41(11):765-771.
[15] 黄志刚, 赵连友, 郑强荪, 等. 白细胞介素10对AVP诱导心脏成纤维细胞增殖及p27蛋白表达的影响[J].第四军医大学学报, 2006,27(14):1256-1258.
(编辑:何佳凤)
The Effect of IL-10 on the Proliferation of HL-7702 Cells Stably Expressing HBx Gene
ZHANG Jie, ZHENG Biyun, CHEN Zhixin, LI Dan, WANG Xiaozhong
Department of Gastroenterology, Fujian Medical University Union Hospital, Fuzhou 350001, China
Objective To investigate the effect of interleukin-10(IL-10) on the proliferation of HL-7702 cells stably expressing hepatitis B virus X protein(HBx) gene. Methods Cell-counting Kit-8(CCK-8) assay were explored to detect the effect of HBx gene on the proliferation of HL-7702 cells and the effect of IL-10 on the proliferation of HL-7702 cells stably expressing HBx gene. Flow cytometry was used to analyze the effect of IL-10 on the apoptosis of HL-7702/HBx cells. RT-PCR was used to detect the effect of HBx gene on the expression of CDKN1B mRNA in HL-7702 cells and the effect of IL-10 on the expression of CDKN1B mRNA in HL-7702/HBx cells. Result The data of CCK-8 assay showed that the proliferation rate of HL-7702/HBx cells was significantly faster than HL-7702 and HL-7702/MOCK cells(P<0.05). The proliferation of the HL-7702/HBx cells was significantly inhibited after being treated with 80 ng/mL IL-10 for 24 hours(P<0.05). In addition, treatment of IL-10 of 80 ng/mL for 24 hours had no effects on the apoptosis of HL-7702, HL-7702/MOCK and HL-7702/HBx cells. Compared with HL-7702 and HL-7702/MOCK cells, the expression of CDKN1B mRNA level in HL-7702/HBx cells was decreased(P<0.05). After the treatment of 80 ng/mL IL-10 for 24 hours, the expression of CDKN1B mRNA level in HL-7702/HBx cells had increased(P<0.05). Conclusions HBx gene can promote the proliferation of HL-7702 cells. IL-10 can inhibit the proliferation of HL-7702/HBx cells but has no effect on the apoptosis. HBx gene probably enhances the proliferation of HL-7702/HBx cells by down-regulating the expression of CDKN1B mRNA. IL-10 can inhibit the proliferation of HL-7702/HBx cells which was probably related to the up-regulation of the expression of CDKN1B mRNA.
viral proteins; hepatocytes; hepatitis B virus; interleukin-10; cell transformation, neoplastic; cell proliferation
2016-08-01
福建省临床医学重点专科资助项目(闽卫科教[2012]149号);福建省自然科学基金青年项目(2016J05189);福建省卫生和计划生育委员会中青年骨干重点项目(2014-ZQN-ZD-9)
福建医科大学 附属协和医院消化科,福州 350001
张 洁,女,住院医师,医学硕士
王小众. Email: drwangxz@163.com
R341;R394;R73-37;R735.7;R977.6
A
1672-4194(2017)02-0077-05
