口腔肿瘤组织中HPV感染和P16蛋白表达的临床意义
2017-08-07丁淑琴解秀梅胡建国
丁淑琴,解秀梅,张 凯,洪 虓,王 锦,胡建国
(蚌埠医学院第一附属医院检验科,蚌埠 233004;*通讯作者,E-mail:59270847@qq.com)
口腔肿瘤组织中HPV感染和P16蛋白表达的临床意义
丁淑琴*,解秀梅,张 凯,洪 虓,王 锦,胡建国
(蚌埠医学院第一附属医院检验科,蚌埠 233004;*通讯作者,E-mail:59270847@qq.com)
目的 检测口腔肿瘤中HPV感染及P16蛋白表达率,并分析其临床意义。 方法 收集44例口腔肿瘤的新鲜组织标本,采用PCR法进行HPV DNA检测,免疫组化法检测肿瘤组织中P16的表达情况。分析HPV感染与P16的相关性。 结果 44例口腔肿瘤组织中HPV感染率为47.7%(21/44),P16阳性表达率为77.3%(34/44),44例标本中HPV感染与P16表达无关联(P>0.05)。与P16阴性组相比,P16阳性组男性、非吸烟、非饮酒者所占比例稍高,但没有统计学差异(P>0.05)。 结论 口腔肿瘤患者与HPV感染密切有关,口腔肿瘤患者P16表达和HPV感染无关联性,P16本身可能就可作为诱发口腔肿瘤发生的独立因素。
人乳头瘤病毒; 口腔肿瘤; P16
人乳头状瘤病毒(human papillomavirus, HPV)是某些皮肤和黏膜良恶性肿瘤的发病原因,尤其是宫颈癌发生的最重要原因。最近研究发现,HPV感染与头颈部肿瘤发病也有关,HPV感染相关的头颈部肿瘤患者数量不断增加[1,2]。HPV成为继烟草、酒精之后引发头颈部肿瘤发生的又一大因素[1,2],尤其是在口腔肿瘤、无抽烟及喝酒嗜好的病人中起重要作用[3-6],HPV有关的口腔肿瘤发生率呈快速增加趋势[7]。目前国外研究证实,HPV阳性的口腔肿瘤是一个独立的亚型,有独特的分子生物学及临床病理特点[8],影响口腔肿瘤患者的预后。但如今国内尚缺乏较大宗的临床资料来指导HPV相关口腔肿瘤的诊断和治疗,对口腔肿瘤与HPV感染相关性的病因学探讨也不多,其具体致病机制尚不清楚。另外,有研究报道,口腔肿瘤中P16抑癌基因的产物P16蛋白的表达与HPV感染密切相关,并有研究者建议可作为HPV的替代检测手段[9,10]。皖北地区是口腔肿瘤的多发地区之一,本地区口腔肿瘤中HPV的感染率如何?P16蛋白在口腔肿瘤组织的表达如何?HPV感染和P16蛋白相关性如何?这些都是我们需要回答的问题。
本研究中HPV-DNA检测采用SPF10[11,12]PCR-凝胶成像法,SPF10(short PCR fragment)PCR方法已经在宫颈鳞癌的研究中被建立及使用,但目前还很少用于口腔肿瘤的研究。SPF10的引物集扩增的是HPV DNA高度保守区L1区的一部分,产物长度为65 bp。本研究通过检测皖北地区口腔肿瘤中HPV感染及P16蛋白的表达,结合临床病例特点进行分析,以期为口腔肿瘤的初步诊断提供有用的指标及为临床治疗提供理论依据。
1 材料和方法
1.1 一般资料
收集2014-10~2015-10蚌埠医学院附属医院口腔科初治口腔肿瘤患者的组织44例,年龄26-79岁,平均年龄57岁,均经病理检查诊断,术前均未化疗或放疗。同时收集了该医院口咽部非肿瘤患者组织20例(包括口腔部外伤或鼾症矫形手术、炎症、囊肿)用作对照组。
1.2 取材方法

1.3 主要试剂
DNA提取试剂盒购于天根生化科技有限公司,HPV通用引物SPF10由上海生工合成,SPF10引物集的序列见表1,SPF10[6]的引物集扩增的是HPV DNA高度保守区L1区的一部分,产物长度为65 bp,为39种HPV型别核酸序列中6582-6646这段序列。这39种型别为HPV16,6,11,13,18,26,30,31,33-35,39,40,42-45,51-56,58,59,61,62,64,66-70,72-74,MM4,MM7,MM8,囊括了所有黏膜高危型(7种),目前被认为黏膜低危型别中除32型外也都囊括在内,详细内容参见文献[8,9]。PCR试剂盒为Thermo fish公司产品,兔抗人P16单克隆抗体购自abcam公司,SP免疫组织化学试剂盒购于福州迈新生物技术开发有限公司。
表 1 SPF10的引物集序列
Table 1 Sequences of SPF10 primers

SPFprimers序列(5′→3′) SPF1AGCiCAGGGiCACAATAATGGSPF1BGCiCAGGGiCATAACAATGGSPF1CGCiCAGGGiCATAATAATGGSPF1DGCiCAAGGiCATAATAATGGSPF2BGTiGTATCiACAACAGTAACAAASPF2DGTiGTATCiACTACAGTAACAAA
i:次黄嘌呤;SPF1:上游引物;SPF2:下游引物
1.4 SPF10 PCR法检测HPV-DNA
①将冷冻的组织标本匀浆,然后按试剂盒操作说明书进行人基因组DNA的提取。②使用HPV通用引物SPF10进行PCR扩增,扩增片段长度为65 bp。每次PCR反应都设有阴性质控(distilled H2O)和阳性质控(已知HPVHPV阳性标本)。③使用GAPDH作内参,GAPDH引物序列上游:5′-AGAAGGCTGGGGCTCATTTG-3′,下游:5′-AGGGGCCATCCACAGTCTTC′-3′。扩增产物长度为258 bp。④用3%琼脂糖电泳并成像。⑤结果判断:在65 bp处有明显条带者为HPV阳性。
1.5 免疫组化检测P16蛋白的表达
使用常规免疫组织化学法检测口腔肿瘤和口腔部非肿瘤组织中的P16蛋白的表达,P16一抗稀释度(1 ∶100),抗原修复采用0.01 mol/L柠檬酸盐缓冲液高压蒸汽修复法。用羊血清替代一抗作为阴性对照,用已知阳性切片作为阳性对照。
免疫组化结果判定:P16阳性染色为细胞核和胞质出现棕黄色颗粒。判定标准:采用半定量方法,采用高倍视野随机记数500个肿瘤细胞,按阳性细胞所占比例,分为4级,≤5%为阴性(-),>5%-25%为轻度阳性(+),>25%-75%为中度阳性(++),>75%以上为强阳性(+++)。由两位病理科医生双盲阅片并判定结果。
1.6 统计学方法
采用SPSS 19.0软件进行分析,计量资料采用t检验,计数资料采用卡方检验,P<0.05为差异具有统计学意义。
2 结果
2.1 口腔肿瘤与非肿瘤组织中HPV感染情况及其相关性
采用PCR法检测口腔肿瘤组织中HPV DNA(见图1)。选取阳性标本进行DNA测序鉴定(见图2),对测序结果进行B1ast比对,结果显示所获得的HPV DNA序列与GenBank中人HPV DNA相同(见图3)。本研究观察到44例口腔肿瘤患者中21例HPV阳性,阳性率47.7%;20例非肿瘤患者中2例HPV阳性,阳性率仅10.0%(见表2),口腔肿瘤患者可能与HPV感染密切有关(χ2=8.501,P=0.004)。

1-3.HPV阳性标本;4.HPV阴性标本;5.HPV阳性质控;6.阴性质控;M.DNA Marker图1 HPV DNA扩增产物琼脂糖电泳成像 Figure 1 Agarose electrophoresis of HPV DNA PCR production

图2 HPV PCR产物测序的图谱Figure 2 Sequencing of HPV PCR production

图3 HPV PCR产物测序结果的序列比对Figure 3 Sequence blast of HPV PCR production
表 2 口腔肿瘤与非肿瘤组织中HPV感染情况和P16蛋白表达情况
Table 2 HPV infection and P16 protein expression in oral neoplasms and non-neoplastic tissue

组织nHPVP16+-χ2P+-χ2P口腔部肿瘤 口腔部非肿瘤44203122318850100043401020329700000
2.2 不同HPV状态的口腔部肿瘤P16蛋白表达情况及其关联性
免疫组化检测P16蛋白在口腔肿瘤组织中表达,在细胞核或胞质出现棕黄色或棕褐色颗粒为阳性表达(见图4)。44例口腔肿瘤患者中34例P16阳性,阳性率77.3%,而20例非肿瘤患者P16均阴性。通过分析44例口腔标本,发现HPV与P16仅存在弱关联。21例HPV阳性患者中P16阳性18例(85.71%),但HPV阴性患者中P16阳性率也较高,为69.56%(16/23)(见表3)。提示除HPV外,某些其他因素也可使P16蛋白表达上调或P16本身就可作为诱发口腔肿瘤发生的独立因素。

A-C为口腔正常组织,D-F为口腔肿瘤组织;A,D.口腔肿瘤组织HE染色(×400);B,C,E,F.P16免疫组化结果(B,E.×100;C,F.×400)图4 P16在口腔肿瘤组织中的表达Figure 4 P16 protein expression in oral tumor
表 3 HPV阳性和阴性的口腔部肿瘤P16蛋白表达情况(以5%为界)
Table 3 P16 protein expression in HPV-positive and HPV-negative oral tumor

P16HPV⁃DNA(+)HPV⁃DNA(-)合计(+)181634(-)3710合计212344
2.3 口腔肿瘤患者HPV感染及P16蛋白表达与临床特征比较
HPV及P16的阳性组与阴性组相对比,年龄、性别、吸烟、饮酒、发病部位均差异无统计学意义(P>0.05),但HPV及P16的阳性组中男性、非吸烟、非饮酒者比例相对更高,但差异没有统计学意义(P>0.05,见表4)。
3 讨论
HPV是一种DNA病毒,属乳多空病毒科乳头状瘤病毒属。广泛存在于自然界中,是一组致瘤性病毒。因越来越多肿瘤被发现与HPV感染有关,使得HPV日益被人们重视及研究。随着分子生物学技术的发展,对HPV的致病机制有了进一步的认识。游离或整合状态的HPV-DNA潜入宿主细胞,引起一系列的变化,使细胞增殖和转化发生异常[13]。虽然HPV已被普遍公认为是一种肿瘤相关病毒,但过去较多的研究都集中在HPV与宫颈癌的关系上。近来,HPV与头颈部肿瘤的关系受到广泛的关注,并有一系列的报道阐述了HPV在不同部位的头颈部肿瘤中的表达,检出率为20%-100%不等[14]。本次研究表明HPV感染在口腔肿瘤中的感染率为47.7%,由于本次研究重点是探究HPV总感染率,未进行分型,仅随机抽取了3个HPV阳性标本的PCR扩增产物进行测序并比对,结果均为HPV16型,与报道的HPV16型是HPV阳性口腔肿瘤的最常见型别相符[15,16]。国外的大量临床试验结果均表明:与HPV阴性相比,HPV阳性口腔肿瘤患者肿瘤进展的风险较低,对放化疗治疗更加敏感,且预后明显好于HPV阴性口腔肿瘤患者[17,18]。因此,对于HPV阳性口腔肿瘤患者可考虑降低局部治疗的强度,包括降低放疗剂量、单纯放疗代替放化疗或用靶向治疗替代化疗。希望在不久的将来,我们能够根据HPV感染状态来判断口腔肿瘤患者的预后并指导治疗决策,为HPV阳性口腔肿瘤患者制定个体化的治疗方案以改善预后,降低治疗相关毒性,提高患者的生活质量。
表 4 口腔肿瘤患者HPV感染及P16蛋白表达与临床特征比较
Table 4 Correlation of HPV infection, P16 protein expression and other parameters in oral neoplasms
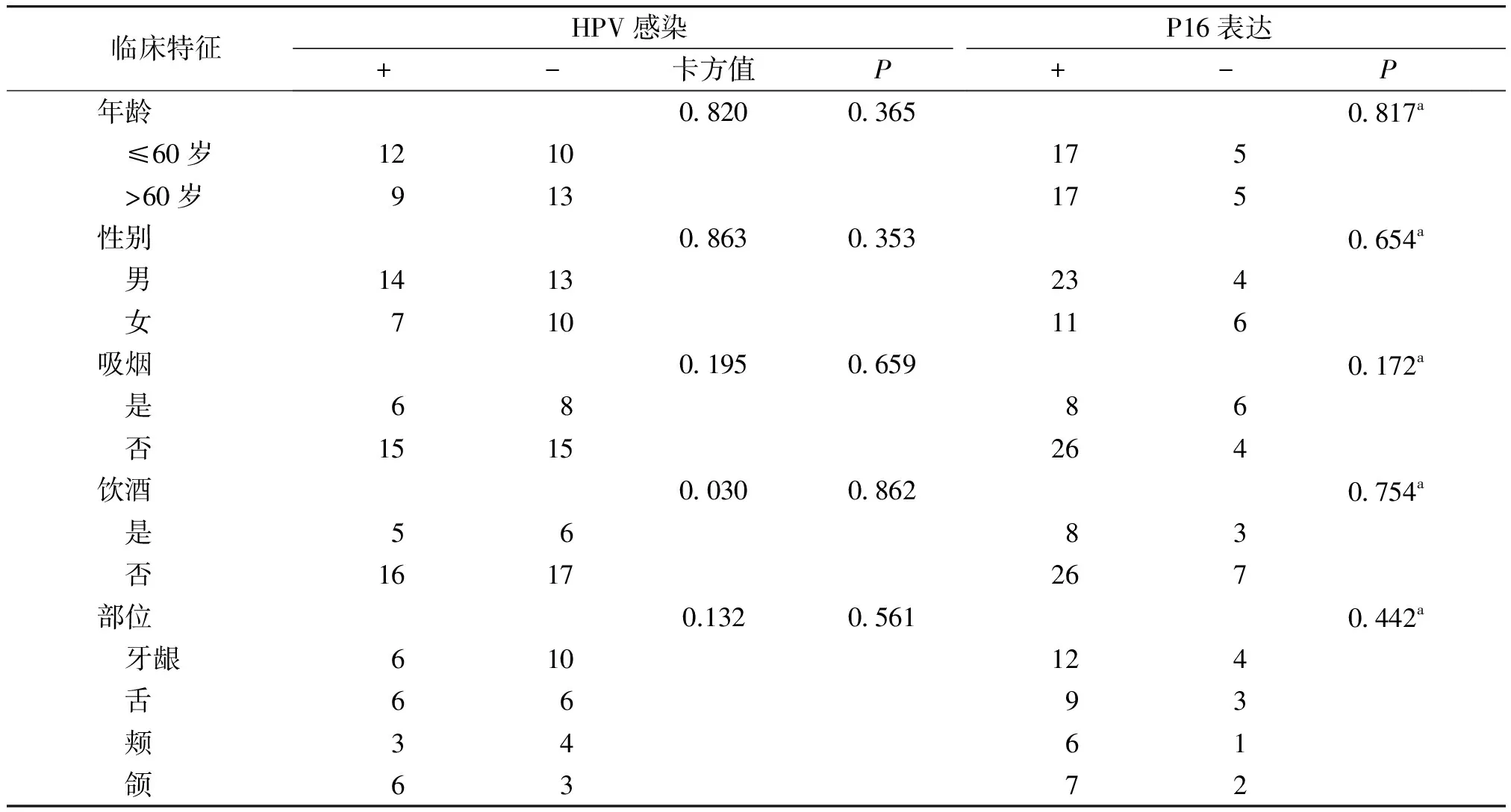
临床特征HPV感染+-卡方值PP16表达+-P年龄082003650817a ≤60岁1210175 >60岁913175性别086303530654a 男1413234 女710116吸烟019506590172a 是6886 否1515264饮酒003008620754a 是5683 否1617267部位0.13205610442a 牙龈610124 舌6693 颊3461 颌6372
a期望计数小于5,用Monte Carlo法计算
P16基因又叫MTS(multiple tumor suppressor 1)基因,是一种多肿瘤的抑制基因。到目前为止,已经在人类的许多恶性肿瘤及头颈部肿瘤中检测到P16基因的改变[19],引起许多学者在多领域的广泛研究。有研究表明P16基因在口腔颌面部多种恶性肿瘤中表现异常[20]。最近有学者报道,在口腔肿瘤患者中P16蛋白的表达与HPV感染密切相关,并认为可以将较廉价且操作相对简单的P16免疫组化作为HPV感染检测的替代检测手段[9,10];而有些学者则报道在口腔肿瘤中没有发现P16表达与HPV感染的相关性,不主张将P16表达状态作为HPV感染强有力的替代检测指标[21-23]。本研究中虽然21例HPV阳性口腔肿瘤中有18例P16蛋白阳性,但P16蛋白在23例HPV阴性口腔肿瘤中也有16例阳性,P16在HPV阳性与HPV阴性口腔肿瘤中的表达没有统计学上的差异(P>0.05)。本研究结果与Harris等[24]的研究结果一致,Harris等研究表明,其所观察的年轻舌癌患者中,在HPV低感染的前提下,仍有P16的高表达,提示P16可以作为诱发年轻舌癌患者的独立因素[24]。本研究中,P16蛋白阳性的口腔肿瘤中只有52.94% HPV阳性(18/34),故推测P16本身就可作为诱发口腔肿瘤发生的独立因素。国外一些研究显示,P16蛋白高表达的口腔肿瘤患者有更好的治疗效果和预后[26]。希望随着研究的深入,P16基因能为口腔肿瘤乃至其他肿瘤的预防、诊断和治疗提供新的思路。
本课题组分析了HPV和P16与口腔肿瘤患者烟酒嗜好乃至性别等的关系,结果表明,与HPV阴性组相比,HPV阳性组男性、非抽烟、非嗜酒者所占比例较高,但差异没有统计学意义(P>0.05);与P16蛋白阴性组相比,P16阳性组男性、非抽烟、非嗜酒者所占比例也较高,差异也没有统计学意义(P>0.05)。
综上所述,本研究表明:HPV是口腔肿瘤发生的重要致瘤因素;P16也可能是诱发口腔肿瘤发生的独立因素。但因本研究样本例数有限,结果尚带有偶然性,仍需扩大样本量进一步研究。
[1] Goldenberg Malhotra J, Praud D, Boffetta P. Changes in the trend of alcohol-related cancers:perspectives on statistical trends[J].Chem Res Toxucol, 2015, 28(9):1661-1665.
[2] Young D, Xiao CC, Murphy B,etal. Increase in head and neck cancer in younger patients due to human papillomavirus (HPV)[J]. Oral oncol,2015,51(8): 727-730.
[3] Portugal LG, Goldenberg JD, Wenig BL,etal.Human papillomavirus experssion and p53 gene mutations in squamous cell carcinoma[J]. Arch Otolaryngol Head Neck Surg, 1997,123(12):1230-1234.
[4] Chaturvedi AK, Anderson WF, Lortet-Tieulent J,etal. Worldwide trends in incidence rates for oral cavity and oropharyngeal cancers[J]. J Clin Oncol,2013,31:4550-4559.
[5] Dalianis T. Human papillomavirus (HPV) and oropharyngeal squamous cell carcinoma[J]. Presse Med,2014,3:429-434.
[6] 张春林,陈月红,邓泽义,等. 中国口腔癌中高危型HPV感染率的Mate分析[J]. 中华肿瘤防治杂志,2016,23(10):682-689.
[7] Nasman A, Attner P, Hammarstedt L,etal. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden:an epidemic of viral-induced carcinoma?[J]. Int J Cancer, 2009, 125: 362-366.
[8] Marur S, D′Souza G, Westra WH,etal. HPV-associated head and neck cancer: a virus-related cancer epidemic[[J]. Lancet Oncol, 2010, 11(8): 781-789.
[9] Adel K, El-Naggar, MD,etal. P16 Expression as s surrogate marker for HPV-related oropharyneal carcinoma: a guide for interpretative relevance and consistency[J]. Head Neck, 2012, 4:459-461.
[10] Agrawal GP, Joshi PS and Agrawal A,etal. Role of HPV-16 in pathogenesis of oral epithelial dysplasia and oral squamous cell carcinoma and correlation of p16ink4a expression in hpv-16 positive cases: an immunohistochemical study[J].ISRN Pathology, 2013, 7:110-117.
[11] Kleter B, van Doorn LJ, ter Schegget J,etal. A novel short-fragment PCR assay for highly sensitive broad-spectrum detection of anogenital human papillomaviruses[J]. Am J Pathol, 1998, 153:1731-1739.
[12] Kleter B, van Doorn LJ, Schrauwen L,etal. Development and clinical evaluation of a highly sensitive PCR-reverse hybridization line probe assay for detection and identification of anogenital human papillomavirus[J]. J Clin Microbiol, 1999, 37:2508-2517.
[13] Iaconis L, Hyjek E, Ellenson LH,etal. P16 and Ki-67 immunostaining in atypical immature squamous metaplasia of the uterine cervix: correlation with human papillomavirus detection[J]. Arch Pathol Lab Med, 2007, 131:1343-1349.
[14] Tornesello ML, Perri F, Buonaguro L,etal. HPV-related oropharyngeal cancers: from pathogenesis to new therapeutic approaches[J]. Cancer Lett, 2014, 351:198-205.
[15] Dalianis T. Human papillomavirus (HPV) and oropharyngeal squamous cell carcinoma[J]. Presse Med, 2014, 43: 429-434.
[16] Ribeiro MG, Marcolino LD, Ramos BR,etal. High prevalence of human papillomavirus (HPV) in oral mucosal lesions of patients at the Ambulatory of Oral Diagnosis of the Federal University of Sergipe, Northeastern Brazil[J].Appl Oral Sci, 2017, 25(1):69-74.
[17] Ang KK,Harris J,Wheeler R,etal. Human papillomavirus and survival of patients with oropharyngeal cancer[J]. N Engl J Med, 2010, 363:24-35.
[18] Fakhry C. Improved survival of patients with human papillomavirus-positive head and neck squamous cell carcinoma in a prospective clinical trial[J]. J Natl Cancer Inst, 2008, 100:261-269.
[19] O′Regan EM,Toner ME,Finn SP,etal.P16 (INK4A) genetic and epigenetic profiles differ in relation to age and site in head and neck squamous cell carcinomas[J]. Hum Pathol, 2008, 39 (3): 452.
[20] Liu Y, Sharpless NE. Tumor suppressor mechanisms in immune aging[J]. Curr Opin Immunol, 2009, 21(4): 431-439.
[21] kayanunt PR, Morita K, Matsukawa S,etal. Lack of Association between High-risk Human Papillomaviruses and Oral Squamous Cell Carcinoma in Young Japanese Patients[J]. Asian Pac J Cancer Prev, 2014, 15(10): 4135-4141.
[22] Heinzel PA, Balaram P, Bernard HU,etal. Mutations and polymorphisms in the p53, p21 and P16 genes in oral carcinomas of Indian betel quid chewers[J]. Int J Cancer, 1996, 68: 420-423.
[23] Mark E, Zafereo, Li Xu,etal. Squamous cell carcinoma of the oral cavity often overexpresses P16 but is rarely driven by human papillomavirus[J].Oral Oncol, 2016, 56:47-53.
[24] Harris SL, Thorne LB, Seaman WT. Association of P16INK4a overexpression with improved outcomes in young patients with squamous cell cancers of the oral tongue[J]. Wiley Online Library, 2010, 5: 1622-1627.
[25] Saito Y, Yoshida M, Ushiku T,etal. Prognostic value of P16 expression and alcohol consumption in Japanese patients with oropharyngeal squamous cell carcinoma[J]. Cancer, 2013, 119 (11): 2005-2011.
Clinical value of HPV infection and P16 protein expression in oral neoplasms
DING Shuqin*,XIE Xiumei,ZHANG Kai,HONG Xiao,WANG Jin,HU Jianguo
(DepartmentofClinicalLaboratory,FirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China;*Correspondingauthor,E-mail:59270847@qq.com)
ObjectiveTo investigate the infection rate of human papillomavirus(HPV) and P16 protein expression in oral neoplasm tissues and their clinical value.MethodsHPV DNA was detected by PCR and P16 protein was determined in 44 cases of oral tumor tissue by immunohistochemistry. The correlation of HPV infection with P16 protein expression was assessed.ResultsThe incidence of HPV infection in oral tumor was 47.7%(21/44).The P16 was expressed in 77.3%(34/44) of the tumor tissues.The P16 protein expression was not correlated with the presence of HPV infection in 44 specimens(P>0.05). The proportions of male non-smokers and non-drinkers were higher in P16-positive group than in P16-negative group, respectively, but the difference was not statistically significance(P>0.05).ConclusionOral cancer is highly correlated with the infection of HPV, and P16 could be an independent risk factor for oral cancer.
oral neoplasms; HPV; P16 protein
安徽省高等学校自然科学研究一般项目(KJ2015B081by,KJ2015B052by);蚌埠医学院创新课题项目(Byycxz1508)
丁淑琴,女,1980-11生,硕士,主管技师,讲师,E-mail:59270847@qq.com
2017-02-28
R739.85
A
1007-6611(2017)07-0724-06
10.13753/j.issn.1007-6611.2017.07.019
