长链非编码RNA BANCR在恶性肿瘤中的研究进展
2017-06-24刘芳腾李金高
董 晴,刘芳腾,周 亮,李金高
长链非编码RNA BANCR在恶性肿瘤中的研究进展
董 晴1,2,刘芳腾3,周 亮4,李金高2
BANCR是由BRAF基因发生突变后产生的长链非编码RNA,在视网膜母细胞瘤、黑色素瘤、甲状腺乳头状癌、胃癌和肝癌中表达上调,而在结直肠癌、肺癌及膀胱癌中低表达。BANCR主要通过MEK/ERK、MAPK信号通路和TSH/TSHR/cAMP等信号通路对癌细胞增殖、转移、凋亡等过程进行调节;随着研究的不断深入,其有望成为潜在的肿瘤标志物。关键词:长链非编码RNA;BANCR;恶性肿瘤;肿瘤标志物
1 BANCR概述
研究表明,至少有90%的基因组序列转录为非编码RNA[1],其中长链非编码RNA是长度大于200个核苷酸的RNA分子,无编码蛋白质的功能,曾被认为是基因组中的“噪音”[2]。然而,越来越多的证据显示[3-5],长链非编码RNA在肿瘤基因转录翻译、表观遗传学、细胞分化、细胞迁移等生命活动中发挥重要作用,如BANCR、HOTAIR、SPRY4-ITl等非编码RNA在黑素瘤的致癌过程中发挥作用[6]。BANCR位于第9号染色体,全长693 bp的非编码RNA,由BRAF基因发生突变后产生[3]。目前,研究表明BANCR通过MEK/ERK/EMT、MAPK信号通路和TSH/TSHR/cAMP等信号通路调节恶性肿瘤的生物活性。
2 BANCR的生物学功能
最新研究表明,BANCR在某些肿瘤上调,如视网膜母细胞瘤、黑色素瘤、甲状腺乳头状癌、胃癌和肝细胞癌,而在结直肠癌、肺癌及膀胱癌中低表达。BANCR的重要功能是作为信号分子调控细胞代谢,其表达与多种恶性肿瘤的增殖及迁移密切相关,如在甲状腺乳头状癌中,BANCR可以通过激活自噬促进癌细胞增殖[1];在结直肠癌中,BANCR通过MEK/ERK信号通路诱导癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT)过程,进而促进结肠癌的转移[7]。由此可见,BANCR涉及不同的信号通路(图1),并在各癌细胞发挥其独特的作用。
3 BANCR与恶性肿瘤之间的关系
近年,随着对BANCR研究的深入,已发现许多恶性肿瘤的发生、发展与其密切相关,其中包括最早研究的黑色素瘤及随后的甲状腺乳头状癌、肺癌、食管癌、胃癌、结直肠癌等(表1)。
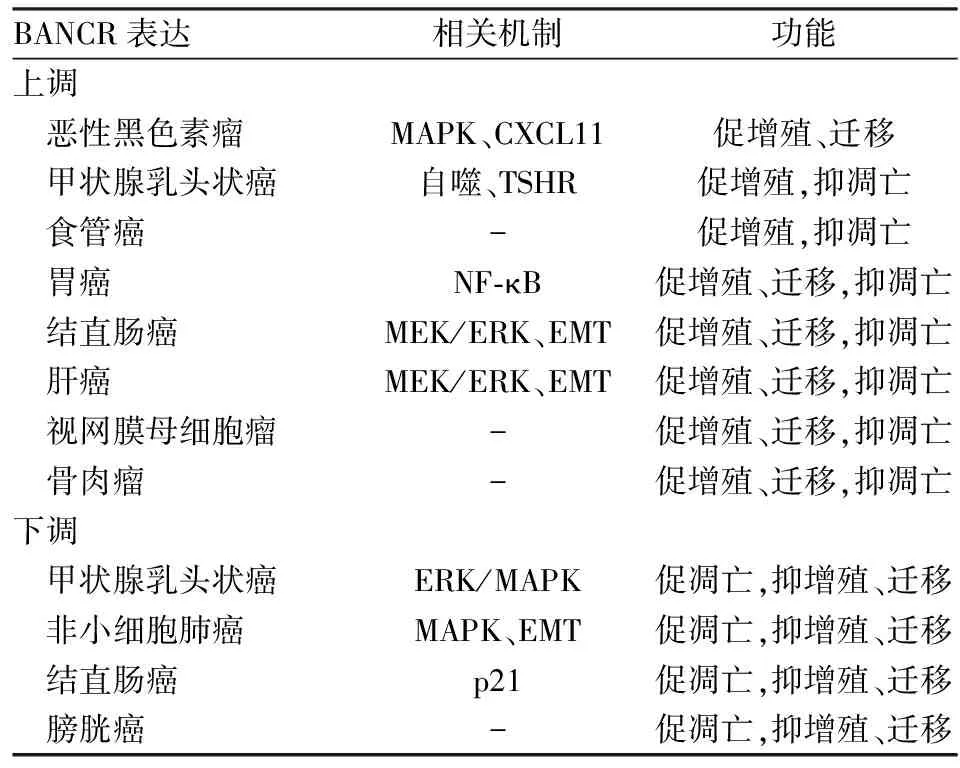
表1 BANCR在肿瘤中表达及其作用
3.1 BANCR与恶性黑色素瘤 BANCR最早由Flockhart等[3]于2012年在黑色素瘤中通过基因测序发现,BANCR调节RNA的转录。进一步分析发现,BANCR的敲除可引起黑色素瘤细胞迁移的重要介质CXCL11下调,减少黑色素瘤细胞的迁移,从而确定BANCR在黑色素瘤细胞迁移中起重要作用。
Li等[1]发现,BANCR在黑色素瘤组织与正常组织相比,其异常过表达。这种过表达与TNM分期呈显著正相关;与患者年龄、性别、地域等无关,且BANCR表达下调可抑制癌细胞增殖。研究发现,MAPK级联反应的异常调节可导致多种恶性肿瘤的发生,其终端的MAPK是ERK1/2、JNK、p38激酶和ERK5[1]。Western blot实验表明,BANCR可通过活化MAPK途径的ERK1/2和JNK成分促进黑色素瘤细胞增殖。此外,生存分析实验表明,BANCR高表达患者其总生存期明显低于低表达患者。提示BANCR在黑色素瘤中的机制及生物活性,为后续实验提供理论基础。

图1 BANCR基本调控途径
3.2 BANCR与甲状腺乳头状癌 Wang等[4]在甲状腺乳头状癌患者中发现BANCR表达上调,通过观察LC3-II/LC3-I的比率,发现BANCR过表达抑制细胞凋亡,促进细胞生长,其可以通过3-MA即自噬抑制剂来抑制。实验结果表明BANCR可通过激活自噬增加癌细胞增殖。在体外实验发现,BANCR对促进癌细胞迁移并无显著效果,这与Flockhart等在黑色素瘤中有关BANCR可调节细胞迁移的结论不一致,从而表明BANCR的功能具有特异性。
Zheng等[8]进一步分析发现,BANCR可通过结合组蛋白甲基转移酶EZH2富集,导致促甲状腺激素受体TSHR启动子转录上调,进而促进TSHR及其靶基因,包括Cyclin D1的表达,使处于G0/G1期的细胞减少,从而调控细胞生长和细胞周期。因此,BANCR可能是通过调节TSHR的表达影响甲状腺乳头状癌细胞的增殖和生长[9]。
Liao等[10-11]通过RT-PCR法证明BANCR在甲状腺乳头状癌组织和细胞系中表达下调,BANCR过表达可抑制细胞增殖、迁移和促进凋亡,从而提出BANCR可能作为甲状腺乳头状癌的肿瘤抑制物。这与文献报道有差异,可能是由于来自不同数量的组织样本及应用不同的细胞系有关。进一步实验证明,BANCR的过表达灭活ERK1/2和p38,提示BANCR通过ERK/MAPK信号通路发挥肿瘤抑制作用。上述结果提示BANCR可以作为人类甲状腺乳头状癌的潜在分子靶标。
3.3 BANCR与非小细胞肺癌 Sun等[5]在非小细胞肺癌的实验中发现,采用qRT-PCR等技术检测BANCR在肺癌组织中的表达明显低于正常组织,BANCR下调促进肿瘤细胞的侵袭和迁徙能力,并与肿瘤大小、病理分期、淋巴结转移及总生存期相关。同时,通过一系列细胞实验,证实BANCR过表达能上调E-cadherin蛋白的表达,下调E-cadherin、vimentin蛋白表达,影响EMT,从而抑制癌细胞的增殖和侵袭;但是BANCR调节EMT具体的分子机制仍需进一步探讨。Jiang等[12]报道肺癌中MAPK信号通路与BANCR调节之间的关系,发现BANCR过表达抑制p38蛋白和JNK的活化,进而影响肺癌细胞的增殖和迁移。在治疗肺癌过程中,Chen等[13]通过Western blot和免疫沉淀法发现通过HDAC3的介导,BANCR在暴露于辐射的组织中增加。这些发现进一步揭示了肺癌的癌变机制,从而促进该疾病诊疗的发展。
3.4 BANCR与消化系统肿瘤
3.4.1 BANCR与食管癌 Liu等[14]研究表明,在血浆中食管癌患者比正常对照组的BANCR水平明显升高,且BANCR高表达与食管癌患者TNM分期、淋巴结转移及更短的生存期相关。同时首次分析BANCR在食管癌发生、发展过程中的变化及其临床意义,证明从低级别到高级别上皮内病变时BANCR表达显著增加,但在手术后随着时间的推移,血浆中BANCR水平明显下降。因此,对于食管癌及食管鳞状上皮不典型增生患者,BANCR可能成为一种新型无创的早期检测肿瘤标志物。
3.4.2 BANCR与胃癌 最新的研究表明[15],BANCR在胃癌组织和细胞中高表达,并与临床分期、肿瘤浸润深度、淋巴结转移及远处转移呈正相关;BANCR过表达与患者的总生存期呈负相关。研究表明[16],NF-κB通路在多种肿瘤细胞中存在,NF-κB1是在炎症、应激反应、细胞分化/增殖和细胞死亡过程中的核心因素。Zhang等[17]通过大量细胞实验发现NF-κB1参与BANCR在胃癌细胞生长和凋亡过程。BANCR下调显著降低NF-κB1蛋白和NF-κB的30UTR的活性,并抑制细胞迁移及促进细胞凋亡,而NF-κB1的过表达逆转BANCR下调对癌细胞的生长和凋亡的影响。有文献报道[18]芬太尼通过NF-κB下调和PTEN上调,抑制胃癌细胞增殖。目前,还需进一步探讨BANCR在胃癌的调控过程中确切的分子机制。
3.4.3 BANCR与结直肠癌 Guo等[19]于2014年首次发现BANCR在结直肠癌中高表达,且BANCR高表达组的TNM分期更高,进一步调查BANCR表达与人类结直肠癌中HCT116细胞系迁移的关系时发现,BANCR下调与上调的E-cadherin蛋白和下调的vimentin蛋白表达相关联,并证明BANCR经由MEK/ERK信号通路适度诱导结直肠癌的EMT过程,从而促进癌细胞的转移。
然而与Guo等报道不同,Shi等[20]通过一系列细胞实验证实,BANCR的表达在结肠癌组织中显著下调,可能是由于个体差异的影响,同时发现BANCR与p21蛋白相互作用抑制结直肠癌细胞的生长。实验表明,BANCR可能在结直肠癌的治疗过程中被用作潜在的分子靶点。最近有研究表明[18]芬太尼对结直肠癌有潜在的抗肿瘤作用,其机制为芬太尼在结直肠癌细胞诱导BANCR上调和ETS-1下调,提示芬太尼有望应用于结直肠癌的治疗。
3.4.4 BANCR与肝癌 Zhou等[21]通过临床病理分析表明,BANCR高表达的肝癌患者具有更高的TNM分期,且总生存率明显缩短。王浩联等[22]采用RT-PCR检测肝癌组织中BANCR与E-cadherin、vimentin蛋白的表达关系,分析发现BANCR与E-cadherin蛋白的表达呈负相关,而与vimentin蛋白呈正相关。进一步实验表明,在肝癌组织中BANCR表达可能通过MEK/ERK通路影响EMT过程,参与肝癌的恶性发展过程。提示BANCR不仅在肝癌发生、发展中可充当预后的标志物,而且将来可能成为肝癌治疗的潜在靶标。
3.4.5 BANCR与膀胱癌 He等[23]采用RT-PCR法、流式细胞仪检测54例膀胱癌组织与正常组织中的BANCR表达,结果显示BANCR在癌组织中显著下调,并与TNM分期显著相关,其过表达能抑制细胞增殖和迁移,诱导细胞凋亡。因此,有学者提出可将BANCR作为膀胱癌新的肿瘤标志物;而BANCR在膀胱癌中发挥作用的具体分子机制仍有待进一步分析。
3.4.6 BANCR与视网膜母细胞瘤及骨肉瘤 最新研究表明[24-25],在视网膜母细胞瘤及骨肉瘤中,BANCR表达显著增加,并与肿瘤发展相关联。通过体外实验分析证明,BANCR敲除后可明显抑制恶性细胞的增殖、迁移、侵袭。此外,多因素分析表明,BANCR过表达是患者独立的不良预后因素,表明BANCR对于这两种恶性肿瘤的研究具有重要临床意义。He等[26]在分析黄芩素对骨肉瘤的抑制作用时发现,黄芩素促进BANCR的表达,而过表达的BANCR可依次导致JNK激活和β-catenin降解,从而抑制骨肉瘤细胞的生存力,并促进细胞凋亡。由此可见,BANCR可能成为视网膜母细胞瘤及骨肉瘤新的治疗策略及预后指标。
4 结语
综上所述,BANCR通过调节细胞内各周期蛋白表达、信号分子的传递等对肿瘤发生、发展产生影响。目前,我们对BANCR研究仅局限于黑色素瘤、甲状腺乳头状癌、食管癌、胃癌、结直肠癌、肝癌等恶性肿瘤,其他肿瘤研究仍在起步阶段,特别是血液系统肿瘤还未见相关报道。目前,临床检测技术也具有局限性,对各种恶性肿瘤的具体作用机制尚不明确。因此,应对BANCR影响恶性肿瘤的分子机制及其他恶性肿瘤需进一步分析。随着BANCR分析的不断深入,其有望为恶性肿瘤的诊治提供更好的方案。
[1] Li R, Zhang L, Jia L,etal. Long non-coding RNA BANCR promotes proliferation in malignant melanoma by regulating MAPK pathway activation[J]. PLoS One, 2014,9(6):e100893.
[2] Yamashita A, Shichino Y, Yamamoto M. The long non-coding RNA world in yeasts[J]. Biochim Biophys Acta, 2016,1859(1):147-154.
[3] Flockhart R J, Webster D E, Qu K,etal. BRAFV600E remodels the melanocyte transcriptome and induces BANCR to regulate melanoma cell migration[J]. Genome Res, 2012,22(6):1006-1014.
[4] Wang Y, Guo Q, Zhao Y,etal. BRAF-activated long non-coding RNA contributes to cell proliferation and activates autophagy in papillary thyroid carcinoma[J]. Oncol Lett, 2014,8(5):1947-1952.
[5] Sun M, Liu X H, Wang K M,etal. Downregulation of BRAF activated non-coding RNA is associated with poor prognosis for non-small cell lung cancer and promotes metastasis by affecting epithelial-mesenchymal transition[J]. Mol Cancer, 2014,13:68.
[6] 程 雪,蔡丽敏,王永晨. 长链非编码RNA在黑素瘤的研究进展[J]. 国际皮肤性病学杂志, 2015,41(4):260-263.
[7] 赵 义,张行行,徐 岷. 长非编码RNA在肿瘤上皮间质转化中的研究进展[J]. 国际肿瘤学杂志, 2015,8:599-601.
[8] Zheng H, Wang M, Jiang L,etal. BRAF-activated long noncoding RNA modulates papillary thyroid carcinoma cell proliferation through regulating thyroid stimulating hormone receptor[J]. Cancer Res Treat, 2016,48(2):698-707.
[9] 郝少龙,刘新承,马纪红. BANCR对甲状腺乳头状癌TSHP表达调控的研究进展[J]. 中华普外科手术学杂志, 2016,10(4):358-360.
[10] Liao T, Qu N, Shi R L,etal. BRAF-activated LncRNA functions as a tumor suppressor in papillary thyroid cancer[J]. Oncotarget, 2016, doi: 10.18632/oncotarget.10825.
[11] 李 潍,陈晓铭,武 革. 长链非编码RNA在甲状腺乳头状癌中的作用[J]. 国际内分泌代谢杂志, 2015,35(6):413-416.
[12] Jiang W, Zhang D, Xu B,etal. Long non-coding RNA BANCR promotes proliferation and migration of lung carcinoma via MAPK pathways[J]. Biomed Pharmacother, 2015,69:90-95.
[13] Chen J X, Chen M, Zheng Y D,etal. Up-regulation of BRAF activated non-coding RNA is associated with radiation therapy for lung cancer[J]. Biomed Pharmacother, 2015,71:79-83.
[14] Liu Z, Yang T, Xu Z, Cao X. Upregulation of the long non-coding RNA BANCR correlates with tumor progression and poor prognosis in esophageal squamous cell carcinoma[J]. Biomed Pharmacother, 2016,82:406-412.
[15] Li L, Zhang L, Zhang Y, Zhou F. Increased expression of LncRNA BANCR is associated with clinical progression and poor prognosis in gastric cancer[J]. Biomed Pharmacother, 2015,72:109-112.
[16] Hoesel B, Schmid J A. The complexity of NF-κB signaling in inflammation and cancer[J]. Mol Cancer, 2013,12:86.
[17] Zhang Z X, Liu Z Q, Jiang B,etal. BRAF activated non-coding RNA (BANCR) promoting gastric cancer cells proliferation via regulation of NF-κB1[J]. Biochem Biophys Res Commun, 2015,465(2):225-231.
[18] Li A X, Xin W Q, Ma C G,etal. Fentanyl inhibits the invasion and migration of colorectal cancer cells via inhibiting the negative regulation of Ets-1 on BANCR[J]. Biochem Biophys Res Commun, 2015,465(3):594-600.
[19] Guo Q, Zhao Y, Chen J,etal. BRAF-activated long non-coding RNA contributes to colorectal cancer migration by inducing epithelial-mesenchymal transition[J]. Oncol Lett, 2014,8(2):869-875.
[20] Shi Y, Liu Y, Wang J,etal. Downregulated long noncoding RNA BANCR promotes the proliferation of colorectal cancer cells via downregualtion of p21 expression[J]. PLoS One, 2015,10(4):e0122679.
[21] Zhou T, Gao Y. Increased expression of LncRNA BANCR and its prognostic significance in human hepatocellular carcinoma[J]. World J Surg Oncol, 2016,14(1):8.
[22] 王浩联,张金平,李东颖,等. BANCR在肝细胞肝癌中的表达及其临床意义[J]. 世界华人消化杂志, 2016,24(2):196-202.
[23] He A, Liu Y, Chen Z,etal. Over-expression of long noncoding RNA BANCR inhibits malignant phenotypes of human bladder cancer[J]. J Exp Clin Cancer Res, 2016,35(1):125.
[24] Su S, Gao J, Wang T,etal. Long non-coding RNA BANCR regulates growth and metastasis and is associated with poor prognosis in retinoblastoma[J]. Tumour Biol, 2015,36(9):7205-7211.
[25] Peng Z Q, Lu R B, Xiao D M, Xiao Z M. Increased expression of the lncRNA BANCR and its prognostic significance in human osteosarcoma[J]. Genet Mol Res, 2016,doi:10.4238/gmr.15017480.
[26] He N, Zhang Z. Baicalein suppresses the viability of MG-63 osteosarcoma cells through inhibiting c-MYC expression via Wnt signaling pathway[J]. Mol Cell Biochem, 2015,405(1-2):187-196.
国家自然科学基金(81460409)
1南昌大学医学院肿瘤学,南昌 3300002江西省肿瘤医院放三科,南昌 3300293南昌大学第二附属医院普外科,南昌 3300004南昌大学附属眼科医院眼肿瘤科,南昌 330000
董 晴,女,硕士研究生。E-mail: a1021592179@qq.com 李金高,男,博士,主任医师,通讯作者。E-mail: lijingao@hotmail.com
时间:2017-5-17 23:53 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.018.html
R 730
A
1001-7399(2017)05-0550-04
10.13315/j.cnki.cjcep.2017.05.018
接受日期:2017-02-28
