用于肿瘤标志物现场快速检测的便携式仪表的研制
2016-12-08樊艳王杨刘军涛罗金平徐辉任徐声
樊艳+王杨+刘军涛+罗金平+徐辉任+徐声伟+蔡新霞


摘 要 针对肿瘤标志物高灵敏度现场快速检测的需求,将电化学检测技术与电子技术相结合,采用差分脉冲伏安法(Differential pulse voltammetry, DPV)研制了一种可用于肿瘤标志物现场快速检测的便携式仪表,检测电压和电流的分辨率分别为0.8 mV和1 nA。结合实验室自制微流控纸芯片,利用该便携式仪表对肿瘤标志物癌胚抗原 (Carcinoembryonic antigen,CEA)进行检测,实验结果表明,在1~500 μg/L浓度范围内,DPV峰值电流响应与CEA抗原浓度对数呈线性关系,线性相关系数为0.998,检出限为10 pg/mL。根据抗原抗体特异性结合和电化学检测原理,检测到电化学反应的微弱电流后,仪表可以根据已经标定的电流与浓度之间的比例关系自动计算出肿瘤标志物的浓度。此便携式仪表具有检测灵敏度高、检出限低等优点,可广泛应用于肿瘤标志物的即时检测。
关键词 肿瘤标志物; 电化学检测; 差分脉冲伏安法; 便携式; 即时检测
20160129收稿;20160301接受
本文系国家自然基金项目(Nos.61527815, 61471342, 31500800, 61501426),国家重大科学研究计划(No.2014CB744600),北京市科技计划项目(Nos.Z141100003414015,Z141100000214002),中科院重点部署项目(No.KJZDEWL112)资助
Email: xxcai@ mail.ie.ac.cn
1 引 言
肺癌是常见的恶性肿瘤之一,其死亡率和发病率居恶性肿瘤第一位,严重危害人体健康。肺癌早期一般无任何临床症状,一旦确诊,即已属于中晚期,且极易扩散和转移。大量临床研究表明,肺癌的预后与临床分期密切相关,早期肺癌患者的5年生存率可达70%以上,而晚期肺癌患者的5年生存率极低[1,2],所以及早发现、诊断和治疗肺癌有着很大的临床意义。
肿瘤标志物的临床检测有酶联免疫分析法[3]、放射性免疫分析法[4]、电化学发光免疫分析法[5]、化学发光免疫分析法[6]和荧光免疫分析法[7],这些方法检测血清用量大、分析时间长、费用高、操作繁琐,不适于现场快速检测。近年,随着生物芯片技术的发展,电化学检测方法与免疫技术相结合的电化学免疫分析法备受研究者关注[8~11],该方法检测血清用量少、分析时间短、成本低、准确性和精确度高、操作简便、重复性好,非常适用于现场快速检测。目前,实验室进行电化学免疫检测主要采用大型的电化学工作站,此类型仪器检测精度高, 但成本昂贵,仪器体积大,不便于携带,因此研制用于肿瘤标志物现场快速检测便携式仪表具有很大的实用价值。
基于上述研究背景,本实验研制了一款用于肿瘤标志物快速检测的便携式仪表。结合实验室自制微流控纸芯片,对肿瘤标志物癌胚抗原 (Carcinoembryonic antigen,CEA)进行检测。结果表明, 此便携式仪表能快速定量检测肿瘤标志物,检测灵敏度高。
2 系统设计
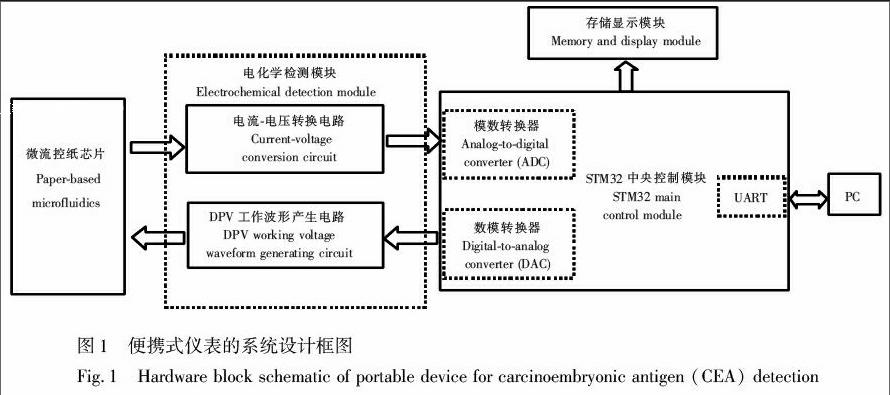
本便携式仪表系统设计包括电化学检测模块、STM32中央控制模块、存储显示模块和UART通信模块。系统设计框图如图1所示。
2.1 电化学检测模块
电化学检测的对象是肿瘤标志物浓度(μg/L),根据不同浓度抗原与抗体特异性结合会引起电活性物质的电化学电流响应变化的原理进行检测[9],该电流响应非常微弱(nA~μA级),因此必须将微弱的电流信号转化为易测量的电压信号才能检测出来。电化学检测模块包括差分脉冲伏安法(Differential pulse voltammetry, DPV)工作波形产生电路和电流电压转换电路。DPV工作波形产生电路根据恒电位仪原理设计,是利用运算放大器的“虚短”、“虚断”特性设计成电压跟随器为电化学检测参比电极提供一个仅受程序控制而不受电化学电流影响的工作电位[12,13];电流电压转换电路采用T型反馈网络电路[14],将测得的电流信号转换为易测得的电压信号,送入ADC模块进行后续数据计算。
2.2 STM32中央控制模块
中央控制模块采用基于ARM CortexM3内核的32位微处理器STM32F103RCT6芯片,该芯片内部含有3个18通道的12位模数转换器(Analogtodigital converter, ADC)和1个12位数模转换器(Digtialtoanalog converter, DAC), 电压最小分辨率为0.8 mV,电流最小分辨率为1 nA,可满足肿瘤标志物浓度电化学检测精度的需求。
2.3 存储显示模块
存储模块采用串行CMOS EEPROM芯片AT24C02,存储容量为2 kb,内部含有256个8位字节,用来存储肿瘤标志物浓度检测结果;显示模块采用2.4英寸OLED显示液晶屏,反应速度约为10 μs,具有低耗电流,超广视角,自发光等特点,用来显示检测结果。
2.4 UART通信模块
UART模块可将肿瘤标志物浓度检测结果通过USB传输至PC端进行保存,以便用于后续数据分析与处理。
2.5 仪表工作流程
仪表工作流程为:STM32中央控制模块产生DPV检测电压,通过STM32F103RCT6芯片内部DAC将数字信号DPV检测电压转换为模拟信号送入DPV工作波形产生电路;DPV工作波形产生电路将检测电压施加到微流控纸芯片各个电极端,在电压作用下微流控纸芯片上产生微弱电化学电流信号;该微弱电流通过电流电压转换电路转换为电压信号;转换得到的电压信号送入STM32中央控制模块,通过STM32F103RCT6芯片内部ADC转换为数字信号;肿瘤标志物浓度与检测到的电化学电流信号成比例关系,仪表可以根据已经标定的电流与浓度之间的校正方程自动计算出肿瘤标志物的浓度;检测结果实时显示在OLED液晶显示屏上并自动存储到AT24C02芯片中,检测结果可由UART端口传送到PC机端保存。
本便携式仪表整机尺寸为11 cm×7 cm×2.5 cm(长×宽×高),重量约122 g,仪表外观如图2所示。
3 实验部分
3.1 仪器与试剂
电化学工作站(Autolab PGSTAT302N, 瑞士万通公司),万用表(Agilent 34461A,美国安捷伦科技公司),磷酸盐缓冲液(PBS, 0.1 mol/L, pH 7.4,Sigma公司)。K3[Fe(CN)6](上海生工生物工程有限公司),CEA抗原和抗体(北京科跃中楷生物技术有限公司),实验用水为去离子水。
3.2 微流控纸芯片
微流控纸芯片(实验室自制),采用喷蜡打印工艺在纸基(Whatman No.1层析纸)上制作出相应的亲水沟道和疏水沟道,通过丝网印刷工艺在层析纸表面印刷得到三电极体系,工作电极和对电极采用导电碳浆,参比电极采用Ag/AgCl浆;工作电极的表面修饰氨基化石墨烯/硫堇/纳米金混合物用以固定抗体,其中硫堇为电活性物质,电化学检测测得电流响应即为硫堇与电极表面相互作用产生的电流变化[10,15];通过电流与浓度之间的比例关系,可以对应计算出肿瘤标志物浓度。
3.3 DPV检测原理
DPV检测工作波形可看作是线性增加的电压与恒定振幅的矩形脉冲的叠加,脉冲高度ΔE为固定值,典型值为50 mV;脉冲周期一般为500~2000 ms; 脉冲宽度一般取40~80 ms[16]。在一个周期内测量两次电流值: 在脉冲前20 ms和脉冲期后20 ms分别测量电流,将两次测量电流相减得到差值电流Δi作为该时刻电流值,连续测得多个周期的电流Δi,作出Δi与电势E之间的关系图, 即差分脉冲曲线。其中Δi满足:
在脉冲施加前20 ms,只有双层充电电流ic,在脉冲期后20 ms,所测电流为电解电流和电容电流之和,两次电流相减得到Δi,减小了电容电流的干扰,并且杂质的氧化还原电流导致的背景电流也被大大扣除[16],因而检测灵敏度和准确性比常规的计时电流法和循环伏安扫描法更高。本便携式仪表采用DPV检测方法, 大大提高了电化学检测的灵敏度。
3.4 仪表基本性能测试实验方法
便携式仪表硬件部分主要包括电化学检测电路、STM32微控制器、OLED液晶显示屏、AT24C02存储器以及电源供电电路。仪表基本性能测试主要验证仪表的精确性、灵敏度和基本电化学性能。
3.4.1 仪表检测误差分析方法 通过对三电极体系的分析,一个电化学传感器可等效为图3a所示电阻网络模型。其中,R1和R2分别为参比电极、对电极和工作电极之间待测溶液的等效电阻,Rzy是电极间电荷转移产生的感应电阻,C1是工作电极与周围电解质在接触面上由于离子吸附形成的双层电容[16,17]。在直流信号下,Rzy和R1很小,可忽略,C1不起作用,图3a电路简化为图3b所示电路。
3.5 肿瘤标志物CEA电化学检测实验方法
微流控纸芯片通过插槽的方式与便携式仪表相连,实现肿瘤标志物浓度的检测。利用便携式仪表驱动微流控纸芯片对不同浓度的肿瘤标志物浓度CEA抗原标准血清样品进行检测,以获得仪表对CEA抗原标准血清样品溶液的线性范围和检出限。
实验方法:首先滴加10 μL任一浓度的CEA抗原到修饰上抗体和氨基化石墨烯/硫堇/纳米金混合物微流控纸芯片工作区中,室温静置10 min(抗原抗体孵育时间);在工作区滴加20 μL PBS溶液,静置3 min,等待溶液完全渗透整个工作区,使三电极体系检测在同一个溶液体系中进行;通过运算放大器在工作电极和参比电极之间施加从 0.5~0.3 V范围电压,利用便携式仪表在电化学检测模块输入端加入DPV检测波形,测量CEA抗原浓度在1~500 μg/L范围内的DPV检测响应电流值,实验温度为25℃。
采用上述方法检测临床血清样本并进行误差分析,验证仪表的临床应用能力。
4 结果与讨论
4.1 仪表基本性能测试实验
仪表基本性能测试实验主要针对仪表电压电流误差测量值与计算值之间误差分析和对K3[Fe(CN)6]溶液电化学测试来验证仪表的精确性、灵敏度和基本电化学性能。
4.1.1 仪表检测误差分析 由于仪表最终检测物质为肿瘤标志物CEA,而用于肿瘤标志物CEA浓度检测的电活性物质硫堇的DPV峰值电位根据聚合底液pH值不同在 0.5~0.5 V,在进行仪表基本性能测试时,电压范围也选取在此范围内;等效电阻R2选取1,10,43,91 和150 kΩ进行测量。在仪表设计时,为了扩大检测范围能够使其在正负工作电压范围内同时检测,选用LM40411.225 V基准电压源加在运放TLC2264正极,根据运放“虚短”原理,将工作电极电位固定在1.225 V,前级运放输入DAC电压值分为加入1.7136, 1.5146, 1.3156, 1.1167和0.9177 V, 用6位半万用表Agilent 34461A并联到R2两端,测量其两端电压,得到误差为1 mV,证明仪表的电压精度误差小,能准确进行测量。
输入电压设定为0.5 V,将6位半万用表Agilent 34461A调节至电流档串联接入电路中,调整电阻R2阻值,实际测量得到的3次电流平均值与计算得到的电流值之间的误差关系如表1所示,电流误差较小,此仪表具有较高的准确度。
4.1.2 便携式仪表基本电化学性能测试 利用便携式仪表和电化学工作站分别对50 mmol/LK3[Fe(CN)6]溶液进行3次DPV检测,电流响应如图4所示(实线为电化学工作站Autolab检测结果,虚线为便携式仪表检测结果)。便携式仪表与电化学工作站Autolab测试结果相比,峰电位相同为0.160 V,峰值电流响应平均值分别为96.836和97.230 μΑ,差值为0.394 μA,相对偏差为0.4%;电化学工作站Autolab 3次检测偏差为0.5%,便携式仪表与电化学工作站Autolab之间检测偏差在电化学工作站自身偏差范围内,表明仪表检测精度与现有商品化电化学工作站检测精度相当,具有较高的检测精度。
利用便携式仪表对不同浓度K3[Fe(CN)6]溶液进行检测,DPV电流响应如图5所示。在1~50 mmol/L浓度范围内,检测电流随着K3[Fe(CN)6]浓度升高而升高,线性校正方程为Y=1.917X-2.344, 相关系数为0.996,表明仪表能够实现不同浓度K3[Fe(CN)6]溶液电流响应的检测,DPV电流响应峰值电流与K3[Fe(CN)6]溶液浓度之间呈良好的线性关系。
综上可知,此仪表具有良好的电化学检测能力,检测灵敏度较高,与电化学工作站相比,检测精度相当,可用于肿瘤标志物CEA的检测。
4.2 肿瘤标志物CEA电化学检测实验
利用便携式仪表对浓度为1 μg/L的CEA抗原标准血清样品进行4次测量,相对标准偏差(Relative standard deviation, RSD)为3.2%,表明便携式仪表具有较好的检测精度。利用便携式仪表检测不同浓度CEA抗原标准血清样品的DPV电流响应曲线如图6所示。结果表明,随着CEA抗原浓度增加,检测到的DPV电流响应信号逐渐降低,DPV电流响应值与CEA抗原浓度对数呈线性关系,CEA抗原浓度在1~500 μg/L范围内,线性校正方程为Y=2.903-0.630X, 相关系数为0.998,检出限为10 pg/mL,表明本仪表检测灵敏度较高。
4.3 临床血清样本测试
由于临床血清样本中的干扰物质较多,影响抗原和抗体的特异性结合,因此与抗原标准血清样品相比,检测得到的线性校正方程会有区别,检测灵敏度也会有所下降。利用便携式仪表对7例临床血清样本(北京肿瘤医院提供)进行检测,在1~85 μg/L范围内得到线性校正方程为Y=-0.009X+3.652, 相关系数为0.945。利用便携式仪表对3例临床血清样本3次检测平均值与医院提供的罗氏Cobas E602全自动电化学发光免疫分析仪检测值进行对比如表2所示。结果表明,此便携式仪表检测结果与电化学发光免疫分析法检测结果具有良好的相关性,表明仪表具有较好的临床应用能力。
5 结 论
实验设计了一款用于肿瘤标志物CEA现场快速检测的便携式仪表,通过实验设计验证了仪表的性能,检测电压和电流的分辨率分别为0.8 mV和1 nA。利用此仪表对不同浓度肿瘤标志物CEA进行检测,在1~500 μg/L浓度范围内电流响应的线性相关度为0.998,检出限为10 pg/mL。此便携式仪表能快速定量检测肿瘤标志物,检测灵敏度高,测量偏差小,检出限低,可用于肿瘤标志物的即时检测。
References
1 Louie A V, Palma D A, Dahele M, Rodrigues G B, Senan S. Radiother. Oncol., 2015, 114(2): 138-147
2 Surapaneni R M D, Singh P M D, Rajagopalan K M D, Hageboutros A M D. J. Thoracic Oncol., 2012, 7(8): 1252-1256
3 YANG Jing, ZENG ShaoWei, WANG XueQian, ZHAO Qian, SUN Hui, LI HuiQiang. Chinese J. Cellular and Molecular Immunology, 2012, 28(8): 871-875
杨 静, 曾昭伟, 王学谦, 赵 倩, 孙 辉, 李会强. 细胞与分子免疫学杂志, 2012, 28(8): 871-875
4 SHI ZhiHong, XIE Lan, YANG Lan. Journal of Xi′an Jiaotong University (Medical Sciences), 2011, 32(6): 725-727
石志红, 谢 岚, 杨 岚. 西安交通大学学报(医学版), 2011, 32(6): 725-727
5 Yan J, Yan M, Ge L, Geb S, Yu J. Sensors Actuat. B, 2014, 193(31): 247-254
6 XIAO Qin, LIN JinMing. Chinese J. Anal. Chem., 2015, 43(6): 929-938
肖 勤, 林金明. 分析化学, 2015, 43(6): 929-938
7 Spliethoff J W, Evers D J, Klomp H M, van Sandick J W, Wouters M W, Nachabe R, Lucassen G W, Hendriks B H W, Wesseling Je, Ruers T J M. Lung Cancer, 2013, 80: 165-171
8 Liu J T, Luo J P, Wang Y, Xu H R, Wang L, Fan Y, Cai X X. Euro. J. Biomedi. Res., 2015, 1(3): 9-16
9 Sun X B, Ma Z F. Anal. Chim. Acta, 2013, 780(30): 95-100
10 Ma C, Li W P, Kong Q K, Yang H M, Bian Z Q, Song X R, Yu J H, Yan M. Biosens. Bioelectr., 2015, 63(15): 7-13
11 Loncarica C, Tangb Y, Ho C, Parameswarana M A, Yu H Z. Sensors Actuat. B, 2012, 161(1): 908-913
12 LIN NanSen, WANG Li, WANG MiXia, XU ShengWei, YU WeiDong, CAI XinXia. Chinese J. Anal. Chem., 2015, 43(1): 93-97
林楠森, 王 力, 王蜜霞, 徐声伟, 禹卫东, 蔡新霞. 分析化学, 2015, 43(1): 93-97
13 LIN NanSen, SONG YiLin, LIU ChunXiu, CAI XinXia. Chinese J. Anal. Chem., 2011, 39(5): 770-774
林楠森, 宋轶琳, 刘春秀, 蔡新霞. 分析化学, 2011, 39(5): 770-774
14 TONG ShiBai, HUA ChengYing. Fundamentals of Analog Electronics. Beijing: Higher Education Press, 2009: 313-315
童诗白, 华成英. 模拟电子技术基础. 北京: 高等教育出版社, 2009: 186-189, 453-454
15 Wang Y, Liu J T, Luo J P, Xu H R, Wang L, Yan S, Zhang Y, Yang Y, Cai X X. ISTM Conference, 2015, Greece
16 Brad A J, Faulkner L R. Translated by SHAO YuanHua, ZHU GuoYi, DONG XianDui, ZHANG BaiLin. Electrochemical Methods Fundamentals and Applications. Beijing: Chemical Industry Press, 2008: 15-28, 198-202, 437-455
电化学方法原理和应用. 邵元华, 朱果逸, 董献堆, 张柏林 译, 北京: 化学工业出版社, 2008: 15-28, 198-202, 437-455
17 WANG ZhaoYu, WU XiaoMing, LIU ZhongMing. Chinese J. Medical Physics, 2013, 30(1): 3909-3912
王兆雨, 吴效明, 刘仲明. 中国医学物理学杂志, 2013, 30(1): 3909-3912
18 AN HaiZhen, YUAN Ruo, CHAI YaQin, TANG DianPing, LI Na. Acta Chimica Sinica, 2008, 66(6): 633-638
安海珍, 袁 若, 柴雅琴, 唐点平, 李 娜. 化学学报, 2008, 66(6): 633-638
Abstract By combining electrochemical detection technique and electronic technique, a portable device which adopted differential pulse voltammetry (DPV) measurement was developed to meet the needs of high sensitivity and onsite rapid detection for tumor marker. The voltage and current resolution of portable device were 0.8 mV and 1 nA, respectively. Combined with laboratory made paperbased analytical device, carcinoembryonic antigen(CEA) was tested by portable device. Experimental results revealed that the DPV peak currents showed good linear relation with the logarithm of CEA concentration in the range from 1 μg/L to 500 μg/L. Its corresponding correlation coefficient was 0.998 and the limit of detection was 10 pg/mL. According to the principle of specific binding of antibody and antigen and electrochemical detection, CEA concentration could be calculated automatically according to the linear equation. The portable device had high sensitivity and low detection limit features which could be widely used in the pointofcare testing of tumor marker.
Keywords Carcinoembryonic antigen; Electrochemical detection; Differential pulse voltammetry; Portable; Pointofcare testing
