医疗机构制剂生产中纯化水质量控制的实践与探讨
2017-06-02翁静艳张建中吕迁洲姚帮新赵柳娅
翁静艳+张建中+吕迁洲+姚帮新+赵柳娅
摘 要 目的:研究纯化水作为医疗机构制剂生产中主要原料及清洗剂的质量监测,确保生产用水质量合格。方法:制定纯化水质量控制的方案,在纯化水各使用点取样,按 2015 年版《中国药典(二部)》最新规定进行化学指标及微生物限度检测,连续 3 个检验周期对其进行质量监测。结果:所生产的纯化水各项化学指标及微生物限度指标均符合规定。结论:为确保制剂工艺用水安全,全面控制纯化水质量尤为重要。
关键词 医疗机构制剂 纯化水 质量控制
中图分类号:R943 文献标识码:C 文章编号:1006-1533(2017)09-0069-04
Practice and discussion of the quality control of purified water in medical institution preparation
WENG Jingyan*, ZHANG Jianzhong**, LYU Qiangzhou, YAO Bangxin, ZHAO Liuya(Department of Pharmacy, Zhongshan Hospital affiliated to Fudan University, Shanghai 200032, China)
ABSTRACT Objective: To investigate the quality control standard for the purified water used as raw material and cleaning agent in medical institution preparations in order to ensure the eligible quality of production water. Methods: The samples of the purified water were collected from different sampling points and examined according to Chinese Pharmacopoeia 2015 edition (Vol. 2), and the chemical items and microbial limit in the water were detected for three consecutive inspection periods (9 weeks). Results: The chemical items and microbial limit indicators in the purified water meet the requirements of current standard. Conclusion: It is particularly important to have a total quality control of purified water in order to ensure the water safety in preparation process.
KEy WORDS medical institution preparation; purified water; quality control
隨着国家对医药卫生标准化管理进程,医药行业GMP进程的加快,对医疗用水和工艺用水的要求逐步提高,水的质量成为药品生产质量控制的关键[1]。纯化水是医疗机构制剂乃至药物制剂行业中用途最广、用量巨大的一种原料及清洗剂[2],它的质量控制尤为重要,是直接关系到药品质量的首要因素以及过程介质[2-4],一直被《中国药典》所收载[5-9]。纯化水在生产、贮存、运输和使用过程中,非常容易被微生物污染,而微生物或其代谢产物会严重影响药品质量,引起不良后果。因此,对水质的日常检测是质检部门的一个重要工作。2015年版《中国药典(二部)》对纯化水的检测方法及质量标准分别都有明确规定,并修订了纯化水微生物限度检查项目,本版药典紧跟国际先进药典的发展趋势,有益于我们更好地加强药品的质量控制,保障我国药品的安全性和有效性[10]。为保证医疗机构制剂生产工艺用水质量,定期对纯化水进行检测是必不可少的工作,现依据2015年版《中国药典》要求介绍我院制剂室对纯化水的全面质量监测情况并进行探讨。
1 材料和方法
1.1 仪器
二级反渗透纯化水制备系统(hydranautics),Seven Easy电导率仪及实验室pH计(梅特勒-托利多公司);Getoc-900LAB型总有机碳(TOC)分析仪(GE Analytical Instruments,USA);XMTD-8222型电热恒温水浴锅(上海精宏实验设备有限公司);101-A型数显式电热恒温干燥箱(上海阳光实验仪器有限公司);XG1. DMS-0.24B机动门真空灭菌器(山东新华医疗器械股份有限公司);LRH-150型生化培养箱(上海一恒科技有限公司);CA-1480-2垂直层流洁净工作台(上海上净净化设备有限公司));微生物过滤系统(默克密理博美国公司,滤膜孔径0.45 mm)。
1.2 试药
R2A琼脂培养基和pH 7.0氯化钠蛋白胨缓冲液(上海市疾病预防控制中心,批号分别为1511112和20160314);纯化水(本院制剂室,批号为20160602,20160608,20160615,20160706,20160713,20160720,20160803,20160810,20160817)。其它试剂均为分析纯。
1.3 纯化水的制备与分配
原水先后经石英砂和活性炭过滤器后,进入一级反渗透和二级反渗透膜,制备的纯化水(在线电导率仪检测电导小于2 ms/cm)后,放行进入纯化水罐,通过纯化水分配系统送至各使用点。纯化水总送水口与分配系统总回水口分别设有取样阀。
1.4 取样计划及方法
纯化水的取样点为:总送水口、总回水口、21个使用点出水口。取样时间和频次:总送水口与总回水口为每周及每次生产均监测,其他出水口分三组,每组各7个使用点,每周依次选取一组取样。发生异常情况或不合格应增加监测检验频次。
在纯化水生产系统正常运行30 min后,检验人员开始取样。取样前,各取样点需打开取样阀排水3~5 min,用于理化检测的玻璃瓶取水前需用水样进行润洗3次,每个取水点取2瓶平行样品,每份取样量250 ml,取样结束立即盖好瓶盖。用于微生物限度检查的灭菌玻璃瓶直接取水(应提前采取高温措施灭菌),每个取水点取1瓶样品,每份取样量约100 ml,取样结束立即盖好瓶盖。
1.5 检测项目及质量标准
纯化水的检测项目及质量标准,参照2015年版《中国药典(二部)》纯化水项下规定进行检测[5]。理化检查项目需当天完成,进行总有机碳检测的水样均为取样后立即测定,在空气中停留时间应尽可能短,以便降低样品受空气中CO2的影响,保证试验数据的准确性[11]。微生物限度檢查(薄膜过滤法)需在取样结束2 h内完成检测,取水样10 ml加入滤杯,与pH 7.0的无菌氯化钠-蛋白胨缓冲液100 ml混匀,通过直径为50 mm、孔径0.45 mm的微孔滤膜过滤,小心取出滤膜,菌面朝上,贴于R2A琼脂培养基表面(培养皿f=90 mm)。同时取pH 7.0的无菌氯化钠-蛋白胨缓冲液代替试验组中的纯化水样品按试验组操作进行薄膜过滤,作为阴性对照,每个样品平行做2个培养皿,将培养皿倒置于33 ℃培养箱中培养5 d,菌落计数。
2 结果
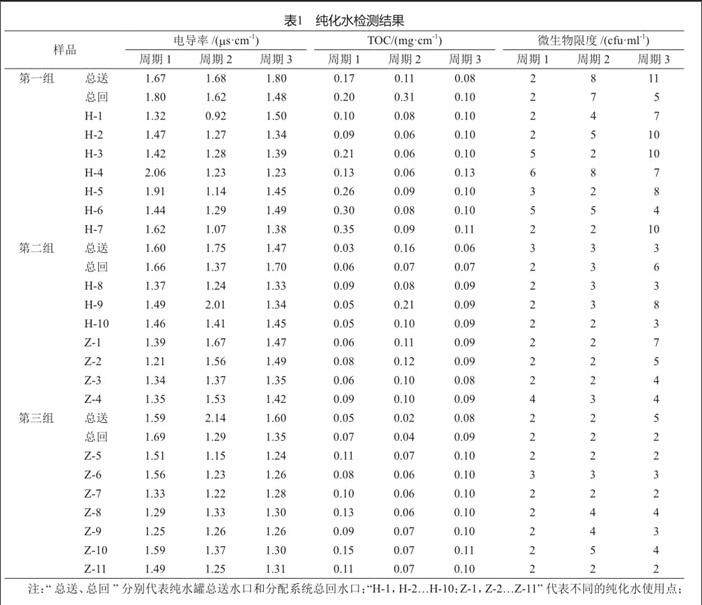
连续9批次纯化水的性状、酸碱度(pH)、硝酸盐、亚硝酸盐、氨、不挥发物和重金属检查项目检测结果均符合规定,其电导率、总有机碳和微生物限度检查检测结果见表1。结果表明,纯化水系统制备和分配循环的纯化水各项质量指标均符合2015年版《中国药典(二部)》纯化水项下规定。
3 讨论
在药品制造过程中,必须从根本上改善制药用水生产情况,才能提升药品质量。纯化水为原水(饮用水)经蒸馏法、离子交换法、反渗透法等方法制备,是医疗机构制剂生产中广泛使用的原料和清洗剂,《药品生产质量管理规范(2010年修订)》建议:“纯化水采取循环,其在制备、贮存和使用过程中微生物容易繁殖,微生物或其代谢产物会严重影响药品质量”[12-13]。因此,纯化水除了要现用现制,缩短贮存时间外,还须对贮罐和管道采取适当方法定期清洗和消毒[14],加强对工艺用水的质量控制显得尤为重要。
根据2015年版《中国药典(二部)》对纯化水的检测方法及质量标准的要求,我院制剂室质量部门制定了纯化水检验标准操作规程SOP、纯化水质量标准STP以及纯化水监测管理制度SMP等文件来规范水质监测方法,确保制剂生产用水质量。综合考虑梅雨季节、气温、湿度、贮存时间等因素对纯化水中微生物生长的影响,将3周定为一个检测周期,即覆盖所有使用水点,并进行一次巴氏消毒,确保纯化水及制剂的质量。同时还建立了纯化水中微生物指标的警戒限度,以20 cfu/ml作为警戒值。当检测值超过警戒值,必须进行巴氏消毒。
在对纯化水进行全项检测的研究中发现,纯化水的某些指标,如TOC、电导率等,因原水水质、天气因素、设备状况存在一定程度的波动,但均在我国药典规定的限度范围内。其他各指标均达到我国药典规定的要求。结果提示:经二级反渗透制得的纯化水水质符合规定,可应用于医疗机构制剂的生产。
综上所述,医疗机构制剂在生产过程中应通过测定纯化水的电导率、TOC和微生物总数等各项指标,定期对设备进行检查、维护和更新[15],以便系统掌握水质基本情况。另外,也有必要制定各项制剂室生产管理制度,制定SOP,加强人员的专业技术培训,以全面控制其质量,确保制剂工艺用水安全。
参考文献
[1] 翁柳静. 对制药用水系统设计的优化与改进[D]. 天津: 天津大学, 2003.
[2] 邱凯峰, 罗俊丽, 罗嘉玲. 医院制剂生产中纯化水的质量控制[J]. 中国实用医药, 2009, 4(25): 55-56.
[3] 李华, 龙亚秋, 杨芳. 医院制剂生产中纯化水的制备与质量控制[J]. 中国药业, 2012, 21(8): 59-61.
[4] 陈树新, 莫玉芳, 蔡先东, 等. 注射用水微生物含量与贮存温度、方式及时间的关系[J]. 中国药业, 2011, 20(5): 36-37.
[5] 国家药典委员会. 中华人民共和国药典(1995 年版)二部[M]. 北京: 中国医药科技出版社, 1995: 997.
[6] 国家药典委员会. 中华人民共和国药典(2000 年版)二部[M]. 北京: 中国医药科技出版社, 2000: 344.
[7] 国家药典委员会. 中华人民共和国药典(2005 年版)二部[M]. 北京: 中国医药科技出版社, 2005: 303.
[8] 国家药典委员会. 中华人民共和国药典(2010 年版)二部[M]. 北京: 中国医药科技出版社, 2010: 411.
[9] 国家药典委员会. 中华人民共和国药典(2015 年版)二部[M]. 北京: 中国医药科技出版社, 2015: 579.
[10] 冯震, 范一灵, 杨美成. 《中华人民共和国药典(2015年版)》(四部)中微生物检验相关通则的增、修订情况介绍[J].上海医药, 2016, 37(7): 11-15.
[11] 张振巍, 张娜娜, 白丹丹, 等. 水总有机碳测定方法评价与分析[J]. 中国药师, 2013, 16(9): 1328-1330.
[12] 国家卫生部. 药品生产质量管理规范(2010 年修订)[M].北京: 人民卫生出版社, 2011: 14.
[13] 方朝东, 邱文娜, 李磊, 等. 疫苗生产中纯化水与注射用水的质量控制研究[J]. 中国药业, 2016, 25(11): 69-72.
[14] 邓还根. 制药工业 GMP 管理实施指南[M]. 北京: 中国计量出版社, 2000: 428.
[15] 闫秀红. 制药工艺用水制备流程分析[J]. 黑龙江科学, 2015, 6(2): 62-63.
