模拟生产工艺制作大肠杆菌苗课堂改革
2017-03-09任平韩双张凯华
任平 韩双 张凯华
摘要:随着高职教育课堂形式改革的不断深入,理实一体化课堂形式已成为培养高职学生的主要运行模式。大肠杆菌疫苗的制作是《生物药物制备技术课程》的主修内容,具有实践性和应用性强的特点,为了使菌苗制作的工序过程更接近生产实际,让学生“零距离”体验生产岗位的操作标准,掌握操作过程的技能与技巧,经过多年来的探索和实践,总结出模拟生产工艺制作大肠杆菌铝胶灭活苗的一些经验供相关学者参考。
关键词:模似生产;流程;大肠杆菌
中图分类号:G71 文献标识码:A
文章编号:1005-913X(2017)01-0143-02
大肠杆菌疫苗制作的课堂教学在内容设计上,由原来的零散实验如:培养基的制作、菌种的培养、细菌的计数方法、铝胶的配制、配苗和检验等,改为模拟大肠杆菌的生产工艺流程,按照生产岗位的操作标准,以生产上的工序过程,利用理实一体化课堂教学模式,完成大肠杆菌铝胶灭活苗的制作和检验,全过程分基本知识介绍和基本技能操作两部分。
一、基本知识介绍
让学生课下复习大肠杆菌相关的理论知识,课堂上通过播放工业生产中大肠杆菌苗的视频及课件了解大肠杆菌苗的整体制作过程;同时讲清大肠杆菌每道工序操作的要点及注意事项。让学生明晰在生产岗位所要从事的工作。
二、基本技能操作训练
整个操作过程分6道工序完成。将学生分成6个小组,按工序的顺序进行实施。完成每一道工序时,按生产上的操作标准(模拟生产要求)执行,同时按要求检验每道工序作品是否合格,合格后方可执行下一道工序。
(一)菌种的选择与鉴定
可选用购买的大肠杆菌标准菌种或按常规制作血液琼脂平板或营养琼脂平板,分离培养含大肠杆菌的病料(死于大肠杆菌病的动物心血、腹水、肝渗出物、气囊附着物或正常动物的肠道内容物),经伊红美兰琼脂平板培养,挑选出黑色带金属光泽菌落;经靛基质试验、甲基红试验,结果呈阳性,VP试验,结果呈阴性;细菌经涂片、革兰氏染色、显微镜检查,结果呈中等大小革兰氏阴性(红色)的杆菌;经因子血清鉴定确定血清型后,可作为标准菌种使朋。菌种可保存在琼脂斜面中(短期使用)或采用冷冻干燥法保存(长期使用),以免发生变异。
(二)种子培养及菌液的制备
取上述大肠杆菌菌种接种于伊红美兰琼脂平板或麦康凯琼脂平板上,置37℃温箱中培养18~24 h,挑取单个典型菌落,移植于琼脂斜面中作为种子。用灭菌吸管取5 mL马丁肉汤加人大肠杆菌的琼脂斜面中,用接种环刮取下菌体,研磨稀释后倒入另一只灭菌试管中,置37%培养18~24h后,作为一级种子。将一级种子按10%的量再次接种马丁肉汤中进一步扩大培养后,做为配苗菌液。取配苗菌液少量装于灭菌试管中做菌数计数,其余菌液灭活待做配苗用(强毒细菌须在杀菌后,再行计数)。
(三)采用活菌计数法或比浊计数法对配苗菌液进行计数
活菌计数法可选用平板表面涂布法或倾注平板培养法。
1.活菌计数。活菌计数法是将待测菌液精确地作一系列稀释,然后吸取一定量某稀释度的菌液样品,选用适当的方法进行培养。一个活的细菌经培养后,在平板培养基上大量繁殖可形成一个肉眼可见的菌落,从长出的菌落数及稀释倍数,换算出每毫升待测菌液中的活菌数即细菌总数。
(1)平板表面涂布法
制备营养琼脂平板。用商品化的营养琼脂粉,按常规方法制作营养琼脂平板8个,用前将营养琼脂平板倒置在37℃温箱中烘干1h,使其表面的水分蒸发。取出后将其分为4组,每组2个平板,第4组为对照组。
稀释菌液。根据待测菌液中菌数含量的多少,在做培养之前,用普通肉汤或生理盐水将被测菌液作10倍递进稀释即10-1、10-2、10-3、10-4……。稀释方法为:取灭菌试管6~10支,分别标明稀释倍数;每支试管中加入灭菌生理盐水或肉汤9mL;另取灭菌吸管吸取待测菌液1mL,加入第1支试管中,充分混匀,稀釋倍数为10-1;从第1支试管中吸取稀释菌液1mL加入到第2支试管中,充分混匀,稀释倍数为10-2,如此一直稀释到最后一支试管。
涂样。另取三支灭菌吸管,分别吸取后三个稀释度试管中的菌悬液0.1mL,对应加在3组营养琼脂平板上,每一个稀释度菌液接种2个平板,用灭菌L形玻璃棒将菌液涂匀。在平皿底作好与试管稀释度相同的标记。第4组作对照,加稀释液0.1mL。
培养。将上述各组的平板置37℃温箱中培养1~2h,使菌液渗透于培养基内,然后倒置培养24h。
计数。从培养箱中取出培养皿,用肉眼观察计算每个平板上的菌落数,必要时可用5-10倍放大镜观察,以免遗漏。一般选择菌落数在30~300之间的平皿用以计数,每个稀释度应取其菌落平均数,并求3个稀释度之和再取其平均值,得出每毫升待测菌液所含的活菌数。按下式计算活菌数。
活菌数/mL=2个平板平均菌落数×10×稀释倍数。举例:在10-8稀释的平板中所得平均菌落数为85个。计算结果:85×10×108=8.5×1010个活菌/mL
说明:对照组应无菌落生长,否则试验结果不准确,应重做。
前一稀释度的平均菌落数应大致为后一稀释度平均菌落数的10倍左右,如差别太大,则说明试验不准确,应重做。
(2)倾注平板培养法
待检菌液稀释方法同上。分别吸取后三个稀释度试管中的菌悬液1mL加在灭菌平皿中,然后取预先融化且冷却至50℃~55℃的营养琼脂培养基分别倾入上述平皿中,立即摇匀平放,待其冷凝后,置37℃培养24h。统计平皿上长出的菌落数,乘以稀释倍数,计算出三个稀释度的平均数,即为每毫升待测菌液所含的活菌数。
2.比浊计数法
比浊计数法是通过对比待测菌液与标准比浊管的浊度,求出大致的细菌总数。标准比浊管由国家生物制品检定部门提供,每套包括一支细菌比浊标准管、数支对照空管和一张比浊用的图片,说明书上注明标准管相当于不同细菌种类的菌数,使用期为1年。也可自行制作标准比浊管。比浊计数法节时方便,但误差大。
(1)标准比浊管的制备
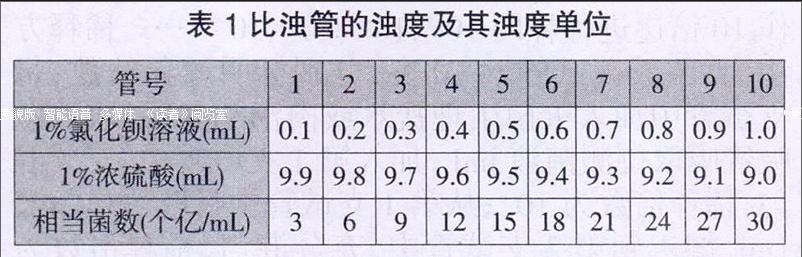
选取口径和管壁厚薄一致的洁净试管10支,分别加入1%氯化钡溶液,然后加入1%浓硫酸溶液,使各管总液量为10mL,加塞并用石蜡封固,保存备用。各管加液量及浊度单位见表1。
(2)比浊方法
取待测菌液1mL加入空试管中,与标准管并列紧贴在图片前,使两管受光均匀,透过两管管壁对比观察,目测图片的清晰度。比浊时标准管与待测菌液管应经常摇匀。若待测菌液管较标准管过浓时,可在待测管中加适量生理盐水进行调整,直至两管背后的图片清晰度相同为止。
例如:测定大肠杆菌的菌数,若1mL菌液加入4mL的生理盐水后,与标准管的浊度相同,即表示该菌液经5倍稀释后相当于标准管。大肠杆菌标准管的菌数相当于8亿个/mL,故被测菌数为8×5=40亿个/mL,
(四)灭活与检验
灭活在疫苗制造上是将细菌及其产生的毒素用物理或化学方法处理,使其丧失毒力或致病性,而保留其抗原性的过程。灭活时,根据细菌的特性选用有效的灭活剂和最适的灭活条件。甲醛是大肠杆菌灭活中最有效的灭活剂,向上述培养的大量菌液中加人终浓度0.3%甲醛溶液,置37℃温箱灭活24~48h。取少量灭活后菌液接种于营养琼脂斜面培养3天,检查无细菌生长,证明灭活完全。
(五)配制氢氧化铝胶与配苗
将灭活后的菌液按5份菌液加入1份氢氧化铝胶进行配苗,大肠杆菌的菌液浓度为100亿-400亿个/ml。配苗时应充分振荡,加入0.01%硫柳汞防腐,置2~8℃静置2-3天,抽弃上清液,浓缩成全量的60%。塞上胶塞,用固体石蜡溶化封口,贴上标签,注明菌苗名称,使用前充分摇匀。在菌液中加入氢氧化铝胶(佐剂),是为了增强免疫效果。
氢氧化铝胶的制作:先用去离子水将无水A1Cl3配成25%溶液,加热溶化,使用时稀释成8%的溶液;另配4%NaOH溶液,将两种溶液同时加温至56℃~60℃。在此温度下,将NaOH溶液缓慢加入于8%AlCl3溶液中,边加边搅拌,当pH值达5.6-6.0时,即为终点,继续搅拌10分钟,置高压灭菌器内121.3℃灭菌20分钟,氢氧化铝胶呈透明略带乳光液体,保存期不超过3个月。
(六)成品检验
1.无菌检查
取1ml鋁胶苗加入49ml硫乙醇酸盐培养基中,培养72h后,移植于葡萄糖蛋白胨水培养基中和酪胨琼脂培养基上培养5天,检查无细菌生长。
2.安全检验
取1月龄健康易感鸡5只,各颈部皮下或肌肉注射铝胶苗2ml,同时设不接种疫苗的对照组,与免疫组同条件饲养,观察14天,应健康存活,剖检时,内脏器官及注射部位应无损伤。
3.效力检验
取1月龄健康非免疫鸡5只,各颈部皮下注射铝胶苗0.5ml,21天后,连同条件的对照组鸡5只,各腹腔注射致病性大肠杆菌的肉汤培养物0.5ml(含活菌2亿~5亿个)。攻毒后观察14天,对照组鸡应全部发病或死亡,剖检后具有典型病变;免疫组鸡保护率在70%以上,为合格。
通过对学生模拟生产工艺制作大肠杆菌铝胶灭活苗的理实一体化的课堂训练,不仅让学生掌握生产大肠杆菌疫苗的操作技巧,学会细菌性灭活苗的制作,同时让学生感受到自己是在生产岗位上工作,即是学习,又是工作,锻炼了学生对应职工作岗位的认知和了解。又因为是小组共同完成任务,又培养了学生共处共生、团结协助的关系。为学生今后走向工作岗位打下坚实基础。
[责任编辑:马欣]