纤维蛋白胶介导大鼠内皮祖细胞移植干预大鼠急性脑缺血的实验研究
2017-02-13胡国章
权 哲,宋 薇,韦 博,胡国章
(1.上海市奉贤区中心医院 神经二科,上海201400;吉林大学中日联谊医院 2.急诊科;3.神经外二科)
纤维蛋白胶介导大鼠内皮祖细胞移植干预大鼠急性脑缺血的实验研究
权 哲1,宋 薇2*,韦 博3,胡国章2
(1.上海市奉贤区中心医院 神经二科,上海201400;吉林大学中日联谊医院 2.急诊科;3.神经外二科)
1 材料和方法
1.1 实验材料
冰箱(Hisense),超净工作台(苏州净化),CO2恒温培养箱(Thermo Scientific),荧光倒置显微镜(OLYMPUS) ,电热恒温干燥箱(常州润华仪器),超纯水纯化仪(四川优普科技),高压蒸汽灭菌锅(山东博科),动物大脑立体定位仪(深圳市瑞沃德生命科技有限公司)。M199培养基(Life公司),胎牛血清(BI),大鼠淋巴细胞分离液(上海生工生物),纤维蛋白胶(sigma公司),CD34/CD133荧光标记的抗体(BD公司),VEGF/FGF-2单克隆抗体(Bioworld公司)。
1.2 大鼠骨髓 EPCs的分离、培养和鉴定
将健康 Wistar 大鼠用乙醚麻醉后脱臼处死,75%酒精中浸泡5 min,超净台内剥离肌肉并离断两端骨骺,预冷PBS润洗,加入淋巴细胞分离液离心后收集沉淀,用M199培养基重悬细胞,计数后接种到24孔板中,置于恒温培养箱培养。CD34/CD133阳性的细胞通过免疫荧光鉴定获得。
1.3 内皮祖细胞与纤维蛋白胶形成复合物
将适量的CD34/CD133阳性内皮祖细胞用内皮细胞培养基重悬后,种植在纤维蛋白胶表面,定期更换新的培养基,置于37 ℃、5%CO2培养箱中,大约经过7 d后形成载有内皮祖细胞的纤维蛋白胶复合物。
1.4 大鼠急性脑卒中模型的建立
式中:Eb为泵站运行费用,元/m3;W 为泵站装机功率,kW;F为农业供水电价,元/(kW·h);Q 为泵站设计流量,m3/h;η末为泵站出口 (一级计量点)至终端计量点之间的渠系水利用系数,示范区中为斗渠渠道水利用系数。
将30只SD大鼠随机均分为3组:假手术组(A组,n=10),对照组(B组,n=10,单独移植大鼠内皮祖细胞),实验组(C组,n=10,移植大鼠内皮祖细胞-纤维蛋白胶复合物)。利用酒精消毒后的线栓制备大鼠急性脑缺血模型,假手术组除线栓处理外,其它操作均同手术组。
1.5 脑卒中模型的评定指标
1.5.1 行为学评定标准[6](见表1)

表1 神经功能评定标准
评分1分以上认为模型成功,进行后续实验研究。
1.5.2 TTC染色评定 利用水合氯醛腹腔麻醉大鼠,快速断头取脑,将鼠脑平分为厚约3 mm的切片,按顺序浸入1%TTC中,37℃染色30 min,正常脑组织TTC染色为鲜红色,缺血区脑组织为白色,计算每组大鼠的脑梗死面积。
1.5.3 病理及免疫组化评定 在移植后不同时间点,将各组大鼠的脑组织浸入4%多聚甲醛中,切除小脑与延髓,平均切成等厚度的6个冠状切片,石蜡包埋后进行HE染色,观察脑组织病理学变化;同时进行VEGF、FGF-2免疫组化,每张切片取8个不重复视野,计数VEGF、FGF-2的阳性细胞数。
1.6 统计学方法
所有实验数据均独立重复检测3次,使用SPSS19.0统计软件对数据进行分析,计量资料比较采用t2检验,多个样本的组间比较采用ANOVA,对因素分析采用多元线性回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠内皮祖细胞的鉴定
内皮祖细胞表面特异性标志有CD133、CD34等,对培养的细胞进行CD133、CD34免疫荧光检测,结果显示收集的细胞均为CD133、CD34表达阳性(见图1)。
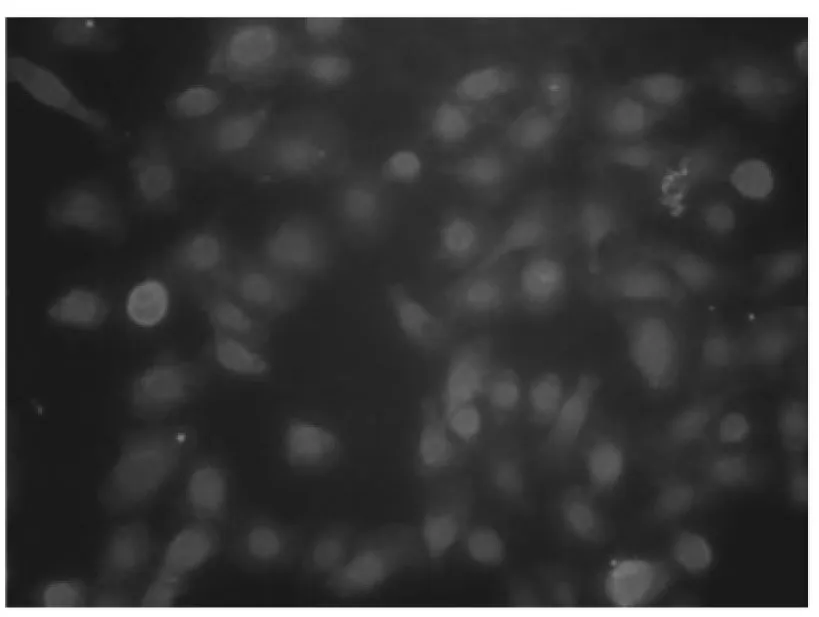
图1-1 EPCs CD133+
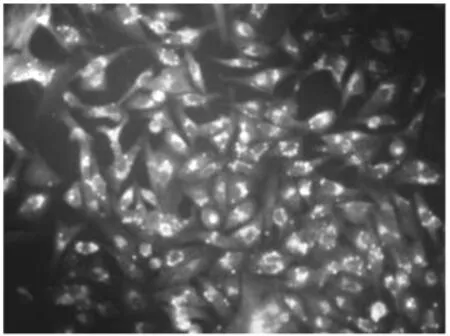
图1-2 EPCs CD34+
2.2 各组大鼠的行为学评分
在3 d、7 d、14 d三个时间点,对各组大鼠的行为学进行评分,移植术3 d后,B、C两组间评分无显著性差异(P>0.05),但均显著高于A组(P<0.01);移植后7 d,C组评分显著低于B组(P<0.05),移植14 d后两组评分差异更明显(P<0.01)。见表2。

表2 三组大鼠在不同时间点的行为学评分(n=10)
假手术A与对照组比较,*P<0.05,**P<0.01,与对照组B组比较,#P<0.05,##P<0.01。
2.3 TTC染色评定各组大鼠的脑梗死面积
TTC染色评定3 d、7 d、14 d三个时间点的脑梗死面积,移植术3 d后,三组间脑梗死面积无显著性差异(P>0.05);移植后7 d,C组脑梗死面积显著低于B组(P<0.05),移植14 d后两组脑梗死面积差异更明显(P<0.01)。组内相比,随着移植时间的延长,A组大鼠的脑梗死面积逐渐增大,B、C两组大鼠的脑梗死面积逐渐减小,C组大鼠降低更为明显。见表3。

表3 三组大鼠在不同时间点的脑梗死面积(n=10)
组间比较,*P<0.05,**P<0.01;组内比较,#P<0.05,##P<0.01。
2.4 HE染色检测各组大鼠的病理学变化
HE染色结果发现A组大鼠神经细胞、胶质细胞的形态结构几乎无变化,胞浆无红染,B和C组大脑组织的坏死区域均发现缺失大量神经元,胶质细胞异常增生,随着移植时间的延长,B组大鼠脑梗死周围未出现新生的毛细血管,C组大鼠脑组织梗死体积明显减少,且脑梗死区域周围可见大量新生的毛细血管。
2.5 各组大鼠脑组织VEGF、FGF-2免疫组化
VEGF、FGF-2免疫组化的着色部位主要在胞浆,呈黄褐色或棕黄色。A组大鼠脑组织的VEGF、FGF-2主要表达在少量的血管内皮细胞、神经细胞和胶质细胞,各个时间点无明显变化。B、C组在脑缺血区域中的血管内皮细胞、神经细胞和胶质细胞表达明显增多,均在移植后7d阳性细胞数达到峰值,但C组大鼠脑组织VEGF、FGF-2的表达量在三个时间点均明显高于B组(P<0.05)和A组(P<0.01)。见表4。

表4 三组大鼠在不同时间点的VEGF、FGF-2阳性细胞数(n=10)
与对照组比较,*P<0.05,**P<0.01。
3 结论
脑卒中[7](又称脑中风)是世界上最重要的致死性疾病之一,具有极高的病死率和致残率,但由于药物治疗的疗效欠佳,手术治疗又受到各种条件的限制,急需寻求新的治疗手段[8]。自从在外周血中发现内皮祖细胞(EPCs),大量研究发现EPCs具有修复血管损伤、促进神经纤维的生长和神经功能恢复等功能,不仅更新了传统上关于血管损伤后修复的理论,而且为防止血管再狭窄、脑血管疾病和血管创伤愈合治疗提供了广泛的临床应用前景[9]。但由于体内EPCs的数量有限,不能充分满足细胞组织工程的迫切需要,如何快速稳定地扩增EPCs是一个困扰广大研究者的问题[10]。而目前仍无一个标准方案规范对大鼠外周血中的EPCs诱导培养,本实验通过查阅大量国内外文献[11],并经过前期实验条件的反复摸索,最后借助免疫荧光技术,成功分离得到能在体外稳定传代的内皮祖细胞,为EPCs在体内的移植提供可靠的理论基础。
伴随细胞移植工程的研究,生物活性材料也是近年来快速发展的热门研究领域。有文献报道,将生物材料单独应用或结合细胞,能够明显改善心梗后的心肌不良重构。生物材料的选择具有严格的标准[12],一方面需要生物可降解性和适当的物理强度,另一方面要具备胶原、纤连蛋白和层粘连蛋白的生物学特性。纤维蛋白胶是经美国FDA批准的作为血和粘合剂广泛应用的生物材料,不仅能为伤口内细胞的生长提供细胞间质,而且通过促进成肌细胞移植物的生存和保持,减少梗死范围,并成功诱导梗死区的血管新生。本实验采用TTC染色法对各组大鼠的脑组织进行染色,比较不同方式移植后大鼠脑梗死面积的变化,发现与单独移植EPCs相比,利用纤维蛋白胶介导EPCs的移植,能明显降低大鼠的脑梗死面积,同时HE染色结果显示纤维蛋白胶介导EPCs的移植能显著促进大鼠脑卒中周围的血管新生,改善脑卒中大鼠的病理学变化进程,提示纤维蛋白胶可以作为有效的生物活性材料,介导EPCs移植体内后发挥生物学功能。
VEGF 是一类促血管内皮细胞生长的关键因子[13],体外能特异性结合内皮细胞,刺激内皮细胞的分裂增殖,体内可有效促进形成新生血管,能起到对神经系统直接的保护作用[14]。FGF-2是一类具有血管活性和神经营养功能的因子,在人体的神经系统和心、肾、肝等组织中广泛分布,研究表明[15]FGF-2的上调表达有助于脑缺血后的神经保护。本实验将EPCs单独或结合纤维蛋白胶移植入大鼠的急性脑卒中模型,在不同时间点检测VEGF和FGF-2的表达量,发现两种指标在A组大鼠的脑组织神经细胞中均为少量表达,B、C两组大鼠的表达水平均增加,且显著高于A组,并在移植7 d后达到最大值,但C组大鼠脑组织VEGF、FGF-2的表达量在三个时间点均明显高于B组和A组。提示EPCs移植后能促进脑组织中神经细胞分泌VEGF和FGF-2,进而促进血管新生和神经功能的恢复,而结合纤维蛋白胶后,进一步加强治疗效果。
本课题通过从大鼠骨髓中成功分离收集EPCs,并结合纤维蛋白胶进行移植,发现对治疗大鼠急性脑卒中有更好的疗效,为临床治疗血管新生相关疾病提供了新的指导。
[1]崔立玲,黄国志,陈镇洲,等.自体血管内皮祖细胞治疗缺血缺氧性脑损伤[J].中国组织工程研究,2013,17(14):2633.
[2]刘国政.缺血性脑血管病的研究进展[J].实用心脑肺血管病杂志,2013,21(8):5.
[3]阿迪拉·阿扎提,赵 龙,周欣荣,等.纤维蛋白胶介导内皮祖细胞再生心肌梗死血管的可行性[J].中国组织工程研究,2014,18(39):6298.
[4]乔 威,冉 峰,刘长建.人外周血内皮祖细胞的分离、培养及鉴定[J].中国组织工 程研究,2013,17(36):6508.
[5]Morancho A,Hernandez-Guillamon M Boada C,et al.Cerebral ischaemia and matrix metalloproteinase-9 modulate the angiogenic function of early and late outgrowth endothelial progenitor cells[J].J Cel MolMed,2013,17(12):1543.
[6]闫醒军,边忠平.外周血内皮祖细胞治疗下肢缺血性疾病的疗效[J].中国老年学杂志,2012,32(7):1373.
[7]朱 江,刘煜敏,孔朝红,等.自体骨髓内皮祖细胞移植治疗动脉粥样硬化大鼠急性脑缺血的实验研究[J].中华神经医学杂志,2010,09(7):652.
[8]路敬叶,周广喜,牛荣东.急性脑缺血大鼠外周血内皮祖细胞研究[J].中国现代神经疾病杂志,2009,3:280.
[9]张海侠,田 玲,刘新峰.内皮祖细胞移植治疗脑梗死的研究进展[J].中国脑血管病杂志,2015,12(3):165.
[10]朱俊德,王贵学,余 彦,等.内皮祖细胞移植对动脉粥样硬化模型大鼠脑缺血再灌注后学习记忆能力与脑顶叶皮质的影响[J].解剖学报,2012,43(4):433.
[11]孙宏毅,罗 勇,卢桃利,等.电针对局灶性脑缺血/再灌注大鼠外周血和骨髓内皮祖细胞的作用[J].针刺研究,2012,37(3):179.
[12]高洪博.局灶性脑缺血再灌注损伤大鼠外周血内皮祖细胞数量的变化[J].中华神经科杂志,2010(10):729.
[13]荆 静,王翠兰,高洪博.脑缺血再灌注大鼠外周血EPCs与VEGF、bFGF、eNOS水平变化及相关性[J].中国现代医学杂志,2011,21(7):759.
[14]Takabatake S,Hayashi K,Nakanishi C,et al.Vascular endothelial growth factor-bound stents:application of in situ capture technology of circulating endothelial progenitor cells in porcine coronary model[J].J Interv Cardiol,2014,27(1):63.
[15]王 亮,焦俊峰,王晓楠,等.脑损伤大鼠内皮祖细胞与早期血管新生的关系[J].中国神经精神疾病杂志,2010,36(3):168.
1007-4287(2017)01-0145-04
上海市奉贤区区科委课题:2015-1003
权 哲(1976-),男,副主任医师,博士。
2016-03-10)
*通讯作者
