MK886对人结肠癌细胞HT-29增殖及Ascl2表达的影响
2017-01-06李仕宇朱蓉刘梅周本刚赵逵
李仕宇,朱蓉,刘梅,周本刚,赵逵
(1 遵义医学院附属医院,贵州遵义563000;2 遵义市第一人民医院)
MK886对人结肠癌细胞HT-29增殖及Ascl2表达的影响
李仕宇1,2,朱蓉1,刘梅1,周本刚1,赵逵1
(1 遵义医学院附属医院,贵州遵义563000;2 遵义市第一人民医院)
目的 探讨5-脂氧合酶活化蛋白(FLAP)抑制剂MK886对人结肠癌细胞HT-29增殖的影响及其作用机制。方法 分别采用12.5、25、50、75、100、200 μmol/L的MK886干预体外培养的HT-29细胞,分别于干预24、48 h时采用CCK-8法测定细胞增殖抑制率,结果显示MK886抑制HT-29细胞增殖最佳作用时间为48 h、最佳浓度为48.12 μmol/L。选择48.12 μmol/L MK886干预HT-29细胞(MK886组),另设对照组(不干预),干预24 h时采用Real-time PCR技术检测Ascl2 mRNA表达,干预24、48、72 h时分别采用Western blotting法检测 Ascl2 mRNA和蛋白表达。结果 经过48.12 μmol/L MK886干预24 h时HT-29细胞中Ascl2 mRNA相对表达量为0.35±0.02,对照组为0.72±0.02,两组比较P<0.01。48.12 μmol/L MK886作用24、48、72 h时HT-29细胞中Ascl2蛋白相对表达量分别为1.75±0.13、1.10±0.15、0.71±0.19,均较对照组降低(P均<0.05);且随着MK886作用时间延长,Ascl2蛋白相对表达量逐渐下调(P均<0.05)。结论 FLAP抑制剂MK886能抑制人结肠癌细胞HT-29增殖,其机制可能与下调Ascl2 mRNA和蛋白表达有关。
结肠癌;MK886;5-脂氧合酶活化蛋白;Ascl2
结直肠癌是发病率和病死率均较高的恶性肿瘤之一,近年来其发病呈年轻化趋势[1,2]。花生四烯酸(AA)是人体必需脂肪酸,在体内代谢后可生成多种有生物活性的物质,如类二十烷酸等。这些代谢产物在肿瘤进展、转移、血管生成等方面具有重要作用[3]。AA主要通过脂氧合酶(LOX)和环氧合酶(COX)途径代谢[4],而非甾体类抗炎药(NSAIDs)或其他抑制剂均能抑制这两条代谢途径,继而抑制肿瘤细胞增殖并延缓肿瘤进展[5]。5-脂氧合酶活化蛋白(FLAP)抑制剂在临床已广泛用于治疗哮喘、关节炎等慢性炎症性疾病[6],但其对肿瘤细胞的作用鲜见报道。2015年5~8月,本研究观察了FLAP抑制剂MK886对结肠癌细胞增殖的影响,现分析结果,并探讨其可能的作用机制。
1 材料与方法
1.1 材料 人结肠癌细胞株HT-29,购自中国科学院上海细胞库。超净台,苏州净化设备厂;二氧化碳培养箱、全波段酶标仪,美国Thermo公司;倒置显微镜,日本Olympus公司。MK886,美国Cayman公司,DMSO溶解后配成10 mmol/L溶液,-20 ℃储存备用,实验时用完全培养基稀释;胰蛋白酶、双抗、RPMI 1640培养基,美国Hyclone公司;胎牛血清,杭州四季青生物工程材料有限公司;CCK-8试剂盒,日本同仁化学研究所;Ascl2引物设计及合成,上海生工生物工程股份有限公司;TRIzol逆转录试剂盒、RT-PCR试剂盒、BCA蛋白定量试剂盒,北京全式金生物技术有限公司;Ascl2兔多克隆抗体,美国Abcam公司;山羊抗兔、鼠IgG-HRP,上海Abmart公司。
1.2 细胞传代培养 取HT-29细胞置于含12%胎牛血清和1%双抗的RPMI 1640培养基中,37 ℃、5% CO2培养箱中常规培养,待细胞贴壁生长至80%~90%融合时,0.25%胰蛋白酶消化传代,继续培养24 h。取对数生长期、生长状态良好的细胞用于实验。
1.3 MK886抑制HT-29细胞增殖的最佳浓度确定 取对数生长期HT-29细胞接种于96孔板中,细胞密度为8×103个/孔,每孔加入100 μL的细胞悬液。随机分为空白对照组、阴性对照组及试验组,试验组分别加入6个浓度的MK886(分别为200、100、75、50、25、12.5 μmol/L)干预,每个浓度均设5个复孔。空白对照组加入不含细胞的完全培养基;阴性对照组加入含细胞的完全培养基,不加MK886;试验组分别加入含细胞及相应浓度MK886的完全培养基,分别培养24、48 h。每孔分别加入CCK-8溶液10 μL,继续培养1 h,酶标仪450 nm波长处检测各孔吸光度(A)值,计算不同浓度MK886作用24、48 h时HT-29细胞的增殖抑制率。细胞增殖抑制率(%)=(阴性对照组A-试验组A)/(阴性对照组A-空白组A)×100%。试验至少重复3次,取平均值。结果见表1。根据半数抑制浓度(IC50)软件,不同浓度MK886作用24、48 h时的IC50分别为44.21、48.12 μmol/L,选取48.12 μmol/L为最佳作用浓度。
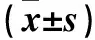
表1 不同浓度MK886作用24、48 h时HT-29细胞增殖抑制率比较
注:与12.5 μmol/L比较,*P<0.05;与25 μmol/L比较,△P<0.05;与50 μmol/L比较,▲P<0.05;与75 μmol/L比较,▽P<0.05;与100 μmol/L比较,▼P<0.05;与同浓度作用48 h比较,#P<0.05。
1.4 MK886对HT-29 细胞Ascl2 mRNA表达影响的观察 采用RT-PCR法。取对数生长期HT-29细胞,以2×105个/mL密度接种于6孔板中常规培养。设对照组及观察组,对照组不加MK886,观察组加入48.12 μmol/L MK886,均培养24 h。采用TRIzol法提取各组总RNA,按说明书操作。采用酶标仪行定量检测,RNA母液浓度=光密度(OD)260×0.04 μg/mL×50倍,OD260/OD280行纯度评估(比值为1.8~2.2提示无RNA水解及蛋白污染)。按逆转录试剂盒说明书进行逆转录cDNA,反应条件:25 ℃ 10 min、42 ℃ 30 min、85 ℃ 5 min、4 ℃ 5 min。按扩增试剂盒说明书以cDNA为扩增模板。引物序列:Ascl2上游引物:5′-GGATGTACTCCACGGCTGAG-3′,下游引物:5′-CGTGAAGCTGGTGAACTTGG-3′,片段长度113 bp;β-actin内参上游引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′,下游引物:5′-TGGCACCCAGCACAATGAA-3′,片段长度186 bp。PCR反应条件:95 ℃ 5 min、95 ℃ 15 s、60 ℃ 30 s、72 ℃ 10 s,共40个循环。扩增后的PCR产物经2%琼脂糖凝胶电泳在凝胶成像系统下观察目标条带,结合扩增曲线及溶解曲线综合分析有无非特异性扩增,以及结果是否可靠。采用2-ΔΔCT法计算mRNA相对表达量。试验至少重复3次。
1.5 MK886对HT-29细胞Ascl2蛋白表达影响的观察 采用Western blotting法。取对数生长期HT-29细胞,4×105个/mL密度接种于培养瓶中常规培养,并设对照组及观察组。对照组加完全培养基,观察组加入48.12 μmol/L MK886,分别作用24、48、72 h。收集细胞,加入细胞裂解液RIPA匀浆使其冰上充分裂解;4 ℃ 12 000 g/min离心30 min,收集上清液,BCA蛋白定量法检测蛋白含量;加入等量的上样缓冲液,沸水煮5 min至蛋白变性。以40 μg/μL的蛋白量上样,常规电泳,转膜,用5% BSA封闭;Ascl2多克隆抗体(1∶1 000)、小鼠抗人β-actin抗体(1∶1 000)作为一抗孵育4 ℃冰箱过夜,山羊抗兔、鼠IgG-HRP(1∶5 000)作为二抗孵育1 h,发光液发光,X线胶片感光,手动洗片机洗片。用全自动凝胶成像分析系统扫描胶片并测定各组蛋白电泳带OD值,以Ascl2的OD值/β-actin的OD值计算Ascl2蛋白相对表达量。试验至少重复3次。
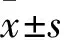
2 结果
2.1MK886对HT-29 细胞Ascl2mRNA表达的影响Ascl2扩增曲线光滑,溶解曲线呈单峰,PCR凝胶电泳显示条带单一,无杂带及非特异性扩增,说明qRT-PCR结果特异性好,结果可靠。观察组Ascl2mRNA的相对表达量为0.35±0.02,对照组为0.72±0.02,两组比较P<0.01。
2.2MK886对HT-29 细胞Ascl2蛋白表达的影响 对照组Ascl2蛋白相对表达量为1.98±0.16,观察组MK886作用24、48、72h时Ascl2蛋白相对表达量分别为1.75±0.13、1.10±0.15、0.71±0.19,与对照组比较均明显降低(P均<0.05);且随着MK886作用时间的延长,Ascl2蛋白相对表达量逐渐下调,存在时间依赖性(P均<0.05)。
3 讨论
结直肠癌发病是多因素、多步骤、多阶段共同作用的结果,但具体发病机制尚不十分清楚。大量研究证实,炎症介质在结直肠癌的发生、发展过程中具有重要作用[7~10]。当炎症因子刺激机体时,被激活的胞质型磷脂酶A2促使膜磷脂释放AA,此时前体化合物AA经5-LOX途径代谢最终产生白三烯类。其中5-LOX是AA生成白三烯类的关键限速酶,其数量和活性可调节下游产物的合成。有研究表明,5-LOX代谢通路中的蛋白在正常组织中不表达或低表达,在肿瘤组织中高表达,5-LOX与肿瘤细胞增殖、转移及侵袭相关,并通过细胞外基质破坏、转移、激活抗凋亡信号通路等促进肿瘤细胞增殖并抗凋亡,抑制该通路可以抑制肿瘤生长[11]。MK886是FLAP抑制剂,可阻止5-LOX的活化,抑制LOX途径下游产物的形成从而发挥抑癌作用。近年来FLAP抑制剂已用于支气管哮喘、类风湿性关节炎等炎症性疾病的治疗[12],但目前其用于结肠癌的报道少见。
Ascl2是一种基本的螺旋-环-螺旋结构的转录因子,在维持胚胎发展过程中滋养层细胞增殖方面发挥重要作用[13]。Jubb等[14]研究发现,Ascl2在结直肠腺癌中高表达,在正常组织中低表达甚至不表达;Ascl2的表达还具有部位特异性,只表达在胎盘和肠黏膜隐窝基底部Lgr5阳性的细胞中[13,14]。Ascl2是Wnt信号通路的靶基因,其转录因子的转基因的过表达可诱导隐窝细胞的过度增殖和绒毛中异常隐窝的形成,敲除Ascl2基因可导致Lgr5阳性细胞的表达消失,故Ascl2基因功能的获得或缺失可能控制着肠干细胞的“命运”[15]。Ziskin等[16]研究发现,在结直肠癌组织中Lgr5/Ascl2表达为74%~85%,且隐窝干细胞来源于Lgr5+/Ascl2+的细胞,主要依赖于Wnt/β-catenin信号通路参与结直肠癌的发生、发展[17]。肠黏膜上皮是哺乳动物中自我更新速度最快的上皮细胞,隐窝是细胞增殖最主要的场所,而干细胞循环池中的干细胞主要存在于隐窝基底部Lgr5阳性细胞中。研究表明,结直肠肿瘤干细胞来源于隐窝干细胞的异常增殖[18]。Ascl2基因能促进肿瘤细胞增殖、抑制其凋亡、促进其耐药,具有肿瘤干细胞的特性;还可作为抑制结肠癌起始细胞的一个潜在靶点,其功能与miR-302b调控的相关机制有关,干扰Ascl2基因的表达可降低结肠癌细胞在体内外的成瘤能力。因此,Ascl2可作为结肠癌干细胞特异性的标志物之一,抑制Ascl2的表达可抑制结肠癌细胞增殖、侵袭及转移。
本研究结果显示,MK886不但可以抑制HT-29细胞增殖,还可下调Ascl2基因及其蛋白表达;说明MK886能抑制结肠癌细胞增殖,此为其应用于结直肠癌放化疗的辅助靶向治疗提供了理论基础。肿瘤干细胞靶向治疗是最近研究的热点,但目前尚处于试验阶段,具体作用机制不清楚,有待后期进一步研究。
综上所述,5-LOX活化蛋白抑制剂MK886能抑制结肠癌细胞增殖,其机制可能与下调Ascl2mRNA及其蛋白表达有关。
[1]DeSantisCE,LinCC,MariottoAB,etal.Cancertreatmentandsurvivorshipstatistics, 2014[J].CACancerJClin, 2014,64(4):252-271.
[2]RoyS,MajumdarAP.Signalingincoloncancerstemcells[J].JMolSignal, 2012,7(1):11.
[3]SteinhilberD,FischerAS,MetznerJ,etal. 5-lipoxygenase:underappreciatedroleofapro-inflammatoryenzymeintumorigenesis[J].FrontPharmacol, 2010(1):143.
[4]BrashAR.Arachidonicacidasabioactivemolecule[J].JClinInvest, 2001,107(11):1339-1345.
[5]AugustEM,NguyenT,MalinowskiNM,etal.Non-steroidalantiinflammatorydrugsandtumorprogression:inhibitionoffibroblasthyaluronicacidproductionbyindomethacinandmefenamicacid[J].CancerLett, 1994,82(1):49-54.
[6]DattaK,BiswalSS,KehrerJP.The5-lipoxygenase-activatingprotein(FLAP)inhibitor,MK886,inducesapoptosisindependentlyofFLAP[J].BiochemicalJ, 1999,340(Pt2):371-375.
[7]GrivennikovSI,GretenFR,KarinM.Immunity,inflammation,andcancer[J].Cell, 2010,140(6):883-899.
[8]RaoCV,JanakiramNB,MohammedA.Lipoxygenaseandcyclooxygenasepathwaysandcolorectalcancerprevention[J].CurrColorectalCancerRep, 2012,8(4):316-324.
[9]UllmanTA,ItzkowitzSH.Intestinalinflammationandcancer[J].Gastroenterology, 2011,140(6):1807-1816.
[10]RaoCV,ReddyBS.NSAIDsandchemoprevention[J].CurrCancerDrugTargets, 2004,4(1):29-42.
[11]GhoshJ.Inhibitionofarachidonate5-lipoxygenasetriggersprostatecancercelldeaththroughrapidactivationofc-JunN-terminalkinase[J].BiochemBiophysResCommun, 2003,307(2):342-349.
[12]Martel-PelletierJ,LajeunesseD,ReboulP,etal.Therapeuticroleofdualinhibitorsof5-LOXandCOX,selectiveandnon-selectivenonsteroidalanti-inflammatorydrugs[J].AnnRheumDis, 2003,62(6):501-509.
[13]MassariME,MurreC.Helix-loop-helixproteins:regulatorsoftranscriptionineucaryoticorganisms[J].MolCellBiol, 2000,20(2):429-440.
[14]JubbAM,ChalasaniS,FrantzGD,etal.Aehaete-scutelike2 (ascL2)isatargetofWntsignallingandisupregulatedinintestinalneoplasia[J].Oncogene, 2006,25(24):3445-3457.
[15]vanderFlierLG,vanGijnME,HatzisP,etal.Transcriptionfactorachaetescute-like2controlsintestinalstemcellfate[J].Cell, 2009,136(5):903-912.
[16]ZiskinJL,DunlapD,YaylaogluM,etal.Insituvalidationofanintestinalstemcellsignatureincolorectalcancer[J].Gut, 2013,62(7):1012-1023.
[17]CadiganKM,WatermanML.TCF/LEFsandWntsignalinginthenucleus[J].ColdSpringHarbPerspectBiol, 2012,4(11):a007906.
[18]FanaliC,LucchettiD,FarinaM,etal.Cancerstemcellsincolorectalcancerfrompathogenesistotherapy:controversiesandperspectives[J].WorldJGastroenterol, 2014,20(4):923-942.
贵州省高层次人才科研条件特助基金资助项目(TZJF-2011-32);贵州省科技计划(黔科合S字[2007]1031)。
赵逵(E-mail: kuizhao95868@msn.com)
10.3969/j.issn.1002-266X.2016.44.014
R735.3
A
1002-266X(2016)44-0043-03
2016-01-20)
