糙叶败酱碱对肺癌SPC-A1细胞增殖的影响及机制
2017-01-06孙志欣张莹
孙志欣,张莹
(天津中医药大学第一附属医院,天津300381)
糙叶败酱碱对肺癌SPC-A1细胞增殖的影响及机制
孙志欣,张莹
(天津中医药大学第一附属医院,天津300381)
目的 观察糙叶败酱碱对肺癌SPC-A1细胞增殖的影响,探讨其作用机制。方法 取对数生长期的人肺腺癌SPC-A1细胞,分别加入适量糙叶败酱碱,使其终浓度为0、5、10、15、20、30、40μmol/L,继续培养24、48h,检测细胞增殖情况,结果显示糙叶败酱碱呈剂量和时间依赖性抑制细胞增殖,最终选用高于及低于半数抑制浓度的10、20μmol/L糙叶败酱碱处理48h进行后续研究。取对数生长期的SPC-A1细胞,分别加入0、10、20μmol/L糙叶败酱碱处理48h,通过流式细胞仪检测G0/G1、S、G2/M期细胞百分比及细胞凋亡率,采用荧光实时定量PCR法检测p21、p53、Bax、细胞周期蛋白依赖性激酶1(CDK1)、血管内皮生长因子(VEGF)、Bcl-2mRNA相对表达量,采用Caspase-3、Caspase-8活性检测试剂盒检测二者活性(以OD值表示活性)。结果 与未加糙叶败酱碱(0μmol/L)细胞比较,10、20μmol/L糙叶败酱碱处理的细胞G0/G1期细胞百分比增加,凋亡率增加,p21、p53、BaxmRNA表达升高,VEGF、CDK1、Bcl-2mRNA表达降低,Caspase-3和Caspase-8活性增加,P均<0.05。结论 糙叶败酱碱可抑制肺癌SPC-A1细胞增殖,激活CDK1、p51、p53等介导的凋亡途径促进细胞凋亡、阻滞细胞周期,可能是其作用机制。
肺癌;糙叶败酱碱;细胞增殖;细胞凋亡
肺癌是全世界发病率和病死率最高的恶性肿瘤之一[1]。手术联合放化疗是肺癌的主要治疗方法,但化疗药物毒副作用大,许多患者无法耐受而放弃治疗[2,3]。糙叶败酱属于败酱科败酱属植物,具有镇静、抗菌、提高免疫力等生物学活性;其化学成分主要有三萜类及其皂苷类化合物、黄酮类化合物、环稀醚萜类化合物及生物碱等。糙叶败酱碱是从糙叶败酱中提取的活性成分,属于N苯甲酰基苯丙氨酸-2-乙酰胺基苯丙醇酯[4,5]。近年研究发现,糙叶败酱碱具有抗肿瘤作用,是一种极有应用价值的抗癌新药[6,7]。2015年11月~2016年1月,本研究观察了糙叶败酱碱对肺癌SPC-A1细胞增殖的影响,现分析结果,并探讨其作用机制。
1 材料与方法
1.1 材料 糙叶败酱碱(纯度95%)为本室提取,用二甲基亚砜(DMSO)溶解,配成浓度为50 mmol/L的储存液,-20 ℃保存,使用前用RPMI 1640完全培养基稀释至所需浓度。人肺腺癌细胞SPC-A1购自上海生命科学研究院细胞生物学研究所。CCK-8试剂盒、Caspase-3及Caspase-8活性检测试剂盒购自碧云天生物技术研究所;细胞周期和凋亡检测试剂盒购于美国BD Bioscience公司;实时荧光定量PCR试剂盒和PrimeScript RT-PCR反转录试剂盒购自Takara公司;p21、细胞周期蛋白依赖性激酶1(CDK1)、血管内皮生长因子(VEGF)、Bcl-2、Bax、p53抗体和相应二抗均购于Santa Cruz公司。
1.2 糙叶败酱碱实验浓度、作用时间确定 人肺腺癌细胞SPC-A1培养于含10% 胎牛血青的RPMI 1640培养基,于37 ℃、5% CO2条件下孵育,取对数生长期细胞接种于96孔板,随机分为七组,分别加入适量糙叶败酱碱,使其终浓度为0、5、10、15、20、30、40 μmol/L,分别于培养24、48 h时采用CCK-8试剂盒检测各组细胞增殖情况(具体步骤参照试剂盒说明书),计录各组450 nm处吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-实验组A值/对照组A值)×100%。结果显示,糙叶败酱碱可抑制SPC-A1细胞增殖,并且其抑制作用呈浓度和时间依赖性。糙叶败酱碱处理24、48 h时对SPC-A1细胞生长抑制的半数抑制浓度(IC50)分别为(27±0.016)、(16±0.023)μmol/L。后续实验选用高于及低于IC50的10、20 μmol/L糙叶败酱碱处理48 h。
1.3 糙叶败酱碱干预及相关指标观察 ①细胞周期:取对数生长期SPC-A1细胞,调整细胞密度为2×105个/mL接种于6 cm培养皿,分别加入0、10、20 μmol/L糙叶败酱碱处理48 h,流式细胞仪分析细胞周期,计算G0/G1、S、G2/M期细胞百分比。②细胞凋亡情况:取对数生长期SPC-A1细胞,调整细胞密度为5×104个/孔接种于6孔板,分别加入0、10、20 μmol/L糙叶败酱碱处理48 h,收集各组细胞,采用流式细胞仪检测细胞凋亡率。③细胞p21、p53、Bax、VEGF、CDK1、Bcl-2 mRNA表达:将对数生长期SPC-A1细胞以5×104个/孔接种于6孔板,分别加入0、10、20 μmol/L糙叶败酱碱处理48 h,收集细胞,采用荧光实时定量RT-PCR法检测p21、p53、Bax、VEGF、CDK1、Bcl-2 mRNA的相对表达量。④细胞Caspase-3和Caspase-8活性:取步骤③收集的各组细胞,采用Caspase-3、Caspase-8活性检测试剂盒检测二者活性,步骤均参照试剂盒说明书,采用酶标仪测定450 nm波长处各组吸光度(OD)值,以此表示Caspase-3、Caspase-8的相对活性。

2 结果
2.1 细胞周期及细胞凋亡率 10、20μmol/L糙叶败酱碱干预后细胞G0/G1期细胞百分比及细胞凋亡率均高于未加糙叶败酱碱(0μmol/L)细胞(P均<0.05)。见表1。

表1 不同浓度糙叶败酱碱处理48 h时 SPC-A1细胞周期分布和凋亡率比较
注:与0 μmol/L比较,*P<0.05;与10 μmol/L比较,△P<0.05。
2.2 p21、p53、Bax、VEGF、CDK1、Bcl-2 mRNA表达 10、20 μmol/L糙叶败酱碱处理48 h细胞p21、p53、Bax mRNA表达高于未加糙叶败酱碱细胞,VEGF、CDK1、Bcl-2 mRNA表达低于未加糙叶败酱碱细胞,P均<0.05。见表2。
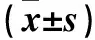
表2 不同浓度糙叶败酱碱处理48 h时SPC-A1细胞p21、p53、Bax、VEGF、CDK1、Bcl-2 mRNA相对表达量比较
注:与0 μmol/L比较,*P<0.05;与10 μmol/L比较,△P<0.05。
2.3 Caspase-3、Caspase-8活性 10、20 μmol/L糙叶败酱碱处理48 h细胞Caspase-3和Caspase-8相对活性均高于未加糙叶败酱碱细胞(P均<0.05)。见表3。
3 讨论
糙叶败酱作为药用植物具有丰富的生物学活性,其中糙叶败酱总木脂素、总皂苷对体外培养的肺癌SPC-A1细胞、 肝癌HepG2细胞和白血病K562细胞的生长均具有抑制作用,且抑制作用与药物浓度及作用时间相关[8,9],但其具体作用机制尚未明确。
本研究发现, 糙叶败酱碱可将肺癌SPC-A1细胞阻滞于G0/G1期,并抑制细胞增殖、促进细胞凋亡,且上述作用呈现浓度依赖性增加的趋势。VEGF在新生血管生成中发挥重要作用,是介导肿瘤细胞新生血管生长的关键因素[15]。本研究结果显示,糙叶败酱碱可下调VEGF表达,提示糙叶败酱碱对肺癌细胞的抑制作用可能与阻断新生血管生长有关。CDK1通过与cyclin形成复合物使目标底物磷酸化,调节细胞周期[10];p21通过与细胞周期蛋白、CDK结合为周期素依赖激酶(CDKs)复合物,导致细胞周期阻滞,阻断细胞增殖过程[11];p53蛋白可激活p21,使其发挥细胞周期抑制作用,并修复受损的DNA,还可促进DNA修复不成功的细胞进入凋亡程序[12]。本研究发现,糙叶败酱碱可抑制CDK1表达,促进p53和p21表达,提示调控CDK1、p21、p53表达,介导DNA损伤修复,可能亦是糙叶败酱碱抑制肺癌细胞增殖的作用机制。Bcl-2 基因是凋亡基因Bcl-2家族的重要成员,对细胞凋亡有明显的抑制作用[13];Bax基因也是Bcl-2家族的重要成员,主要发挥促凋亡作用,亦可与Bcl-2等抗凋亡因子协同作用调控细胞的凋亡过程[14]。凋亡发生机制中最关键的环节之一是Caspase-3激活并引发级联反应。Caspase-8通常以酶原的形式存在,被Caspase-3激活后可进一步激活下游凋亡基因,发生促凋亡功能。Bcl-2是 Caspase-3的上游基因,通过抑制Caspase-3激活而发挥作用[15]。Bcl-2还是Caspase-3的直接底物,Caspase-3激活后可特异性酶解Bcl-2片段,使Bcl-2从抑制凋亡变为触发凋亡[16~18]。本研究10、20 μmol/L糙叶败酱碱处理48 h SPC-A1细胞Bax表达明显高于、Bcl-2表达明显低于未加糙叶败酱碱细胞,进一步活化Caspase-3和Caspase-8,促进凋亡的发生。
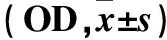
表3 不同浓度糙叶败酱碱处理48 h时SPC-A1细胞Caspase-3、Caspase-8相对活性比较
注:与0 μmol/L比较,*P<0.05。
综上所述,糙叶败酱碱可抑制肺癌SPC-A1细胞增殖、促进细胞凋亡,激活CDK1、p51、p53介导的凋亡途径,调节Bax、Bcl-2等基因表达,活化Caspase-3、Caspase-8可能是其作用机制。
[1] Islami F, Torre LA, Jemal A. Global trends of lung cancer mortality and smoking prevalence [J]. Transl Lung Cancer Res, 2015,4(4):327-338.
[2] Boolell V, Alamgeer M, Watkins DN, et al. The evolution of therapies in non-small cell lung cancer[J]. Cancers, 2015,7(3):1815-46.
[3] Lemjabbar-Alaoui H, Hassan OU, Yang YW, et al. Lung cancer: biology and treatment options[J]. Biochim Biophys Acta, 2015,1856(2):189-210.
[4] 顾正兵,杨根金,李延钊,等.糙叶败酱碱的分离与结构鉴定[J].药学学报,2002,37(11):867-869.
[5] Uddin SJ, Grice D, Tiralongo E. Evaluation of cytotoxic activity of patriscabratine, tetracosane and various flavonoids isolated from the Bangladeshi medicinal plant Acrostichum aureum[J]. Pharm Biol, 2012,50(10):1276-1280.
[6] Yuan L, Wang JH, Sun TM. Total synthesis and anticancer activity studies of the stereoisomers of asperphenamate and patriscabratine[J]. Chin Chem Letters, 2010(21):155-158.
[7] Akter R, Uddin SJ, Tiralongo J, et al. A new cytotoxic steroidal glycoalkaloid from the methanol extract of blumea lacera leaves[J]. J Pharm Pharm Sci, 2015,18(4):616-633.
[8] 陈茹,赵健雄,王学习,等.糙叶败酱总木脂素对K562细胞体外生长的影响[J].四川中医,2007,25(5):14-17.
[9] 陈茹,赵健雄,王学习.糙叶败酱提取物的体外抗肿瘤活性比较[J].四川中药,2011,29(1):50-52.
[10] Sakurikar N, Eichhorn JM, Chambers TC. Cyclin-dependent kinase-1 (Cdk1)/cyclin B1 dictates cell fate after mitotic arrest via phosphoregulation of antiapoptotic Bcl-2 proteins[J]. J Biol Chem, 2012,287(46):39193-39204.
[11] Xu H, Wang Z, Jin S, et al. Dux4 induces cell cycle arrest at G1 phase through upregulation of p21 expression[J]. Biochem Biophys Res Commun, 2014,446(1):235-240.
[12] Qi LW, Zhang Z, Zhang CF, et al. Anti-colon cancer effects of 6-shogaol through G2/M cell cycle arrest by p53/p21-cdc2/cdc25A crosstalk[J]. Am J Chin Med, 2015,43(4):743-756.
[13] Laulier C, Lopez BS. The secret life of Bcl-2: apoptosis-independent inhibition of DNA repair by Bcl-2 family members[J]. Mutat Res, 2012,751(2):247-257.
[14] Brady HJ, Gil-Gómez G. The pro-apoptotic Bcl-2 family member, Bax[J]. Int J Biochem Cell Biol, 1998,30(6):647-650.
[15] 连娇燕,金海,文国容,等.线粒体凋亡通路在肝细胞癌发生、发展中作用的研究进展[J].山东医药,2016,56(8):95-97.
[16] 仇志富,吴晓光,孟杰,等.补阳还五汤提取物灌胃对脑出血大鼠脑组织中PI3K、AKT、Caspase-3表达的影响[J].山东医药,2016,56(9):29-31.
[17] 王智明,张雨霏,叶明,等.自噬相关基因Bcelin-1与凋亡相关基因Bcl-2在舌鳞状细胞癌中的表达与意义[J].临床军医杂志,2015,43(7):762-765.
[18] Uddin SJ, Grice D, Tiralongo E. Evaluation of cytotoxic activity of patriscabratine, tetracosane and various flavonoids isolated from theBangladeshi medicinal plant Acrostichum aureum[J]. Pharm Biol, 2012,50(10):1276-1280.
天津市高等学校科技发展基金计划项目(20110223)。
10.3969/j.issn.1002-266X.2016.44.011
R734.2
A
1002-266X(2016)44-0035-03
2016-01-12)
