二氢嘧啶脱氢酶基因的T85C和A1627G联合突变对乳腺癌患者预后的影响
2016-11-22刘晓丽黄勇杨丽敏余峰谷峰马勇杰
刘晓丽,黄勇,杨丽敏,余峰,谷峰,马勇杰
(天津医科大学肿瘤医院肿瘤研究所肿瘤细胞生物学实验室,国家肿瘤临床研究中心,教育部乳腺癌防治重点实验室,天津300060)
论著
二氢嘧啶脱氢酶基因的T85C和A1627G联合突变对乳腺癌患者预后的影响
刘晓丽,黄勇,杨丽敏,余峰,谷峰,马勇杰
(天津医科大学肿瘤医院肿瘤研究所肿瘤细胞生物学实验室,国家肿瘤临床研究中心,教育部乳腺癌防治重点实验室,天津300060)
目的:探讨二氢嘧啶脱氢酶基因(DPYD)的T85C和A1627G突变对浸润性乳腺癌患者生存的影响。方法:采用SPSS19.0软件进行统计学分析,使用临床资料完整的173例浸润性乳腺癌患者的石蜡包埋组织标本,检测并分析了DPYD基因编码序列的第85位点和第1627位点的核苷酸突变情况,并分析其与患者预后的关系。结果:T85C和A1627G位点联合突变与患者的淋巴结转移状态呈正相关。T85C和A1627G位点单突变对乳腺癌患者预后无影响,而与对照组相比,存在T85C和A1627G位点联合突变的乳腺癌患者预后较差,差异具有统计学意义。结论:中国乳腺癌患者中,DPYD基因T85C和A1627G联合突变与患者的淋巴结转移状态相关,T85C和A1627G联合突变的患者预后较差。
乳腺癌;二氢嘧啶脱氢酶基因;突变;预后
乳腺癌是严重危害女性生命健康的常见恶性肿瘤之一,全球每年约有120余万妇女患乳腺癌,约50万妇女死于乳腺癌,且其发病率呈较快增长趋势,我国乳腺癌患者发病每年约以3%~4%以上的速度递增,因此,预防和治疗乳腺癌意义重大[1-2]。二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase,DPD)由二氢嘧啶脱氢酶基因(DPYD)编码产生。人DPYD基因定位于染色体1p22上,全长约950 kb,包括23个外显子。研究表明,DPYD基因序列上碱基的突变可能引起DPD结构及活性的改变。迄今为止共发现至少50种DPYD的单核苷酸多态性(single nucleotidepolymorphisms,SNP),其中大部分SNP是在DPD酶活性缺乏的患者中测得的[3-4]。目前的研究表明,DPD是在核酸和5-氟尿嘧啶(5-Fu)代谢通路中起重要作用的酶,与肿瘤的进展、肿瘤患者对以5-Fu为基础的肿瘤化疗的敏感性及毒性有关[5-6]。Gamelin等[7]研究81例结肠癌患者外周血单核细胞DPYD活性,发现其与5-Fu化疗的毒性呈负相关。Tershima等[8]报道胃癌组织中DPD活性越低,肿瘤对5-Fu的反应就越敏感[8]。值得注意的是,目前对于DPYD基因突变是否影响乳腺癌患者的生存预后尚无报道,在本研究中,我们首次探讨了DPYD基因中T85C和A1627G突变对乳腺癌患者生存预后的影响。
1 资料与方法
1.1病例资料随机选取2010年在天津医科大学肿瘤医院接受外科手术治疗的173例浸润性乳腺癌患者的石蜡包埋标本,患者病例信息完整,均为女性,年龄32~75岁,平均年龄(53.31±10.25)岁,所有患者在手术前均未接受过任何肿瘤相关治疗。根据WHO乳腺癌组织分类标准分别记录患者的临床病理参数:年龄、肿瘤大小、组织学分级、淋巴结状态和激素受体状态等。其中年龄分为≤50岁和>50岁,肿瘤大小分为≤2 cm和>2 cm,组织学分级用Elston评分标准进行。本研究经天津医科大学伦理委员会批准,所有患者均签署知情同意书。
患者的随访起点为确诊日期,末次随访时间为2015年8月27日,平均随访48.2月。患者的生存状态包括死亡和复发情况。肿瘤的复发主要为局部复发(同侧锁骨上、胸壁复发、内乳淋巴结转移)、对侧新发和远处转移(对侧锁骨上、颈部淋巴结,肝、骨、肺、脑等其他远处器官的转移)。患者的无进展生存时间定义为从手术之日起至首次发生肿瘤复发或最后一次随访的时间。总生存时间定义为从手术之日起至患者死亡或最后一次随访的时间。至随访截止日,有22例(12.7%)患者出现了肿瘤的复发或远处转移,有13例(7.5%)患者死于乳腺癌,有160例(92.5%)患者健在,无失访病例。
1.2突变检测DPYD突变检测采用DPD基因突变检测试剂盒(diagnostic kit for DPD mutation,中山大学达安基因股份有限公司),定性检测乳腺癌石蜡包埋组织的人基因组DNA中的DPYD基因编码序列的第85位点和第1627位点的单核苷酸多态性。T85C SNP为DPYD基因编码序列第85位核苷酸由胸腺嘧啶(T)突变为胞嘧啶(C),该突变导致半胱氨酸变为精氨酸;A1627G SNP为DPYD基因编码序列第1627位核苷酸由腺嘌呤(A)突变为鸟嘌呤(G),该突变导致异亮氨基酸被缬氨酸替代。该试剂盒检测基因突变的原理是采用毛细管电泳技术取代传统的聚丙烯酰胺电板电泳,应用ABI公司专利的四色荧光染料标记的双脱氧核糖核苷酸(ddNTP)为反应底物,通过单引物PCR测序反应,生成的PCR产物则是相差1个碱基的3′末端为4种不同荧光染料的单链DNA混合物,使得4种荧光染料的PCR产物可以在一根毛细管内电泳。由于PCR产物分子量不同,在毛细管电泳中的迁移率也不相同,当其通过毛细管读数窗口段时,激光检测器窗口中的电荷耦合元件(CCD)摄影机检测器就可对荧光分子逐个进行检测,激发的荧光经光栅分光,以区分代表不同碱基信息的不同颜色的荧光,并在CCD摄影机上同步成像,分析软件可自动将不同荧光信息转换为DNA序列信息,从而达到DNA测序的目的。在突变检测时,为了进行质量控制,设置野生型阳性对照、突变型阳性对照和空白阴性对照,用于判断突变检测的准确性,准确性为100%。
1.3统计学方法所有研究数据采用SPSS19.0统计软件包进行数据分析,以P<0.05为差异具有统计学意义的检验标准。各组间临床病理资料及差异的比较使用χ2检验,DPYD基因突变情况与乳腺癌临床病理参数的相关性分析采用Spearman秩相关检验。Kaplan-Meier法(乘积极限法)用于绘制生存曲线,生存检验采用Log-rank检验,分析DPYD基因突变对乳腺癌患者预后的影响。
2 结果
2.1 T85C单突变与浸润性乳腺癌临床病理参数无相关性及对乳腺癌患者的预后无影响Kaplan-Meier生存分析发现,DPYD基因的T85C单突变对患者预后无明显影响,突变组患者的总生存(P=0.253)和无进展生存(P=0.337)与对照组患者无明显差别(图1)。
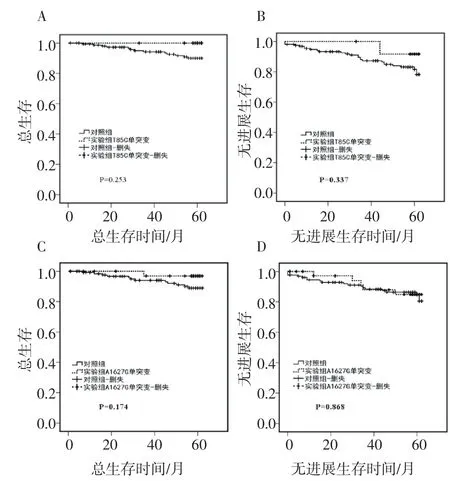
图1 T85C单突变和A1627G单突变的总生存和无进展生存曲线分析Fig 1 OS&PFS curve of T85C single mutation and A1627G single mutation
本研究分析了T85C单突变与浸润性乳腺癌的各项临床病理参数的相关性,发现T85C位点单突变与包括年龄、组织学分级、肿瘤大小、淋巴结转移状态、复发和/或远处转移、雌激素受体状态(ER)、孕激素受体状态(PR)、人类表皮生长因子受体2状态(Her2)、细胞核相关抗原(Ki67)在内的病理指标均无相关性(表1)。
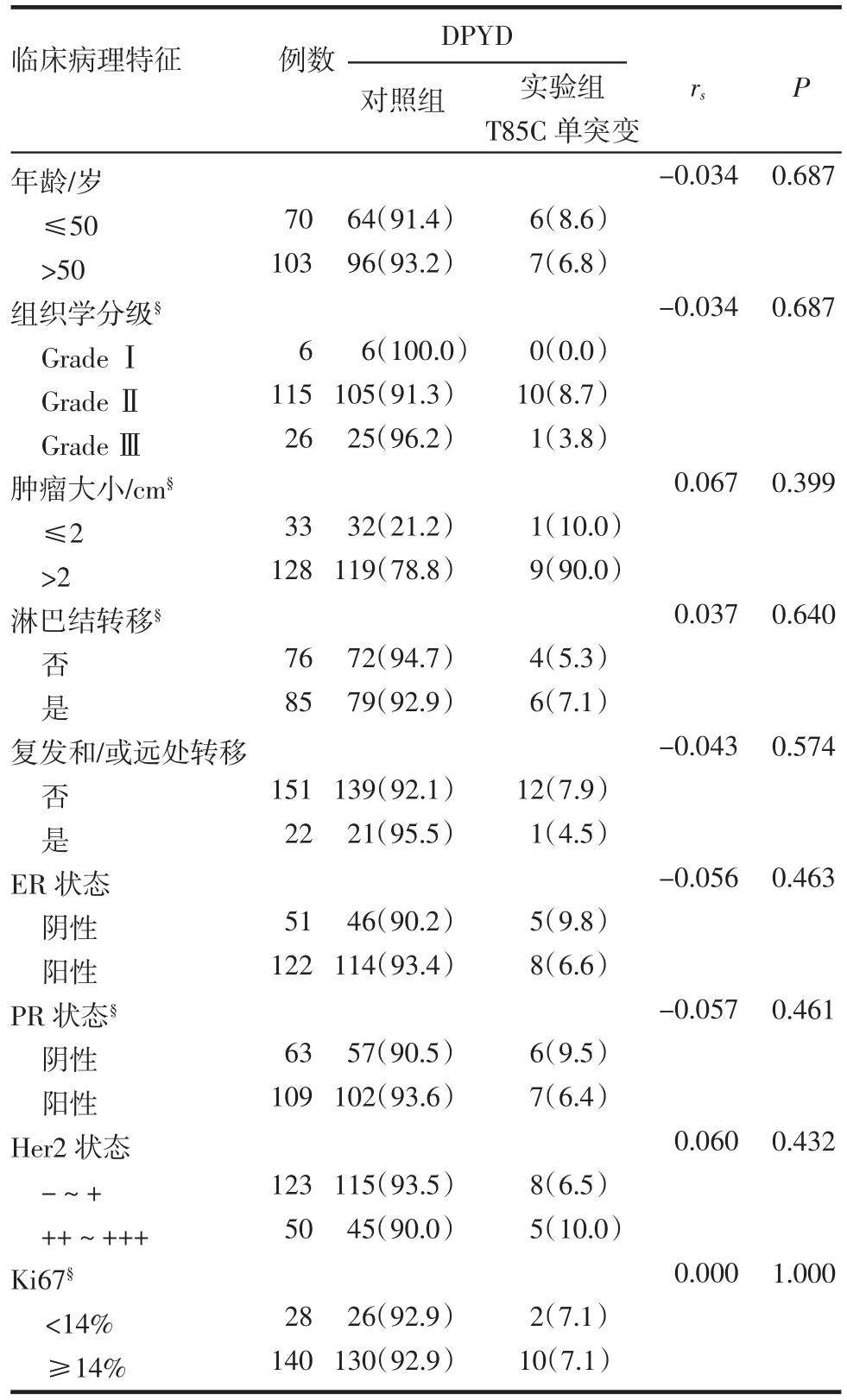
表1 DPYD的T85C单突变与浸润性乳腺癌临床病理参数的相关性[n(%)]Tab 1 Association of T85C single m utation of DPYD and pathological features of invasive breast cancer[n(%)]
2.2 A1627G单突变与浸润性乳腺癌临床病理参数无相关性及对乳腺癌患者的预后无影响Kaplan-Meier生存分析发现DPYD基因的A1627G单突变对病人预后也无明显影响,突变组患者的总生存(P=0.174)和无进展生存(P=0.868)与对照组患者相比无明显差别(图1C、D);笔者还分析了A1627G单突变与浸润性乳腺癌患者的各项临床病理参数的相关性,发现A1627G单突变与患者年龄、组织学分级、肿瘤大小、淋巴结转移、复发和/或远处转移、ER状态、PR状态、Her2状态、Ki67等指标均无相关性(表2)。
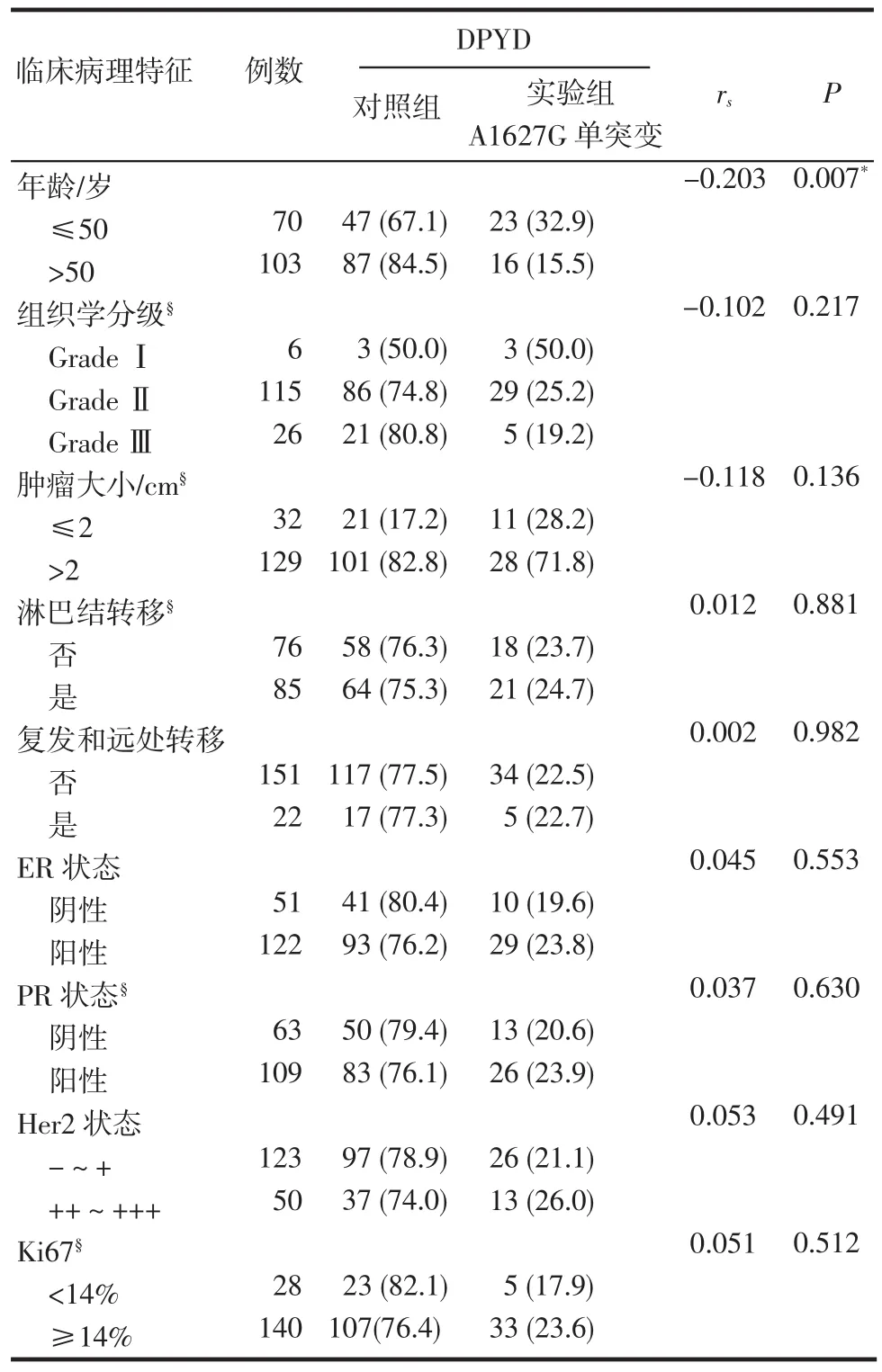
表2 DPYD的A1627G单突变与浸润性乳腺癌临床病理参数的相关性[n(%)]Tab 2 Association ofA1627G singlemutation ofDPYDand pathological features of invasive breast cancer[n(%)]
2.3 T85C和A1627G联合突变的乳腺癌患者预后差T85C和A1627G联合突变的患者与对照组患者相比,预后较差。33.3%(3/9)的T85C和A1627G联合突变患者在随访期间发生了复发或远处转移,而11.6%(19/164)的对照组患者在随访期间发生了复发或远处转移。并且,联合突变组患者的总生存期(P=0.036)和无进展生存期(P=0.021)均明显缩短,其平均生存期为52.7月,22.2%(2/9)患者死亡,而对照组的患者平均生存期为59.7月,6.7%(11/ 164)患者死亡(图2)。
分析T85C和A1627G联合突变与浸润性乳腺癌的各临床病理参数之间的相关性,发现T85C和A1627G联合突变与淋巴结转移有相关性,且成正相关(rs=0.176,P=0.026),T85C和A1627G联合突变的患者中88.9%(8/9)发生了淋巴结转移,对照组患者中50.6%(77/152)发生了淋巴结转移,差异具有统计学意义(表3)。
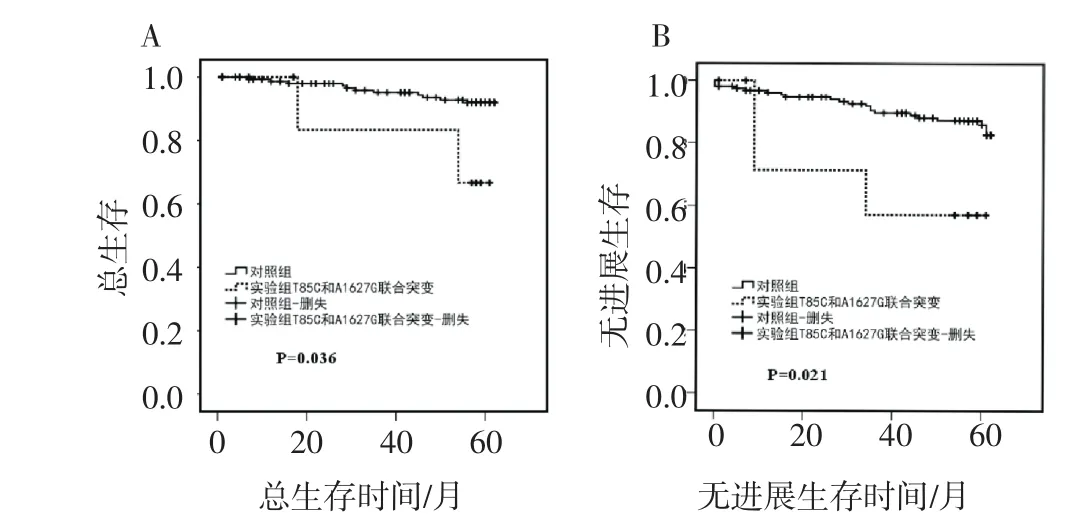
图2 T85C和A1627G联合突变的总生存和无进展生存曲线分析Fig 2 OS&PFS curve of combined mutations of T85C and A1627G
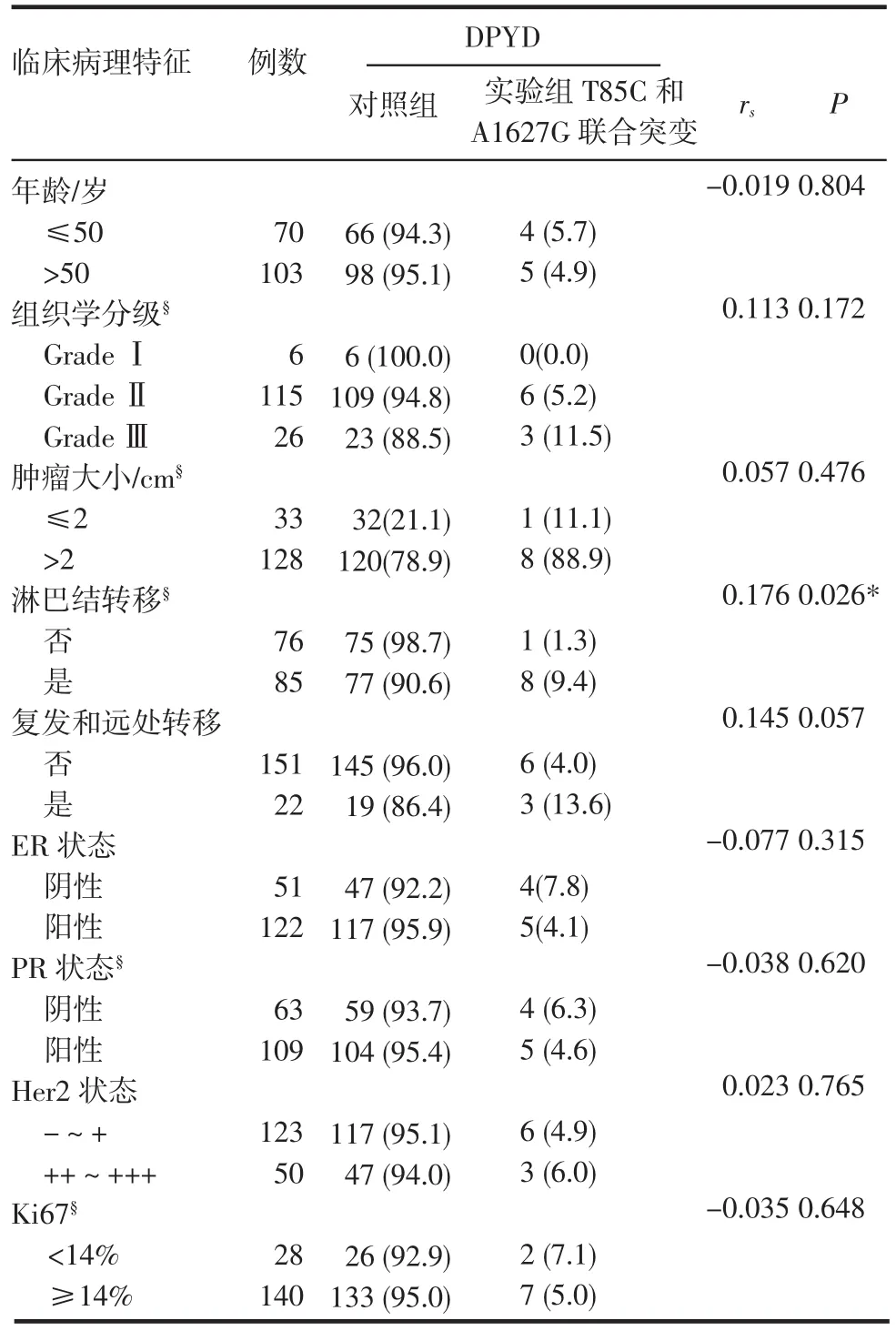
表3 DPYD的T85C和A1627G联合突变与浸润性乳腺癌临床病理参数的相关性[n(%)]Tab 3 Association of com bined m utations of T85C with A1627G of DPYD and pathological features of invasive breast cancer[n(%)]
3 讨论
人类编码的DPYD基因的多态性包括序列重复丢失、插入以及SNP,其中SNP是最常见的表现形式。研究报道中出现频率较高的6种DPYD突变型基因分别为DPYD-2,-3,-4,-5,-9,-12,其中DPYD-5(A1627G)和DPYD-9A(T85C)在中国汉族乳腺癌患者中发生率较高,DPYD-5发生率约为39.8%,DPYD-9A发生率约为20.4%,DPYD-5和DPYD-9A联合突变的发生率约为9.7%[9]。
尽管已明确DPD缺乏症的分子基础为DPYD基因突变,但也有研究表明,不同个体中相同的DPYD突变对DPD酶活性的影响可能不同。如错义突变DPYD-9A可引起DPD活性降低[10],应用大肠杆菌表达系统也证实这一突变可导致翻译产生的DPD酶活性完全缺乏[11],但是也有研究表明DPYD-9A(T85C)在人群中的发生率高达33.8%,且与DPD活性无关,并报道2例DPYD-9A纯合子突变基因型的个体表现为正常的DPD活性。同一作者还报道23例DPD活性缺乏者中仅4例存在DPYD基因突变(17%),因而认为DPD缺乏症的基因型和表型之间缺乏相关性[12]。有研究表明,DPD活性缺乏和DPD活性正常的人群中均存在T85C、G1601A、A1627G以及G2194A等错义突变,而这些错义突变与DPD活性缺乏并不相关[13]。有报道使用PCR技术检测了142例大陆肿瘤患者中的DPD基因,发现T85C、A1627G、T1896C和G2194A基因位点发生突变,但这些位点的基因突变是否引起DPD活性的降低尚未明确[14]。
DPD在黏液细胞癌和分化较差的腺癌中表达水平较高,且与肿瘤浸润深度和淋巴结转移相关[15]。在胃癌组织中DPD表达比正常组织高,多因素分析显示DPD表达阳性患者的总死亡危险性是阴性者的4.9倍[14]。遗憾的是,迄今为止,DPYD基因与DPD表达水平及其生物活性与乳腺癌临床表现之间的关系尚无明确结论。其原因是多种多样的,首先DPYD基因突变与DPD的表达水平的关系不明确,DPD酶缺乏症可能表现为多种遗传方式,关于确切的遗传方式目前存在争议;其次,DPD酶的表达水平不能完全反映其生物学活性的高低,这为应用DPYD基因及DPD表达水平指导临床实践带来了极大的困难。
本研究首次探索了DPYD基因T85C、A1627G突变而非其生物活性或表达对乳腺癌患者生存的影响。我们发现T85C、A1627G各自单突变均不影响患者生存,而T85C和A1627G位点联合突变与乳腺癌患者的淋巴结转移呈正相关,并且患者生存期短,预后差,差异具有统计学意义。
[1]董敏,马义德.基于乳腺肿瘤细胞形态特征参数的乳腺癌诊断发展研究[J].中华临床医师杂志:电子版,2013,7(11):5023
[2]方琼英,吴琼,张秀玲,等.乳腺癌的流行现状分析[J].中国社会医学杂志,2012,29(5):333
[3]刘伟先,赵伟珠.基因多态性与胃癌个体化治疗的研究进展[J].临床荟萃,2012,27(17):1549
[4]陶昀璐.结直肠癌中DPYD基因变异的研究进展[J].肿瘤研究与临床,2014,26(3):206
[5]蔡讯,方珏敏,薛鹏,等.二氢嘧啶脱氢酶基因IVS14+1多态性联合氟尿嘧啶血药浓度检测在预测及减少结直肠癌氟尿嘧啶为基础化疗不良反应中的作用[J].中国癌症杂志,2013,23(2):130
[6]王勇,徐曦,王慧.结直肠癌患者DPYD基因多态性与5-FU毒性反应相关的Meta分析[J].山东医药,2014,54(41):18
[7]Gamelin E,Boisdron-Celle M,Guérin-Meyer V,et al.Correlation between uracil and dihydrouracil plasma ratio,fluorouracil(5-FU)pharmacokinetic parameters,and tolerance in patients with advanced colorectal cancer:A potential interest for predicting 5-FU toxicity and determining optimal 5-FU dosage[J].J Clin Oncol,1999,17(4):1105
[8]Terashima M,Irinoda T,Fujiwara H,et al.Roles of thymidylate synthase and dihydropyrimidine dehydrogenase in tumor progression and sensitivity to 5-fluorouracil in human gastric cancer[J]. Anticancer Res,2002,22(2A):761
[9]徐雅莉,孙强,周易冬,等.二氢嘧啶脱氢酶编码基因DPYD*5及*9A突变频率的研究[J].中国肿瘤临床与康复,2009,16(6):499
[10]van Kuilenburg A B,Haasjes J,Richel D J,et al.Clinical implications of dihydropyrimidine dehydrogenase(DPD)deficiency in patients with severe 5-fluorouracil-associated toxicity:identification of new mutations in the DPD gene[J].Clin Cancer Res,2000,6(12):4705
[11]Vreken P A,Meinsma R.Dihydropyrimidine dehydrogenase(DPD)deficiency:identification and expression of missense mutations C29R,R886H and R235W[J].Hum Genet,1997,101(3):333
[12]Collie-Duguid E S,Etienne M C,Milano G,et al.Known variant DPYD alleles do not explain DPD deficiency in cancer patients[J]. Pharmacogenetics,2000,10(3):217
[13]蔡乐,朱珠.二氢嘧啶脱氢酶基因多态性的研究进展[J].中国药学杂志,2008,43(9):644
[14]王磊,胡冰.二氢嘧啶脱氢酶在结直肠癌中的研究现状及进展[J].安徽医药,2010,14(4):373
[15]武月,赵葳,闫兆鹏,等.TS、DPD与5-FU的关系及在消化道肿瘤个体化治疗中的意义[J].现代肿瘤医学,2013,21(7):1656
(2016-01-04收稿)
Effect of combined mutations of T85C and A1627G in dihydropyrim idine dehydrogenase gene on prognosis of patients w ith breast cancer
LIU Xiao-li,HUANG Yong,YANG Li-min,YU Feng,GU Feng,MA Yong-jie
(Department of Tumor Cell Biology,Cancer Institute and Hospital,Tianjin Medical University;National Clinical Research Center for Cancer;Key Laboratory of Breast Cancer Prevention and Therapy,Ministry of Education,Tianjin 300060,China)
Objective:To explore the prognostic effect of two mutations,T85C and A1627G of dihydropyrimidine dehydrogenase(DPYD)gene in invasive breast cancer.Methods:Paraffin-embedded specimens of 173 invasive breast cancer patients were sequenced and the nucleotide mutations at 85 and 1627 locus of DPYD gene coding sequence were detected.SPSS 19.0 software package was used to analysis the relationship between these two mutations and patients′prognosis.Results:T85C combined with A1627G mutations showed a positive association with lymph node metastasis in breast cancer patients.T85C or A1627G single mutation was not correlated with prognosis of breast cancer patients.Patients with both T85C and A1627G mutations showed a worse prognosis compared with other patients.
Conclusion:Combination of T85C with A1627G mutations in DPYD may have a positive association with lymph metastasis in Chinese invasive breast cancer patients.T85C combined with A1627G mutations indicates a worse prognosis.
breast cancer;dihydropyrimidine dehydrogenase gene;mutation;prognosis
R737.9
A
1006-8147(2016)05-0412-05
国家自然科学基金资助项目(81272358)
刘晓丽(1984-),女,医学检验技师,研究方向:恶性肿瘤的发生发展机制;通信作者:马勇杰,E-m ail:yong jiemagu@aliyun.com。
