β片层阻断肽对AD模型小鼠学习记忆及PI3K/AKT信号通路的影响
2016-11-22付雪斐李靖孙凤仙袁小涌王超徐淑梅
付雪斐,李靖,孙凤仙,袁小涌,王超,徐淑梅
(天津医科大学生理学教研室,天津300070)
论著
β片层阻断肽对AD模型小鼠学习记忆及PI3K/AKT信号通路的影响
付雪斐,李靖,孙凤仙,袁小涌,王超,徐淑梅
(天津医科大学生理学教研室,天津300070)
目的:观察β片层阻断肽H102对阿尔茨海默病(AD)模型小鼠学习记忆的影响,探讨其是否通过PI3K/AKT参与Aβ代谢。方法:(1)将APP/PS1双转基因小鼠随机分为模型组和H102给药组,设同月龄同背景的C57BL/6J为正常对照组。H102给药组采用鼻腔给药,5 μL/d。通过Morris水迷宫检测不同组小鼠的空间记忆能力的改变。(2)采用免疫组化、RT-PCR及Western blot技术检测PI3K/AKT信号通路相关蛋白P85、pAKT的表达。结果:(1)Morris水迷宫检测显示H102给药组在定位航行实验以及空间探索实验均优于模型组,且具有统计学意义。(2)PI3K的mRNA在模型组中显著降低,在H102给药组水平显著增高;ITGB5的mRNA水平在模型组升高,在H102给药组中明显下调,在H102给药组和模型组之间有显著差异。(3)与模型组比较H102给药组PI3K(P85)与pAKT的表达量有明显升高。(4)PI3K和AKT免疫组化染色显示H102给药组的阳性细胞在大脑皮层和海马较模型组有显著增加。结论:H102通过激活PI3K/AKT信号通路,使胰岛素降解酶表达增加,进而加强了Aβ的降解,达到治疗AD的作用。
β片层阻断肽;APP/PS1双转基因小鼠;Morris水迷宫;PI3K/AKT信号通路;阿尔茨海默病
阿尔茨海默病(AD)是一种引起痴呆的神经变性疾病。AD发病机制尚未明确,目前主要有3种假说,胆碱能假说,Tau蛋白假说和淀粉样蛋白假说。在这几种假说中淀粉样蛋白假说被越来越多的学者所认可[1]。该假说认为淀粉样斑块的沉积和聚集形成的病理级联是AD重要致病因素[2]。PI3K/AKT通路广泛存在于细胞中,参与细胞生长、增殖、分化,调节信号转导途径。磷酸肌醇3-激酶(PI3K)是受G蛋白偶联受体调节的脂质激酶,参与炎性反应和过敏反应[3]。PI3K由催化亚基P110和调节亚基p85构成,p85氨基末端包含SH3结构域和能够结合到所述SH3结构域果糖富集区。PI3K的P110亚基有同源性的蛋白激酶,还具有磷脂激酶活性。胰岛素降解酶(IDE)是一个中性锌金属肽链内切酶,有研究证明,IDE基因突变会影响Aβ降解,增加AD的患病风险[4]。遗传连锁研究已发现,血浆中Aβ1-42的水平与染色体10q相关,而IDE基因正是位于这段区域[5]。有研究表明AD患者中IDE的表达[6]和催化活性[7]均受到抑制,然而IDE的调节方式的研究相对鲜见报道。课题组前期的研究表明:β片层阻断肽在细胞和小鼠模型中,对Tau蛋白磷酸化有明显的抑制作用[8],同时还可提高Aβ的降解酶IDE、NEP的表达[9]。本研究旨在观察β片层阻断肽H102鼻腔给药对APP/PS1双转基因小鼠脑内PI3K/AKT信号通路的影响,探讨H102提高IDE表达的机制。
1 材料与方法
1.1实验动物APP/PS1双转基因小鼠40只(25.5~30.5 g),同背景的C57BL/6J小鼠20只(23.2~28.61 g),所有小鼠均为24周龄,购于北京华阜康生物科技股份有限公司,饲养于天津医科大学动物中心SPF级动物房,温度为(24±1)℃,12:12 h光/暗周期(6:00 Am)开始给予光照。
1.2药物及材料H102采用Fmoc固相合成并用高效液相色谱纯化,质谱鉴定纯度达95%(上海吉尔生化有限公司)。Anti-pAKT,Anti-AKT,Anti-PI3K购自Abcam公司,USA;即用型SABC免疫组化试剂盒,DAB显色试剂盒购自武汉博士德生物公司;辣根酶标记山羊抗兔IgG,辣根酶标记山羊抗小鼠IgG购自北京博奥森生物科技有限公司。
1.3动物分组与给药方法APP/PS1双转基因AD小鼠随机分为2组:模型组和H102给药组,C57BL /6J小鼠为正常对照组,每组17~20只。采用鼻腔给药方法,H102给药组用自制给药器给予33 mg/mL药液5 μL/d;正常对照组和模型组鼻腔给予等体积辅料溶液(取0.5 g壳聚糖及0.1 g BSA溶于100 mL双蒸水中,摇匀,即为辅料溶液),连续5周。
1.4 Morris水迷宫测试测试主要包括定位航行实验和空间探索实验2个部分。实验前1 d将小鼠置于水迷宫中预游泳2 min,使其适应水迷宫环境。正式实验时,置平台于水迷宫第三象限中环内,每日相同时段每只小鼠游泳2次(每次90 s),历时5 d。记录小鼠寻找并爬上平台所需时间即逃避潜伏期。如果小鼠在90 s内未找到平台,则将其引至平台停留20 s,逃避潜伏期记为90 s,此为定位航行实验。于实验第6日撤去平台进行空间探索实验,相同时间段,任选一个入水点将小鼠放入水中,每只小鼠游泳1次(每次90 s),记录小鼠的游泳轨迹,考察对平台的记忆。选取定位航行实验的平均逃避潜伏期和空间探索实验的跨平台次数及入水朝向角作为衡量其空间学习记忆的主要指标。
1.5脑组织处理腹腔注射10%水合氯醛(4 mL/kg)麻醉小鼠,将麻醉的动物仰卧于冰盘上,伸展固定四肢,迅速剪开胸腹并充分暴露心脏和肝脏。从左侧心尖部迅速插管经左心室至升主动脉弓处并固定,同时剪开右心耳,快速灌注0.01 mol/L PBS 60 mL直至右心室流出澄清液体小鼠肝脏完全变白,冰盘上快速取脑,一侧脑组织分离海马和皮层投入液氮后迅速放于-80℃冻存备用。另一侧将脑组织放入4%多聚甲醛溶液内固定24 h以上,待脑组织下沉后,行蜡块包埋,小鼠脑组织行矢状切面切片,待海马CA1区出现后连续切片,切片厚度5 μm。
1.6 Western blot分析从-80℃冰箱取出组织,根据组织质量加入1:10(m:v)的蛋白裂解液匀浆。低温高速离心,12 000 r/min,5 min,取上清,即为总蛋白提取液。BCA法测定各组织蛋白浓度,并用裂解液将各组织的蛋白浓度调至等浓度,充分混匀后按4∶1加入5×上样缓冲液,混匀,煮沸5 min,即可直接上样。
1.7免疫组化染色石蜡切片常规脱蜡,蒸馏水冲洗;3%H2O2室温避光孵育10 min,蒸馏水浸泡,2 min×3次;加入0.01 mol/L枸橼酸缓冲液中微波沸腾抗原修复,沸腾后间隔10 min,再沸腾,取出冷却至室温,PBS浸泡,2 min×3次;滴加5%BSA封闭,室温避光孵育15 min,倾去,勿洗;滴加稀释好的一抗:PI3K(1∶200)、AKT(1∶100)4℃过夜,PBS冲洗,2 min×3次;滴加生物素标记的羊抗鼠通用二抗,室温孵育20 min,PBS冲洗,3 min×3次;滴加SABC液,避光室温孵育20 min,PBS冲洗,5 min×3次;DAB显色剂显色:EP管中加入1 mL双蒸水,A、B、C液各滴1滴,混匀,镜下控制染色程度,去离子水终止显色反应后充分冲洗;苏木素复染,双蒸水充分冲洗,盐酸酒精分化,梯度酒精常规脱水,二甲苯透明,中性树胶封片,于显微镜下观察。
1.8 Real-time PCR Trizol一步法提取总RNA,测定总RNA浓度,逆转录cDNA。20 μL的RT-PCR反应体系含:10 μL的2×SYBR Green PCR Master Mix、5 μL的RNase Free Water、上、下游引物(0.05 μg/μL)各0.5 μL和4 μL的cDNA。反应条件:预热变性,95℃,5 min;变性,95℃,30 s;退火,59℃,30 s;延伸,72℃,30 s;共进行40个循环的扩增,72℃延伸8 min。
2 结果
2.1行为学测试结果
2.1.1定位航行实验与正常对照组相比较模型组逃避潜伏期的时间明显延长,其差异具有显著性(P<0.05);H102给药组与模型组相比较,从第二天开始,时间明显缩短,具有统计学差异(P<0.05),见表1。
表1 小鼠逃避潜伏期(n=20,±s±s)Tab 1 Comparison of average escape latency in navigation test(n=20,±s±s)

表1 小鼠逃避潜伏期(n=20,±s±s)Tab 1 Comparison of average escape latency in navigation test(n=20,±s±s)
与正常对照组相比,#P<0.05;与模型组相比,*P<0.05
组别1 d 2 d 3 d 4 d 5 d正常对照组58.991±10.80 50.443±6.370 42.215±0.940 31.201±0.433 22.186±1.618模型组87.494±5.570#88.514±4.642#89.872±0.044#89.860±0.066#89.833±0.921#H102给药组88.197±1.530 61.719±3.660*43.201±0.941*33.356±1.390*26.163±0.543*
2.1.2空间探索实验与正常对照组小鼠比较,模型组跨越隐匿平台次数明显减少,具有显著性差异(P<0.05);H102给药组与模型组比较跨越隐匿平台次数明显增多,差异有统计学意义(P<0.05)。模型组小鼠的朝向角,与正常对照组比较,明显偏大,具有显著性差异(P<0.05);与模型组比较,H102给药组朝向角明显偏小,具有显著性差异(P<0.05),见表2。
表2 跨越隐匿平台次数及朝向角(n=20,±s±s)Tab 2 Com parison of frequency span hidden platform and the corner into water in space exploration experim en(n=20,±s±s)

表2 跨越隐匿平台次数及朝向角(n=20,±s±s)Tab 2 Com parison of frequency span hidden platform and the corner into water in space exploration experim en(n=20,±s±s)
与正常对照组相比,#P<0.05;与模型组相比,*P<0.05
组别跨越隐匿平台次数/次朝向角/度正常对照组1.60±0.821 38.334±21.264模型组0.00±0.000#129.062±37.672#H102给药组1.20±0.867*45.027±23.936*
2.2 PI3K/AKT信号通路相关蛋白免疫组化实验结果(1)PI3K存在于包浆中,染色呈棕色,H102给药组包浆着色明显,蛋白表达较模型、正常对照组高(均P<0.05),见图1及表3。(2)AKT存在于胞浆中,经过免疫组化染色和细胞计数结果显示在海马的CA1区及大脑皮层,正常对照组阳性细胞率较模型组高,包浆着色明显深,AKT表达增强;模型组较正常对照组阳性细胞率低,包浆着色浅(P<0.05),模型组较H102给药组阳性细胞率较低,包浆着色浅(P<0.05),见图2及表4。
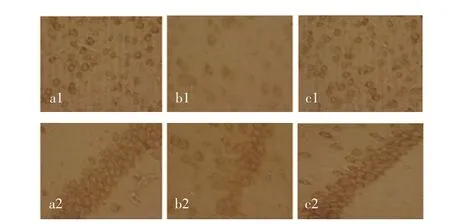
图1 H102对APP/PS1双转基因小鼠大脑皮层及海马CA1区中PI3K表达的影响(IHC,×400)Fig 1 Expressions of PI3K protein in m ouse brain detected by imm unohistochem istry(IHC,×400)
表3 皮层及海马CA1区各组小鼠PI3K的比较(n=20,±s±s)Tab 3 Exp ressions of PI3K detected by immunohistochem istry(n=20,±s±s)
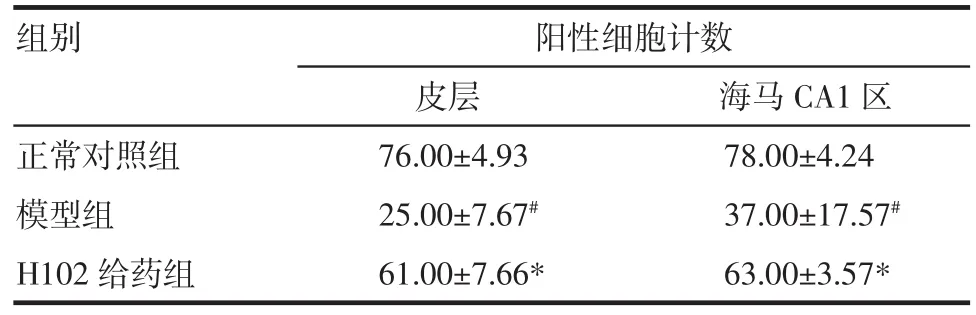
表3 皮层及海马CA1区各组小鼠PI3K的比较(n=20,±s±s)Tab 3 Exp ressions of PI3K detected by immunohistochem istry(n=20,±s±s)
与正常对照组相比,#P<0.05;与模型组相比,*P<0.05
组别阳性细胞计数皮层海马CA1区正常对照组76.00±4.93 78.00±4.24模型组25.00±7.67#37.00±17.57#H102给药组61.00±7.66*63.00±3.57*
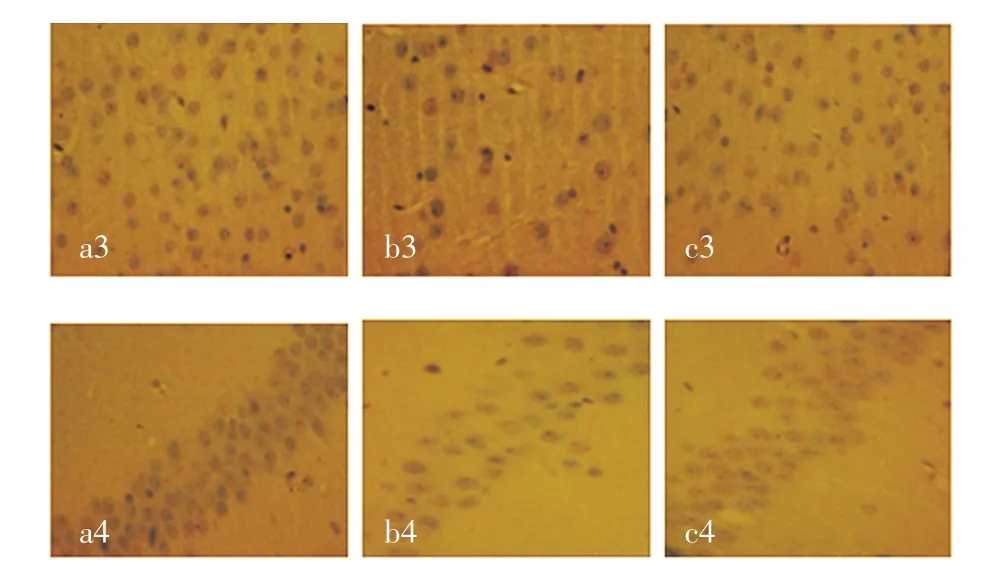
图2 H102对APP/PS1双转基因小鼠大脑皮层及海马CA1区AKT表达的影响(IHC,×400)Fig 2 Expressions of AKT protein in mouse brain detected by immunohistochem istry(IHC,×400)
表4 各组小鼠皮层及海马CA1区AKT的比较(n=20,±s±s)Tab 4 Expressions of AKT detected by immunohistochem istry(n=20,±s±s)
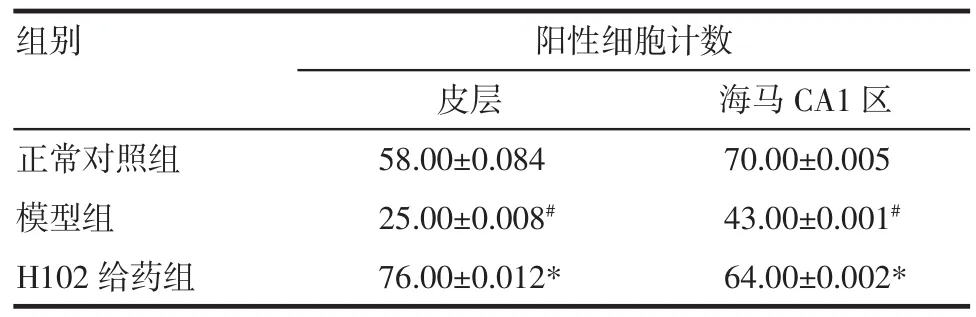
表4 各组小鼠皮层及海马CA1区AKT的比较(n=20,±s±s)Tab 4 Expressions of AKT detected by immunohistochem istry(n=20,±s±s)
与正常对照组相比,#P<0.05;与模型组相比,*P<0.05
组别阳性细胞计数皮层海马CA1区正常对照组58.00±0.084 70.00±0.005模型组25.00±0.008#43.00±0.001#H102给药组76.00±0.012*64.00±0.002*
2.3 PI3K/AKT信号通路相关蛋白Western blot结果(1)PI3K模型组蛋白表达量低于对照组(均P<0.05)。与模型组比较H102给药组PI3K表达量显著增加。见图3及表5。(2)AKT、p-AKT模型组脑内AKT及p-AKT蛋白表达水平低于正常对照组,而H102给药组高于模型组以及正常对照组(P<0.05),见图4及表5。

图3 各组小鼠脑内PI3K蛋白的表达Fig 3 PI3K protein expression in mouse brain by Western blotassay

图4 各组小鼠脑内P-AKT蛋白的表达Fig 4 p-AKT protein expression in mouse brain by W estern blotassay
表5 各组小鼠脑组织中PI3K,AKT和p-AKT蛋白的比较(n=20,±s±s)Tab 5 Expressionsofpurposeprotein detected by W estern blotassay(n=20,±s±s)
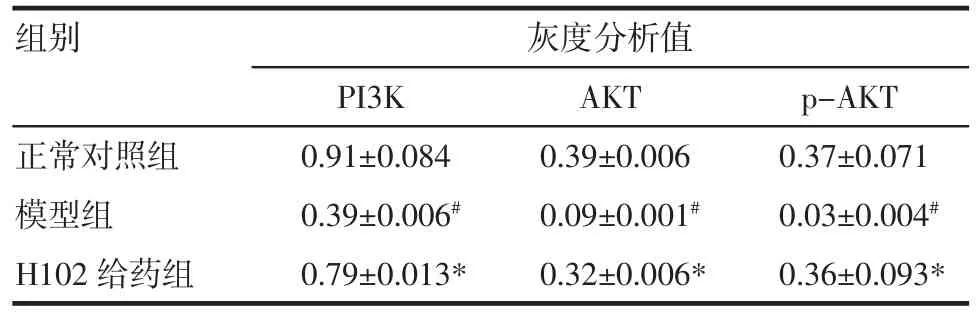
表5 各组小鼠脑组织中PI3K,AKT和p-AKT蛋白的比较(n=20,±s±s)Tab 5 Expressionsofpurposeprotein detected by W estern blotassay(n=20,±s±s)
与正常对照组相比,#P<0.05;与模型组相比,*P<0.05
组别灰度分析值PI3K AKT p-AKT正常对照组0.91±0.084 0.39±0.006 0.37±0.071模型组0.39±0.006#0.09±0.001#0.03±0.004#H102给药组0.79±0.013*0.32±0.006*0.36±0.093*
2.4 ITGB5,PI3K的mRNA表达影响(1)模型组ITGB5的mRNA表达量明显高于正常组,H102给药组与模型组相比ITGB5 mRNA表达量明显减少(均P<0.05)。(2)模型组PI3K的mRNA表达量明显低于正常组,H102给药组与模型组相比PI3K的mRNA表达量明显升高(均P<0.05),见表6。
表6 H 102对AD小鼠脑中ITGB5和PI3Km RNA表达的影响(n=20,±s±s)Tab 6 Expressions of mRNA detected by Real-time PCR(n=20,±s±s)
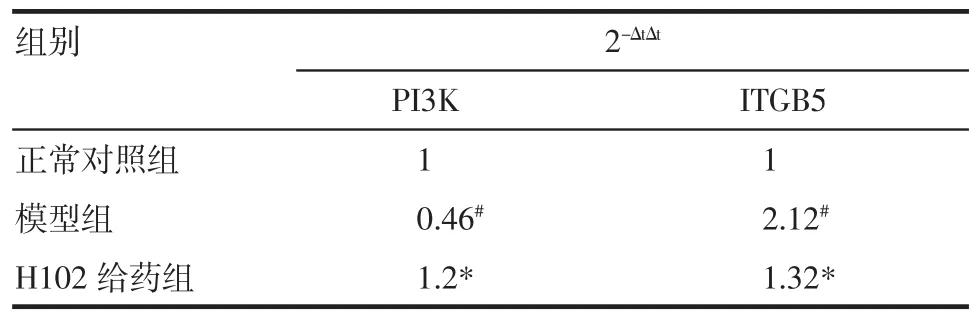
表6 H 102对AD小鼠脑中ITGB5和PI3Km RNA表达的影响(n=20,±s±s)Tab 6 Expressions of mRNA detected by Real-time PCR(n=20,±s±s)
与正常对照组相比,#P<0.05;与模型组相比,*P<0.05
组别2-ΔtΔtPI3K ITGB5正常对照组1 1模型组0.46#2.12#H102给药组1.2*1.32*
3 讨论
Aβ的积累和沉积引起的病理级联是引起AD的基本原因之一[10]。淀粉样蛋白假说认为胞外不可溶的Aβ具有毒性,然而最新的研究认为胞内可溶Aβ的形成才是引起病理级联的关键[11]。以往的很多研究着眼点在Aβ的形成,并且发现家族性AD患者相关基因(P S1,PS2和APP等)的突变导致Aβ的累积或致病性Aβ42的积累导致了异常的聚集;关于Aβ的降解过程的研究相对较少。近几年的研究表明,对于90%的散发型AD患者,Aβ降解失衡可能是导致Aβ增多引发AD的基本原因,因此本研究讨论H102对Aβ的降解和清除过程的影响,探讨相关信号通路在Aβ降解过程中的重要作用。
PI3K/AKT信号通路与细胞内多种调节相关,是细胞周期调控和细胞凋亡的关键通路之一,该通路通过激活PI3K下游的AKT来发挥作用。许多细胞的生存和繁殖受到PI3K/AKT信号通路的调控,通过配体与受体之间的相互作用使下游信号级联介质激活[12-13]。体外研究表明,erythropoietin可以通过PI3K/AKT信号通路对PC12细胞进行保护作用,防止Aβ诱导细胞凋亡[14],PI3K/AKT信号通路在AD的发生、发展乃至治疗中起着重要的作用。
IDE基因位于染色体10q,对于AD的发生产生一定的影响[15-16],对Aβ42具有遗传相关性[17]。研究表明IDE表达的增加[6]以及催化活性的增加[7]会导致遗传性AD的降低。还有研究表明,IDE可能是胰岛素信号传导途径的下游目标的调节器。调节胰岛素信号通路,可以对IDE产生调节作用,增加IDE表达[18]。在以往的实验中,我们已经证明双转基因小鼠中Aβ的mRNA和蛋白水平明显高于正常;H102实验组则有明显的降低,然而IDE的表达量却有所升高[9-19],表明H102以某种方式负向调节Aβ。
ITGB5是整合素家族的成员,有两条不同的链,整合素对于信号通路的调节具有重要作用,可以通过调节细胞信号的跨膜蛋白激酶如受体酪氨酸激酶(RTK)来发挥作用,通过基因芯片技术,我们发现:ITGB5的表达在AD模型组明显高于对照组,而H102组明显降低且与正常对照组无显著差异。而PI3K是细胞存活的一个启动子作用在ITGB5下游,ITGB5可能负调节PI3K。
本研究通过Morris水迷宫测试发现,APP/PS1双转基因小鼠的学习记忆能力较C57BL/6J小鼠明显减弱,H102给药组相较于模型组,其学习记忆能力有明显提高,Real-time PCR的结果显示模型组PI3K的mRNA水平均低于对照组和给药组,模型组ITGB5的mRNA水平均高于对照组和给药组;免疫组化的结果显示模型组脑内PI3K和AKT蛋白表达低于对照组和给药组;Western blot的结果显示模型组脑内的PI3K、p-AKT蛋白表达均低于对照组和给药组。实验结果表明APP/PS1小鼠的PI3K/ AKT信号通路受到了抑制,β片层阻断肽H102可以降低ITGB5的表达,增强PI3K、AKT、p-AKT的表达,可能经由ITGB5,影响PI3K/AKT信号传导途径,使IDE活性增加,促进Aβ的降解清除,进而提高AD模型小鼠的学习记忆能力。
[1]Hardy J,Selkoe D J.The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353
[2]Adlard P A,Tran B A,Finkelstein D I,et al.A review of betaamyloid neuroimaging in Alzheimer's disease[J].Front Neurosci,2014,8:327
[3]Voigt P,Brock C,Nürnberg B,et al.Assigning functional domains within the p101 regulatory subunit of phosphoinositide 3-kinase gamma[J].J Biol Chem,2005,280(6):5121
[4]Hubin E,Cioffi F,Rozenski J,et al.Characterization of insulindegrading enzyme-mediated cleavage of Aβ in distinct aggregation states[J].Biochimica Biophysica Acta,2016,1860(6):1281
[5]Bertram L,Blacker D,Mullin K,et al.Evidence for genetic linkage of Alzheimer's disease to chromosome 10q[J].Science,2000,290(550):2302
[6]Cook D G,Leverenz J B,Mcmillan P J,et al.Reduced hippocampal insulin-degrading enzyme in late-onset Alzheimer's disease is associated with the apolipoprotein E-epsilon 4 allele[J].J Pathol,2003,162(1):313
[7]Kim M,Hersh L B,Leissring M A,et al.Decreased catalytic activity of the insulin-degrading enzyme in chromosome 10-linked Alzheimer disease families[J].J Biol Chem,2007,282(11):7825
[8]徐艳玲,赵娟,马瑞珏,等.H102对APP转基因小鼠脑内淀粉样蛋白和淀粉样蛋白前体蛋白表达的影响[J].中国应用生理学杂志,2010,26(3):302
[9]宋明,李梅,林来祥,等.H102对APP转基因小鼠脑内IDE和NEP表达的影响[J].天津医科大学学报,2010,16(4):566
[10]Adlard P A,Tran B A,Finkelstein D I,et al.A review of β-amyloid neuroimaging in Alzheimer's disease[J].Front Neurosci,2014,8:327
[11]Benek O,Aitken L,Hroch L,et al.A direct interaction between mitochondrial proteins and amyloid-beta peptide and its significance for the progression and treatment of alzheimer's disease[J].Curr Med Chem,2015,22(9):1056
[12]Yang S X,Polley E,Lipkowitz S.New insights on PI3K/AKT pathway alterations and clinical outcomes in breast cancer[J]. Cancer Treat Rev,2016,45:87
[13]Heras-Sandoval D,Pérez-Rojas J M,Hernández-Damián J,et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J].CellSignal,2014,26(12):2694
[14]Barbacid M.Structural and functional properties of the TRK family of neurotrophin receptors[J].Ann N Y Acad Sci,1995,766:442
[15]Son S M,Cha M Y,Choi H,et al.Insulin-degrading enzyme secretion from astrocytes is mediated by an autophagy-based unconventional secretory pathway in Alzheimerdisease[J].Autophagy,2016,10:1
[16]Tundo G,Ciaccio C,Sbardella D,et al.Somatostatin modulates Insulin-Degrading-Enzyme metabolism:implications for the regulation of microglia activity in AD[J].PLoS One,2012,7(4):e34376
[17]Bertram L,Blacker D,Mullin K,et al.Evidence for genetic linkage of Alzheimer's disease to chromosome 10q[J].Science,2000,290(550):2302
[18]Lixia Z,Bruce T,Takashi M.Insulin-Degrading enzyme as a downstream target of insulin receptor signaling cascade:implications for alzheimer's disease intervention[J].J Neur,2004,24(49):11120
[19]Li M,Lin L X,Xu S M.Effects of H102 on cholinergic system and free radicals of APP trangenic mouse[J].Chin J New Drugs Clin Rem,2009,28(2):106
(2016-03-03收稿)
Effect of β-sheet breaker peptide on learning and mem ory and PI3K/AKT signaling pathway in AD model m ice
FU Xue-fei,LI Jing,SUN Feng-xian,YUAN Xiao-yong,WANG Chao,XU Shu-mei
(Department of Physiology,Tianjin Medical University,Tianjin 300070,China)
Objective:To observe the effects of H102 on the learming and memory ability in Alzheimer's disease mice and to explore the mechanism of H102 participating in Aβ metabolism.M ethods:(1)The mice were random ly divided into normal group,model group and H102 group,and were treated with intranasal administrated,5 μL/d.Morris water maze test was used to record different changes in spatial memory of mice.(2)Immunohistochemistry was used to detect a specific protein,and RT-PCR and western blot to detect the expression of P85 and pAKT.Results:(1)Morris water maze test showed the H102 group in place navigation and spatial probe test was superior to the model group,with statistical significance.(2)The level of PI3K mRNA decreased significantly in the model group,with H102 group significantly higher;ITGB5 mRNA levels were significantly lower in H102 group,and there were significant differences between the model and the H102 group.(3)Expression of PI3K(P85)and pAKT in H102 group had significantly increased as compare to the model group.(4)PI3K and AKT immunohistochemistry showed that positive staining cells in the cerebral cortex and hippocampus of H102 group were significantly increased compared with the model group.Conclusion:H102 through the PI3K/AKT pathway of the insulin signaling pathway could increase the expression of IDE,which may further promote the endocytosis and degradation of Aβ in the brain,thus accelerating Aβ degradation,and enhancing therapeutic effect of AD treatment.
β-sheet breaker peptide;APP/PS1 transgene mice;morris water maze;PI3K/AKT signaling pathway;Alzheimer's disease
R338
A
1006-8147(2016)05-0391-05
付雪斐(1990-),女,硕士在读,研究方向:生理学;通信作者:徐淑梅:E-mail: xushm@tijmu.edu.cn。
