重组hIFN-α-2b-BCG抗肿瘤效应的体外研究
2016-11-22王丽宁范晓东孙二琳李娜卢炳新雷铭德丁娜孙岩韩瑞发
王丽宁,范晓东,孙二琳,李娜,卢炳新,雷铭德,丁娜,孙岩,韩瑞发
(天津市泌尿外科研究所,天津医科大学第二医院泌尿外科,天津300211)
论著
重组hIFN-α-2b-BCG抗肿瘤效应的体外研究
王丽宁,范晓东,孙二琳,李娜,卢炳新,雷铭德,丁娜,孙岩,韩瑞发
(天津市泌尿外科研究所,天津医科大学第二医院泌尿外科,天津300211)
目的:了解重组hIFN-α-2b-BCG(rBCG)体外抗肿瘤的作用效果和作用机制。方法:体外共培养后,透射电镜观察不同时间点rBCG对人膀胱肿瘤EJ细胞的影响。吖啶橙染色观察各组肿瘤细胞形态。MTT法检测rBCG对肿瘤细胞生长抑制率。ELISA检测rBCG作用后淋巴细胞分泌Th1型细胞因子水平。LDH释放试验检测rBCG激活的淋巴细胞对肿瘤细胞杀伤效应。结果:BCG和rBCG作用后的肿瘤细胞在透射电镜下和吖啶橙染色后均有显著变化。MTT显示rBCG的生长抑制率显著高于BCG和BCG+IFN-α-2b组。rBCG对淋巴细胞分泌Th1型细胞因子有影响,同时rBCG激活的淋巴细胞对膀胱肿瘤细胞有杀伤作用。结论:重组BCG在体外有优于BCG的免疫调节特性、抗肿瘤作用和直接细胞毒作用。
重组BCG;IFN-α-2b;膀胱肿瘤;免疫疗法
膀胱癌是最常见的泌尿系恶性肿瘤[1]。在我国,膀胱癌居泌尿系恶性肿瘤发病第1位,近年来发病率及死亡率有增高的趋势[2]。卡介苗(BCG)膀胱腔内灌注用于预防和治疗浅表膀胱癌,是膀胱肿瘤最有效的生物治疗法之一[3],同时与膀胱化疗相比BCG在预防肿瘤复发上有明显的优势[4-5]。但因BCG的毒副作用和大约40%的患者对BCG的耐药[6],限制了其广泛应用。近年来,干扰素-α(IFN-α)作为二线药物用于膀胱灌注治疗膀胱肿瘤,对BCG无反应的部分患者有效,且局部和全身毒性较小[7]。INF-α除了单独应用或与BCG联合应用在体内和体外的实验中均已得到证实的优点外,也存在费用昂贵、半衰期短、水溶性易随尿液流失等缺点[8]。因此,能够合成具有持续表达分泌IFN-α功能的重组BCG即可克服上述缺点。重组BCG是应用基因工程技术,将BCG改造成具有携带和表达外源基因的能力。前期笔者已经构建一种重组hIFN-α-2b-BCG(rBCG),以期能够发挥二者优势,同时去除联合应用中的一些不利因素。本文将重组hIFN-α-2b-BCG和人膀胱癌株EJ在体外共同培养,采用透射电镜、荧光染色和流式细胞仪等方法,了解其体外抗肿瘤的作用效果和作用机制。
1 材料与方法
1.1材料丹麦2株BCG D2BP302来自北京生物制品研究所;重组hIFN-α-2b-BCG为本所自行构建保存[9];人膀胱癌细胞为EJ细胞系传代培养,本所保存。主要试剂:胰蛋白酶,中国医药集团上海化学试剂公司;青霉素100 U/μL+链霉素100 μg/μL;吖啶橙,上海远慕生物科技有限公司;乳酸脱氢酶试剂盒,中生北控生物科技股份有限公司;MTT试剂,Sigma公司。
1.2方法
1.2.1细菌和细胞培养BCG的培养:7H9培养基50 mL加入1 mL rBCG或BCG,37℃,饱和湿度,150 r/min摇床内连续震荡培养;7 d左右传一代,根据需要选取不同时期的菌液,洗涤后溶于PBS,测定A600值1.0(约2.7×107CFU)用于实验。
外周血淋巴细胞分离培养:采集健康成人志愿者新鲜外周血;密度梯度离心分离单个核细胞,37℃、饱和湿度、5%CO2培养箱静置4 h,收集非附壁细胞,台盼蓝染液检查所分离的细胞活性:计数200个细胞,活性在95%以上。
膀胱癌株EJ的培养:按常规方法培养(含10%小牛血清的RPMI-1640培养基+双抗),实验前两天换用不含抗生素的RPMI-1640培养基培养,以消除双抗对BCG活性的影响。
取对数生长期肿瘤细胞,培养完全贴壁后,以实验终浓度0.01OD分别加入rBCG和BCG,于37℃,5%CO2,饱和湿度孵箱中培养24、48和72 h。以加PBS的细胞作为空白对照,分别在透射电镜和荧光倒置显微镜下观察。
1.2.2透射电镜形态学观测倒置显微镜下观察不同时间点重组BCG对膀胱肿瘤细胞的影响。透射电镜观察:制备单细胞悬液,离心收集沉淀,2.5%戊二醛磷酸缓冲液固定过夜,0.2 mol/L蔗糖磷酸缓冲液漂洗,1%锇酸后固定,脱水,环氧树脂618包埋,超薄切片后醋酸铀-柠檬酸铅双重电子染色,JEM-2000EX透射电镜下观察。
1.2.3荧光染色细胞爬片吖啶橙染色:盖玻片置6孔板中,加肿瘤细胞悬液,待细胞完全贴壁后,每孔加3 mL RPMI-1640液,过夜,倒置显微镜观察细胞形态完全正常后,加入0.01OD重组BCG或野生BCG,培养环境同上。4%多聚甲醛常温固定20 min,(1)吖啶橙染色3~5 min,PBS漂洗;(2)1%盐酸泡5 s,PBS漂洗;(3)CaCl2脱色3~5 min;(4)荧光显微镜观察。
1.2.4 MTT法检测重组BCG对肿瘤细胞生长抑制率(1)对数生长期EJ膀胱肿瘤细胞1×105/mL密度接种于96孔板中,培养6 h完全贴壁后分别加入rBCG、BCG、BCG加干扰素的混合成分(外源性IFN-α-2b按照rBCG上清液中干扰素的相当量加入),浓度为0.01OD,设只加培养基的肿瘤细胞为空白对照组,于37℃,5%CO2中培养24、48和72 h。(2)每孔加入5 mg/mL MTT 20 μL,培养4 h,离心弃上清,加DMSO充分溶解。酶联免疫检测仪测定各孔570 nm光吸收值,取每组6的均值。(3)细胞生长抑制率(%)=(对照组MTT值-处理组MTT值)/对照组MTT值×100%。
1.2.5 ELISA检测rBCG对PBMC分泌Th1型细胞因子的作用从健康受试者新鲜血液中提取PBMC,rBCG、BCG和BCG+IFN-α-2b分别在24孔板中与PBMC共培养。最终菌浓度为1.4×106CFU/ mL,细胞浓度为1.0×105cells/mL。仅包含PBMC样品的作为空白对照。在CO2培养箱中培养,在12、24、48和72 h分别收集上清液并储存在-70℃。用ELISA方法检测细胞因子IFN-γ、TNF-α和IL-12。
1.2.6 LDH释放试验检测BCG激活的淋巴细胞对肿瘤细胞杀伤效应(1)分离淋巴细胞,常规培养2 h,调整浓度至4×105/mL;和重组BCG及野生型BCG共同培养(浓度同上),37℃、5%CO2、饱和湿度培养72 h。(2)乳酸脱氢酶释放实验的效应细胞为激活的实验组和对照组淋巴细胞,靶细胞为EJ膀胱癌细胞,效靶比例为50∶1。(3)取增殖淋巴细胞与EJ细胞各0.1 mL混匀,37℃、5%CO2孵育4 h;(4)上清37℃预温10 min,加新配的底物液,紫外分光仪在340 nm波长下读取30 s,1 min,2 min,3 min的A值。(5)杀伤活性(%)=实验组LDH-L-自然释放LDH-L/最大释放LDH-L-自然释放LDH-L×100%。
1.3统计学处理采用SPSS13.0统计软件,所有数据采用±s表示,组间比较采用one way-ANOVA法分析,以P<0.05表示差异有统计学意义,P<0.01表示差异有极显著意义。
2 结果
2.1光镜下重组BCG影响EJ细胞形态学变化空白对照组:光镜下,传代培养后,EJ细胞逐渐贴壁生长,12 h后细胞陆续有突起伸出,细胞核变大同时核浆比例变大,染色质不均匀,可见核分裂相。rBCG或BCG与之共培养组:细胞折光性逐渐降低,胞浆内颗粒状物质、胞突逐步消失而细胞逐渐变粗变短,核浆比例变小。48 h后细胞明显变小且变圆,胞突消失,部分细胞悬浮生长并聚集成团状,可见其周围有菌群包绕。72 h变化明显,胞浆可见大量颗粒状物质和空泡,细胞分布稀疏,部分细胞有溶解坏死表现(图1)。

图1 光镜下EJ细胞的形态Fig 1 Cellu lar m orphology under invert m icroscope
2.2透射电镜下肿瘤细胞形态变化正常EJ细胞呈圆形或不规则形,表面有大量的微绒毛,胞浆内有丰富线粒体,可见发达的粗面内质网,染色质分布均匀,细胞核大且有清晰的核仁,有的可见多个核仁(图2A)。BCG或rBCG作用后48 h可见细胞表面微绒毛减少(图2B),72 h可见细胞胞浆内线粒体肿胀,出现空泡样变性,细胞核染色质溶解,细胞质坏死,细胞表面微绒毛减少(图2C)。
2.3荧光染色的结果观察正常细胞体积较小,胞核呈黄绿色荧光,有核分裂相出现,胞质呈橘红色荧光,核浆比例大,细胞贴壁生长。rBCG或BCG作用后,24 h变化不明显,48 h后细胞增殖减慢,并聚集成团状,胞突逐渐消失而胞体逐渐变短变粗,细胞核逐渐缩小,核浆比例变小,可见细胞膜呈泡状突出。72 h后细胞逐渐分布稀疏,染色时极易脱片(图3)。凋亡细胞周围出现典型的花瓣样结构(图3D箭头所示)。
2.4 rBCG对肿瘤细胞增殖抑制实验结果表1示rBCG与BCG相比对膀胱肿瘤细胞有明显的抑瘤效果(P<0.05),与BCG加干扰素组相比,24和48 h二者无明显差异(P均>0.05)。可见生长抑制率随时间延长而增高,72 h点rBCG的生长抑制率显著高于其他各组(P均<0.05)。
2.5 ELISA检测rBCG对PBMC分泌Th1型细胞因子的作用与BCG组和BCG+IFN-α-2b组相比,rBCG诱导的PBMC产生的hIFN-γ水平显著增加(P均=0.00)。各组间12 h和24 h的IL-12水平无明显差异(P>0.05);2 d和3 d时,rBCG组显著高于其他2组(P均<0.05)。TNF-α在12 h的表达量各组均有显著增加,但无明显差异(P>0.05);随后3个时间点rBCG组TNF-α的水平明显高于其他组(P均<0.05)。见表2~4。
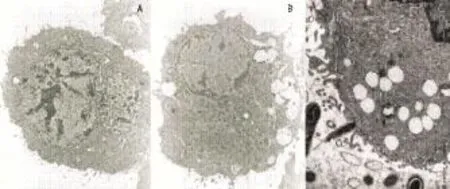
图2 透射电子显微镜下EJ细胞的形态Fig 2 Cellular morphology under transm ission electron m icroscope
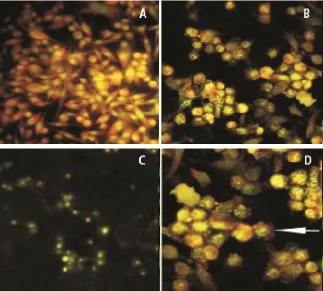
图3 经吖啶橙染色后荧光显微镜下EJ细胞的形态Fig 3 Cellu lar morphology under fluorescence m icroscope by acridine orange staining
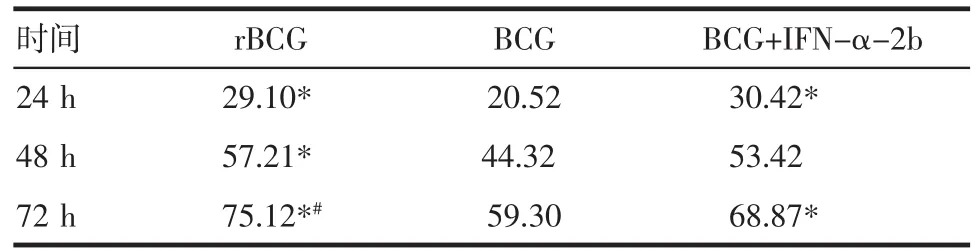
表1 膀胱肿瘤细胞抑制率(%)Tab 1 Inhibition rate of bladder cancer cell(%)
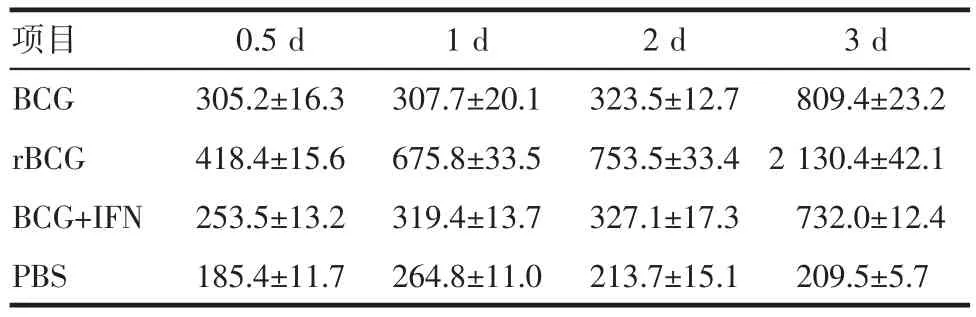
表2 各组诱导的PBMC产生的h IFN-γ的水平(pg/m L)Tab 2 The h IFN-γ secretion from induced PBMC of every group(pg/m L)
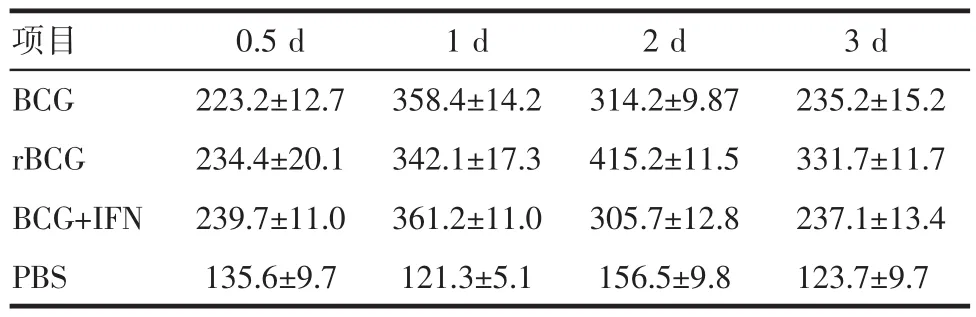
表3 各组诱导的PBMC产生的IL-12的水平(pg/m L)Tab 3 The IL-12 secretion from induced PBMC of every group(pg/m L)

表4 各组诱导的PBMC产生的TNF-α的水平(pg/m L)Tab 4 The TNF-α secretion from induced PBMC of every group(pg/m L)
2.6rBCG激活淋巴细胞对膀胱肿瘤细胞的作用rBCG和BCG激活的淋巴细胞杀伤活性见表5,rBCG激活的淋巴细胞的杀伤活性是单纯淋巴细胞的2.67~6.74倍,是BCG的1.64~2.45倍,是BCG+IFN的1.25~1.66倍。单纯未经诱导的淋巴细胞活性较低,对EJ细胞的杀伤活性明显低下(7.60%);淋巴细胞经过不同浓度BCG刺激培养后被激活,对EJ细胞的杀伤活性明显增强(12.38%~20.89%)(P<0.05);淋巴细胞经过外源性IFN-α+ BCG作用后,其杀伤活性作用(15.78%~34.72%)又较BCG明显增强(P<0.05);rBCG杀伤活性为实验组最高(20.31%~51.22%)(P<0.05)。各不同成分组都随着剂量从2.5~10 μL升高BAK杀伤活性也增高,20 μL均降低,10.0 μL组的BAK杀伤活性最高(P<0.05)。
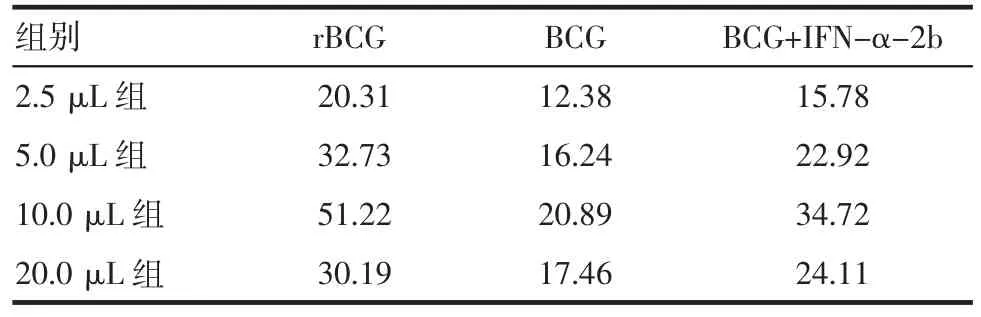
表5 不同浓度各种成分刺激淋巴细胞杀伤活性比较(%)Tab 5 Cell killing activity of lymphocyte stimulated by different concentration of each element(%)
3 讨论
BCG作为一种活的、减毒分支杆菌,具有很强的免疫佐剂功能,对膀胱肿瘤有较好的治疗效果[10]。BCG被认为通过调节免疫效应来发挥其抗肿瘤作用[11]。根据体外实验结果,rBCG或BCG单独作用于培养的肿瘤细胞,可以产生细胞毒作用,直接杀伤膀胱肿瘤细胞,与Rajala等[12]结论一致。研究表明,BCG具有直接的细胞毒性作用[13],可能与BCG影响溶酶体膜蛋白的表达参与凋亡过程有关[14]。有研究表明BCG能够通过影响与侵犯线粒体膜,进而影响细胞呼吸和能量代谢[15]破坏细胞内环境致细胞死亡。
此外,无论BCG还是rBCG对肿瘤细胞的杀伤都体现出时间依赖性,也就是说,随着时间的延长BCG对肿瘤细胞的杀伤效果逐渐加强。实验中对肿瘤细胞形态的观察说明BCG和rBCG直接接触均对肿瘤细胞有明显破坏作用。以往研究发现BCG可以附着于靶细胞,竞争宿主细胞营养从而抑制肿瘤细胞生长,BCG的细胞毒能够破坏肿瘤细胞内环境[16]。细胞膜的完整及正常的通透性在维持细胞正常生命活动中起重要作用,微绒毛是细胞膜的一部分,其作用是增加细胞膜表面积,增加细胞膜内外物质及信息的交换。本实验中,rBCG的细胞毒造成细胞膜微绒毛脱落减少、细胞膜表面出泡,影响了细胞正常的代谢,结果就是细胞死亡和细胞数量的减少。这同膀胱肿瘤细胞生长抑制率MTT测定结果一致,膀胱肿瘤细胞的生长随着时间的延长不同程度的被抑制。与BCG相比,rBCG对膀胱肿瘤细胞有更明显的抑瘤效果,与BCG加干扰素对肿瘤细胞抑制率一致,但随着时间的继续延长,rBCG的膀胱肿瘤细胞生长抑制率明显高于其他两组。在刺激PBMC分泌Th1型细胞因子方面rBCG远大于BCG和BCG加干扰素组。同时rBCG在激活淋巴细胞对膀胱肿瘤细胞的杀伤作用上也明显高于其他两组。研究提示多种细胞因子如IFN-γ、TNF-α、IL-12、IL-18等本身对癌细胞也起抗增殖作用[11],可经由多种信号途径诱发膀胱肿瘤细胞凋亡。故此提示,分泌人IFN-α-2b的rBCG可能有更强的抗肿瘤免疫作用。
上述一系列实验结果提示,该重组BCG对膀胱肿瘤细胞有明显的抗瘤效果,不但自身表现出抗瘤活性,还可以提高免疫细胞抗肿瘤免疫的能力。重组BCG的发展前景令人鼓舞,需要对其作用和机制等问题进行更深入的研究。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359
[2]韩苏军,张思维,陈万青,等.中国膀胱癌发病现状及流行趋势分析[J].癌症进展,2013,11(1):89
[3]Kamat A M,Porten S.Myths and mysteries surrounding bacillus Calmette-Guérintherapy for bladder cancer[J].EurUrol,2014,65(2):267
[4]Lamm D L.Bacille Calmette-Guérin immunotherapy for bladder Cancer[J].J Urol,1985,134(1):40
[5]Herr H W,Wartinger D D,Fair W R,et al.Bacillus Calmette-Guerin therapy for superficial bladder cancer:a 10-year followup[J]. J Urol,1992,147(4):1020
[6]Sylvester R J,van der Meijden A P,Lamm D L.Intravesical bacillus Calmette-Guerin reduces the risk of progression in patients with superficial bladder cancer:a meta-analysis of the published results of randomized clinical trials[J].J Urol,2002,168(5):1964
[7]von Rundstedt F C,Lerner S P.Bacille-Calmette-Guerin nonresponders:how to manage[J].Transl Androl Urol,2015,4(3):244
[8]Xiao Z,Hanel E,Mak A,et al.Antitumor efficacy of intravesical BCG,gemcitabine,interferon-α and interleukin-2 as mono-or Combination-Therapy for bladder cancer in an orthotopic tumor model[J].Clin Med Insights Oncol,2011,5(5):315
[9]孙二琳,刘春雨,韩瑞发,等.重组hIFN-α-2B-BCG的生物学特性的观察[J].中华微生物学和免疫学杂志,2010,30(1):46
[10]Herr H W,Morales A.History of bacillus Calmette-Guerin and bladder Cancer:an immunotherapy success story[J].J Urol,2008,179(1):53
[11]Thompson D B,Siref L E,Feloney M P,et al.Immunological basis in the pathogenesis and treatment of bladder cancer[J].Exp ert Rev Clin Immunol,2015,11(2):265
[12]Rajala P,Kaasinen E,Rintala E,et al.Cytostatic effect of different strains of Bacillus Calmette-Guérin on human bladder cancer cells in vitro alone and in combination with mitomycin C and interferonalpha[J].Urol Res,1992,20(3):215
[13]Garcia C,Jina H,Bergersen P,et al.Bladder contracture-A rare and serious side effect of intravesical bacillus Calmette-Guérin therapy[J].Urol Case Rep,2016,4:22
[14]Moriwaki Y,Begum N A,Kobayashi M,et al.Mycobacterium bovis Bacillus calmette-Guerin and its cell wall complex induce a novel lysosolipopo-lysaccharide and p53-inducible gene,LITAF(PIG7),and estrogen-inducible gene,EET-1[J].J Biol Chem,2001,276(25):23065
[15]Ryll R,Watanabe K,Fujiwara N,et al.Mycobacterial cord factor,but not sulfolipid,causes depletion of NKT cells and upregulation of CD1d1 on murine macrophages[J].Microbes Infect,2001,3(8):611
[16]董亚利,白景文,沈伟,等.BCG对体外培养人癌细胞直接作用的扫描电镜观察[J].天津医科大学学报,1995,1(2):23
(2016-03-08收稿)
Study on antitumor effect of recombinant h IFN-α-2b-BCG in vitro
WANG Li-ning,FAN Xiao-dong,SUN Er-lin,LI Na,LU Bing-xin,LEI Ming-de,DING Na,SUN Yan,HAN Rui-fa
(Tianjin Institute of Urology,Department of Urology,The Second Hospital,Tianjin Medical University,Tianjin 300211,China)
O bjective:To study antitumor effect and mechanism of action on recombinant IFN-α-2b-BCG(rBCG)in vitro.
M ethods:Effect of rBCG on bladder tumor cells was observed through transmission electro microscopy and microscope.Acridine orange staining was used to observe the tumor cellsmorphology by fluorescence microscope.Growth inhibition rate on tumor cell was detected by MTT assay.Effect of rBCG cultures on secretion of Th1-type cytokines was detected by ELISA assay.LDH release assay was applied to determine the lethal effect of active lymphocyte which was stimulated by BCG on tumor cells.Results:The rBCG group showed significant changes.MTT showed rBCG inhibited the proliferation of bladder cancer cell,and more active other groups.RBCG cultures affected the section of Th1 cytokines.And rBCG could enhanced the lethal effect of lymphocyte on tumor cells.Conclusion:The rBCG may have more immunomodulatory properties,anti-tumor effects and cytotoxicity in vitro.
recombinant BCG;IFN-α-2b;bladder tumor;immunotherapy
论著
国家自然科学基金资助项目(81402095);天津市科委抗癌重大科技专项基金资助项目(12zcdzsy16900);天津市卫计委科技基金资助项目(2014KZ104)
王丽宁(1989-),女,研究实习员,学士,研究方向;泌尿外科基础医学;通信作者:孙二琳,E-mail:irene-sunsun@163.com。
R737.14
A
1006-8147(2016)05-0377-04
