β片层阻断肽H102对双转基因AD模型小鼠脑内LPL和PPAR-γ表达的影响
2016-11-22李靖付雪斐孙凤仙袁小涌王超徐淑梅
李靖,付雪斐,孙凤仙,袁小涌,王超,徐淑梅
(天津医科大学生理学教研室,天津300070)
论著
β片层阻断肽H102对双转基因AD模型小鼠脑内LPL和PPAR-γ表达的影响
李靖,付雪斐,孙凤仙,袁小涌,王超,徐淑梅
(天津医科大学生理学教研室,天津300070)
目的:通过观察β片层阻断肽H102对PS1/APP双转基因阿尔茨海默病(AD)模型小鼠学习记忆能力以及脑中脂蛋白脂酶(LPL)及PPAR表达的影响,探究H102对AD治疗作用的可能机制。方法:将AD模型小鼠随机分为模型组和H102治疗组,并将同月龄同背景C57BL/6J小鼠设为正常对照组,H102治疗组小鼠鼻腔给予H102药液,5 μL/d;模型组及正常组小鼠鼻腔给予辅料溶液,5 μL/d。连续给药4周后进行Morris水迷宫测试,检测小鼠学习记忆能力,并应用实时定量荧光PCR(real-time PCR)技术、Western Blot技术以及免疫组化法,观察小鼠脑内LPL和PPAR-γ表达的改变。结果:Real-time PCR技术、Western Blot技术以及免疫组化法均显示,与模型组小鼠相比,H102治疗组小鼠脑内LPL和PPAR-γ的表达显著增加(P<0.05)。
结论:β片层阻断肽H102能够增加AD小鼠脑内LPL的表达,从而进一步促进Aβ的细胞内吞与降解,PPAR-γ可能参与其中。
β片层阻断肽;阿尔茨海默症;脂蛋白脂酶;PPAR-γ;PS1/APP双转基因小鼠
阿尔茨海默病(Alzheimer's disease,AD)是一种进行性中枢神经系统退行性疾病,其特征为记忆丧失和其他认知恶化等[1]。临床早期表现主要为患者记忆力的减退和生活自理能力的下降,最终导致发生进行的认知功能障碍和缺失、神经行为异常,出现精神状况及生活自理能力的完全丧失[2]。AD典型的病理改变是老年斑(senile plaque,SP)的形成以及神经元纤维缠结(neurofibrillary tangle,NFT)[3]。AD的病因及发病机制非常复杂,有多种假说被提出,但尚无肯定的假说来完整地解释AD的病因及其发病机制。SP沉积中的主要成分是β-淀粉样肽(β-amyloidpeptide,Aβ),并且越来越多的证据表明,Aβ是AD形成和发展的关键因素[4-5]。Aβ的神经毒性涉及复杂的分子机制,主要包括促进自由基的形成,破坏细胞内的Ca2+稳态,降低K+通道的功能以及增强致炎细胞因子引起炎症反应[6-13]。抑制Aβ的聚集或促进Aβ的清除也是治疗AD的一个重要手段。脂蛋白脂酶(LPL)主要表达在脂肪和肌肉,也高度表达在脑中,但其具体作用是未知的。然而,考虑到脂蛋白在大脑中的主要部分是高密度脂蛋白,它包含可忽略的或无三酰基甘油,而且大脑缺乏其重要辅助因子--apoCII,推测LPL在大脑中具有与催化三酰基甘油水解所不同的功能。在小鼠以及成人大脑的突触重塑提示LPL具有一个潜在的新功能,即LPL结合Aβ,并促进了细胞表面对Aβ的内吞和吸收[14]。H102是由10个氨基酸组成的β片层阻断肽,能够预防或逆转Aβ的错误折叠和聚集[6-7,13],能够减少AD模型小鼠脑内Aβ的含量。然而,H102对于AD脑内LPL基因的表达是否具有调控作用,是否通过LPL调节Aβ的内化,进而使Aβ含量减少、学习记忆能力提高尚不清楚。在本研究中我们对此进行了探讨。
1 材料和方法
1.1材料
1.1.1实验动物6月龄PS1/APP双转基因小鼠30只,同背景同月龄C57BL/6J小鼠15只,重25.5~30.5 g,购自中国医学科学院医学实验动物研究所(雌雄由该研究所随机提供),饲养于天津医科大学实验动物中心SPF级实验室。
1.1.2药品与试剂β片层阻断肽H102由上海吉尔生物公司合成。LPL抗体和PPAR-γ抗体购自美国ABCAM公司,即用型SABC免疫组化试剂盒和DAB显色试剂盒购自武汉博士德生物公司,Trans Start Top Green qPCR Super Mix试剂盒购自北京全式金生物技术有限公司。
1.2方法
1.2.1动物分组与给药PS1/APP双转基因AD小鼠随机分为2组:模型组和H102治疗组,同背景同月龄C57BL/6J小鼠设为正常对照组,每组15只。动物适应性喂养1周后,采用鼻腔给药方法,H102治疗组用自制给药器给予33 mg/mL药液5 μL/d;正常对照组和模型组鼻腔给予等体积辅料溶液(称取0.5 g壳聚糖及0.1 g BSA溶于100 mL双蒸水中,摇匀,即为辅料溶液),连续5周。之后进行Morris水迷宫测试[6],取脑,一侧脑组织放于-80℃冻存备用,另一侧脑组织固定后进行包埋切片。
1.2.2免疫组化组织石蜡切片常规脱蜡,蒸馏水冲洗;3%H2O2室温避光孵育10 min,蒸馏水浸泡,2 min×3次;加0.01 mol/L枸橼酸缓冲液中微波沸腾,沸腾后间隔10 min,再沸腾,取出冷却至室温,PBS浸泡,2 min×3次;滴加5%BSA封闭,室温避光孵育15 min,倾去,勿洗;滴加稀释好的一抗:LPL(1∶200),PPAR-γ(1∶200),4℃过夜,PBS冲洗,2 min×3次;滴加生物素标记的羊抗鼠通用二抗,室温孵育20 min,PBS冲洗,3 min×3次;滴加SABC液,避光室温孵育20 min,PBS冲洗,5 min×3次;DAB显色剂显色:EP管中加入1 mL双蒸水,A、B、C液各滴1滴,混匀,去离子水终止显色反应后充分冲洗;苏木素复染,双蒸水充分冲洗,盐酸酒精分化,温水反蓝,梯度酒精常规脱水,二甲苯透明,中性树胶封片,于显微镜下观察。阴性对照用0.01 mol/L PBS溶液代替一抗进行实验,其余步骤同上。
1.2.3 Western Blot根据组织质量加入1∶10(m:v)的蛋白裂解液匀浆,提取蛋白。BCA法测定各组织的蛋白浓度,并用裂解液将各组织的蛋白浓度调至等浓度,充分混匀后按4∶1加入5×上样缓冲液,混匀,煮沸5 min,即可直接上样。配胶,上样,电泳,转膜,封闭,孵育,曝光显色。LPL一抗浓度为1∶800;二抗浓度为1∶5 000。
1.2.4 Real-time PCR反应体系为20 μL,反应条件:预热变性,95℃,5 min;变性,95℃,30 s;退火,59℃,30 s;延伸,72℃,30 s;共进行40个循环的扩增,72℃延伸8 min。每批实验均做标准曲线,实验中同步进行内参基因β-actin的定量检测,以目的基因与内参基因相对浓度比作为目的基因的相对表达量。
2 结果
2.1 Morris 水迷宫结果显示,给予H102治疗组的小鼠逃避潜伏期比模型组要短的多,且H102组小鼠入水朝向角与模型组小鼠相比明显减小,而跨越隐性平台次数增多,证明β片层阻断肽H102可以明显改善PS1/APP双转基因AD小鼠的学习记忆能力。
2.2免疫组化染色
2.2.1 LPL免疫组化染色结果正常对照组海马及大脑皮层着色明显,LPL有明显表达;与正常对照组相比,模型组着色较浅,LPL表达降低,其差异有统计学意义(P<0.01);H102治疗组与模型组相比,着色较深,LPL表达增加,其差异有统计学意义(P<0.01)。H102治疗组与正常对照组相比,无显著性差异(P>0.05)。见图1及图2。

图1 H102对PS1/APP双转基因小鼠大脑皮层及海马LPL表达的影响(×400)Fig 1 The expression of LPL p rotein in m ouse brain detected byimmunohistochem istry(×400)
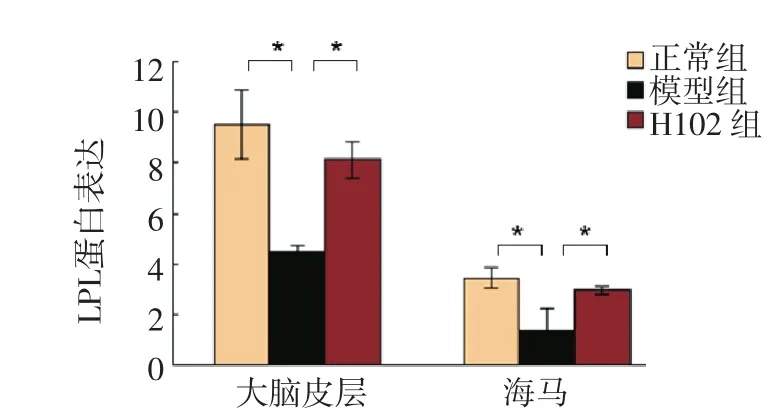
图2 各组小鼠大脑皮层及海马中LPL的表达Fig 2 The expression of LPL protein in mouse brain
2.2.2 PPAR-γ免疫组化染色结果正常对照组大脑皮层着色明显,PPAR-γ有明显表达;与正常对照组相比,模型组着色较浅,PPAR-γ表达降低,其差异有统计学意义(P<0.01);H102治疗组与模型组相比,着色较深,阳性细胞增多,PPAR-γ表达增加,其差异有统计学意义(P<0.01)。H102治疗组与正常对照组相比,无显著性差异(P>0.05)。见图3及图4。
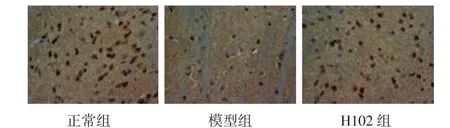
图3 H 102对PS1/APP双转基因小鼠大脑皮层PPAR-γ表达的影响(×400)Fig 3 The expression of PPAR-γ protein in m ouse brain detected by immunohistochem istry(×400)
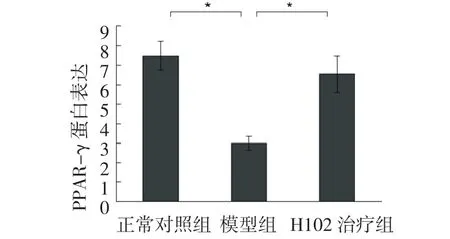
图4 各组小鼠大脑皮层PPAR-γ的表达Fig 4 The expression of PPAR-γ protein in mouse brain
2.3 Western blot实验结果取小鼠海马及皮层进行匀浆提取蛋白质。Westrn blot检测结果显示,LPL能够出现明显条带。与正常对照组相比较,模型组小鼠蛋白条带明显变窄,LPL蛋白的表达量显著减少,其差异有统计学意义(P<0.05);与模型组相比,H102治疗组的LPL蛋白表达量明显升高,蛋白条带明显变粗,其差异有统计学意义(P<0.05);H102治疗组与正常对照组相比较无显著性差异(P>0.05)。见图5。
2.4 Real time PCR实验结果
2.4.1 LPL与正常对照组比较,模型组LPL mRNA水平显著降低(P<0.01);H102治疗组LPL mRNA水平比模型组显著性升高(P<0.01)。见图6。

图5 各组小鼠脑内LPL蛋白的表达Fig 5 The expression of LPL protein in mouse brain by Western blot assay

图6 各组小鼠脑内LPL m RNA的相对表达Fig 6 The expression of LPL m RNA detected by real-tim e PCR
2.4.2 PPAR-γ与正常对照组比较,模型组小鼠脑内PPAR-γ mRNA水平显著降低(P<0.01);H102治疗组小鼠脑内PPAR-γ mRNA水平比模型组显著性升高(P<0.01);H102治疗组与正常对照组相比无显著性差异(P>0.05)。见图7。

图7 各组小鼠脑内PPAR-γ m RNA的相对表达Fig7 Theexpression ofPPAR-γmRNA detected by real-tim e PCR
3 讨论
Aβ是AD形成和发展的关键因素。如果能抑制病理变化的起始阶段或使已形成的斑块溶解,将有助于疾病的根治。以Aβ为靶点开发的药物可通过抑制Aβ聚集,促进Aβ降解和清除,从而达到减少Aβ毒性的作用[15]。前期研究发现,β片层阻断肽能够与Aβ直接作用,从而预防或逆转Aβ的错误折叠和聚集[16]。在本研究中,我们应用Morris水迷宫法测量PS1/APP双转基因AD小鼠空间学习和记忆的能力,结果表明,给予H102治疗组的逃避潜伏期比模型组短,证明β片层阻断肽H102可以明显改善PS1/APP双转基因AD小鼠的学习记忆能力。
在前期工作中我们应用基因芯片技术对PS1/ APP双转基因AD小鼠基因表达进行了检测,结果发现多个基因表达的差异,其中就包括LPL。有研究发现,LPL可以与Aβ结合,增加Aβ与细胞的亲和力,从而促进Aβ的细胞摄取以及进一步的降解。此外,LPL减少可能促进轴突病变[17-18]。LPL也可以是AD的保护因素,在脑内可能通过脂类的清除和回收,粘结功能和其它未识别的机制从而具有抗氧化应激的作用[19-20]。在本研究中,我们发现LPL在AD模型组小鼠的大脑中表达减少,影响了Aβ的内吞和降解效率,使得Aβ的聚集增加。而H102能够影响脑内LPL的表达,H102治疗组LPLmRNA水平和蛋白质水平均较模型组上调,这提示H102改善PS1/APP双转基因AD小鼠学习记忆能力的作用可能与通过增加LPL的表达,促进Aβ的摄取和降解,最终减少脑内Aβ的形成和沉积有关,也证明了LPL的确与AD的病理机制密切相关。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)是调节目标基因表达的核内受体转录因子超家族成员[21]。根据结构的不同,PPAR可分为α、β(或δ)和γ 3种类型,其中PPAR-γ主要表达于脂肪组织及免疫系统,其与胰岛素抵抗、机体免疫反应和脂肪细胞分化有不可分割的关联[22]。PPAR-γ通过与其相应的配体结合达到激活状态,激活后的PPAR-γ能够进一步与视黄醛X受体α(retinoid X receptor α,RXRα)相互作用而形成异二聚体,之后与特异性DNA序列相结合而活化靶基因,这个序列被称为PPAR特异性反应元件(peroxisome proliferator responsive element,PPRE)。含有PPRE结构的基因中就包括LPL[23]。PPAR-γ通过其调节相关基因表达的作用,在脂肪形成、糖脂代谢以及免疫系统中发挥着重要的作用,并且与多种疾病发生、发展相关,例如糖尿病、肥胖、高血压、癌症等[24-25]。此外,PPARγ还能影响NFκB、信号转录子、激活蛋白-1介导的信号通路,通过抑制这些信号通路途径的激活从而对靶基因启动子的激活和转录起到抑制作用[26-27]。因此,我们通过Real-time PCR技术发现脑内有PPAR-γ的存在,同时检测了给予H102后小鼠脑内PPAR-γ表达的变化,H102治疗组小鼠脑内PPAR-γ表达水平较模型组上调,免疫组化染色结果与之相符,均与LPL的表达变化趋势相同。这些结果表明,β片层阻断肽H102在脑内可能通过影响PPAR-γ的活性从而调节LPL基因的表达,进一步促进Aβ的内吞和降解。
总之,在此项研究中,我们发现β片层阻断肽H102能够改善PS1/APP双转基因AD小鼠的学习记忆能力,其可能通过PPAR-γ直接调节LPL在脑内的表达来促进Aβ的细胞内吞和进一步的降解,从而达到治疗效果。我们的发现说明H102不仅仅能够直接作用于Aβ,使Aβ的聚集减少,而且能够通过影响PPARγ-LPL的表达来间接促进Aβ的降解,其作用途径不是单一的,而是多靶点、多方式的。本研究也为AD的发病机制探索以及β片层阻断肽H102对AD治疗作用机制的研究提供了依据。
[1]Zhong Z G,Lü L,Chai L M,et al.Effect of panax notoginseng saponins on APP gene transcription in the brain tissue of SAMP8[J]. Zhong Yao Cai,2011,34(1):77
[2]孙欣,杨宇.β淀粉样蛋白在阿尔茨海默病中所致的细胞内毒性作用[J].中风与神经疾病杂志,2011,28(3):277
[3]Hardy J,Selkoe D J.The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353
[4]Robinson S R,Bishop G M.Abeta as a bioflocculant:implications for the amyloid hypothesisofAlzheimer'sdisease[J].NeurobiolAging,2002,23(6):1051
[5]Schaeffer E L,Figueiro M,Gattaz W F.Insights into Alzheimer disease pathogenesis from studies in transgenic animal models[J]. Clinics(Sao Paulo),2011,66(Suppl 1):45
[6]宋明,李梅,林来祥,等.H102对APP转基因小鼠脑内IDE和NEP表达的影响[J].天津医科大学学报,2010,16(4):566
[7]李梅,林来祥,徐淑梅.H102对APP转基因小鼠胆碱能系统及自由基的影响[J].中国新药与临床杂志,2009,28(2):106
[8]孙凤仙,王曼,徐艳玲,等.β片层阻断肽联合人脐带间充质干细胞对APP转基因鼠的治疗作用[J].中国应用生理学杂志,2013,29(3):239,292
[9]王曼,徐淑梅,马志红.H102对APP转基因小鼠突触相关蛋白表达的影响[J].天津医药,2010,38:405
[10]Larson M E,Lesné S E.Soluble Aβ oligomer production and toxicity[J].J Neurochem,2012,120(Suppl 1):125
[11]Tanzi R E,Moir R D,Wagner S L.Clearance of Alzheimer's abeta peptide:the many roads to perdition[J].Neuron,2004,43(5):605
[12]单媛莉,常富业.阿尔茨海默病药物治疗的概述与展望[J].现代中西医结合杂志,2013,22(6):670
[13]赵娟,徐淑梅.β片层阻断肽对淀粉样β蛋白聚集和毒性的抑制作用[J].中国新药与临床杂志,2008,27(9):675
[14]Nishitsuji K,Hosono T,Uchimura K,et al.Lipoprotein lipase is a novel amyloid beta(Abeta)-binding protein that promotes glycosaminoglycan-dependent cellular uptake of Abeta in astrocytes[J].J Biol Chem,2011,286(8):6393
[15]Li C Y,Zhao R,Gao K,et al.Astrocytes:implications for neuroinflammatory pathogenesis of Alzheimer's disease[J].Curr Alzheimer Res,2011,8(1):67
[16]Xiang L L,Yu B X,Zhen T Y,et al.Feasibility of β-sheet breaker peptide-H102 treatment for Alzheimer's disease based on βamyloid hypothesis[J].PLoS One,2014,9(11):e112052
[17]Vitiello G,Grimaldi M,Ramunno A,et al.Interaction of a betasheet breaker peptide with lipid membranes[J].J Pept Sci,2010,16(2):115
[18]Wang H,Astarita G,Taussig M D,et al.Deficiency of lipoprotein lipase in neurons modifies the regulation of energy balance and leads to obesity[J].Cell Metab,2011,13(1):105
[19]Baum L,Wiebusch H,Pang C P.Roles for lipoprotein lipase in Alzheimer'sdisease:an association study[J].Microsc Res Tech,2000,50(4):291
[20]Blain J F,Aumont N,Théroux L,et al.A polymorphism in lipoprotein lipase affects the severity of Alzheimer's disease pathophysiology[J].Eur J Neurosci,2006,24(5):1245
[21]Schild R L,Sonnenberg-Hirche C M,Schaiff W T,et al.The kinase p38 regulates peroxisome proliferator activated receptor-gamma in human trophoblasts[J].Placenta,2005,27(2/3):191
[22]Lapsys N M,Kriketos A D,Lim-Fraser M,et al.Expression of genes involved in lipid metabolism correlate with peroxisome proliferatoractivated receptor gamma expression in human skeletal muscle[J].J Clin Endocrinol Metab,2000,85(11):4293
[23]Auwerx J,Schoonjans K,Fruchart J C,et al.Transcriptional control of triglyceride metabolism:fibrates and fatty acids change the expression of the LPL and apo C-III genes by activating the nuclear receptor PPAR[J].Atherosclerosis,1996,124(Suppl):S29
[24]Coon K D,Myers A J,Craig D W,et al.A high-density wholegenome association study reveals that APOE is the major susceptibility gene for sporadic late-onset Alzheimer's disease[J].J Clin Psychiatry,2007,68(4):613
[25]Ma J J,Chai J,Shang Y Y,et al.Swine PPAR-γ2 expression upregulated in skeletal muscle of transgenic mice via the swine Myozenin-1 gene promoter[J].Transgenic Res,2015,24(3):409
[26]Shibata N,Motoi Y,Tomiyama H,et al.Lack of genetic associations of PPAR-γ and PGC-1α with Alzheimer's disease and Parkinson's disease with dementia[J].Dement Geriatr Cogn Dis Extra,2013,3(1):161
[27]Wang R S,Li J J,Diao S Y,et al.Metabolic stress modulates Alzheimer's β-secretase gene transcription via SIRT1-PPARγ-PGC-1 in neurons[J].Cell Metab,2013,17(5):685
(2016-03-03收稿)
Effects of β-sheet breaker peptide H 102 on LPL and PPAR-γ protein in double transgenic AD m ice
LI Jing,FU Xue-fei,SUN Feng-xian,YUAN Xiao-yong,WANG Chao,XU Shu-mei
(Department of Physiology,Tianjin Medical University,Tianjin 300070,China)
Objective:To observe the effects of H102 on the learning ability and memory and the expression of LPL and PPAR-γ in PS1/ APP transgenic AD mice.M ethods:PS1/APP transgenic AD mice were random ly divided into two groups:model group and H102 treatment group,while C57BL/6J mice were normal group.The treatment group
33 mg/mL liquid for 5 μL/d,while the normal group and model group were given with an equal volume of materials solution for 4 weeks.After that,the spatial learning ability and memory was tested by Morris Water Maze.Immunohistochemical test,Western blot and quantitative real-time PCR were used to test the expression of LPL.The quantitative real-time PCR and immunohistochemical test were also used to examine the expression of PPAR-γ.Results:Immunohistochemical test,Western blot and quantitative real-time PCR indicated the expression of LPL and PPAR-γ in the model group were decreased significantly than the H102 group(P<0.05).Conclusion:β-sheet breaker peptide-H102 may work via regulating the expression of LPL so as to promote the degradation of Aβ,and PPAR-γ may be involved in the procedure.Those findings also prove that LPL in the brain may be highly correlated with the pathogenesis of AD.
β-sheet breaker peptide-H102;Alzheimer's disease;LPL;PPAR-γ;PS1/APP transgene mice
R338
A
1006-8147(2016)05-0396-05
李靖(1990-),女,硕士在读,研究方向:生理学;通信作者:徐淑梅:E-mail: xushm@tijmu.edu.cn。
