双歧杆菌对大鼠抑郁样行为及单胺神经递质的影响
2016-11-22罗国帅杨建立王承展司纪剑王丽莉
罗国帅,杨建立,王承展,司纪剑,王丽莉
(1.天津医科大学研究生院,天津300070;2.天津市安定医院精八科,天津300074)
论著
双歧杆菌对大鼠抑郁样行为及单胺神经递质的影响
罗国帅1,杨建立2,王承展1,司纪剑2,王丽莉2
(1.天津医科大学研究生院,天津300070;2.天津市安定医院精八科,天津300074)
目的:观察双歧杆菌对抑郁模型大鼠行为学及前额叶皮质(PFC)、纹状体(ST)、杏仁核(AM)、海马(HIP)等脑区单胺递质及代谢产物的影响,探讨双歧杆菌潜在的抗抑郁作用及机制。方法:选取成年雄性SD大鼠40只,采用随机数字表法随机分为模型组、氟西汀组、双歧杆菌组、对照组,每组10只,对照组标准环境每笼5只群养6周,另3组釆用连续6周慢性轻度不可预见性应激(CUS)的方法建立慢性抑郁大鼠模型,并于第3周末至第6周末对双歧杆菌组和氟西汀组分别给予双歧杆菌和氟西汀灌胃,模型组和对照组给予同体积溶剂灌胃;CUS前、后及干预后以糖水消耗实验、体质量测量、旷场实验对大鼠行为进行评估,以库仑阵列电化学高效液相色谱法测定各组抑郁模型大鼠前额叶(PFC)、纹状体(ST)、杏仁核(AM)和海马(HIP)区单胺递质(NE、5-HT、DA)的浓度及其代谢产物(DOPAC、HVA、5-HIAA)的浓度。结果:(1)CUS后CUS组、双歧杆菌组、氟西汀组大鼠较对照组大鼠糖水消耗少、体质量增加少、水平运动距离小、直立次数少、粪便粒数多(均P<0.05)。(2)干预后对照组、双歧杆菌组、氟西汀组大鼠较CUS组大鼠糖水消耗多、体质量增加多、水平运动距离大、直立次数多、粪便粒数少(均P<0.05)。(3)与对照组相比,模型组大鼠PFC、ST、AM、HIP等脑区单胺神经递质NE、DA和5-HT浓度明显降低(均P<0.05);与模型组相比,除外AM区5-HT浓度下降(P<0.05),双歧杆菌组、氟西汀组PFC、ST、AM、HIP等脑区单胺神经递质DA、NE、5-HT浓度及部分代谢产物的浓度显著升高(均P<0.05)。结论:双歧杆菌和氟西汀均可以有效改善抑郁模型大鼠的抑郁行为,并在总体上提高PFC、HIP、AM、ST等脑区单胺神经递质NE、5-HT、DA的浓度,说明双歧杆菌抗抑郁作用和可能机制与氟西汀类似。
抑郁症;双歧杆菌;大鼠;氟西汀;慢性不可预见性刺激
抑郁症是一种常见的精神科疾病,它是由各种原因引起的以抑郁情绪为主要症状的一组心境障碍或情感性疾病,临床上主要表现为情绪低落、思维迟缓、兴趣丧失、意志活动减退和躯体症状等[1]。抑郁症严重危害人类心身健康,已经成为一个全球性公共卫生问题。肠道系统因其独特的作用机制,被称为人类的“第二大脑”。2007年底美国国立卫生研究院(NIH)宣布将投入1.15亿美元正式启动“人类微生物组计划”(Human Microbiome Project,HMP)。近年来随着对肠道微生物生态学研究的深入,许多研究发现肠道微生物菌群结构与多种慢性病密切相关,如肥胖、心血管疾病、皮肤病、阴道感染、炎症性肠病(IBD)、结直肠肿瘤以及精神疾病[2]等。有研究显示,抑郁症的发生与胃肠炎症、自身免疫疾病、心血管疾病、神经变性疾病、2型糖尿病以及癌症等相关,其中与慢性胃肠道炎症显著关联[3]。另一些研究表明,肠道局部炎症通过细胞因子、神经肽和类花生酸类物质的释放,亦可影响大脑及其他器官的功能,从而出现抑郁症状[4]。这种作用可能是一个双向机制,提示抑郁症的发生、发展,可能与肠道微生物的改变有着密切的联系,抑郁症的发生原因可能是“肠-脑轴”的功能障碍。然而国内外有关抑郁症患者肠道微生物的研究并不多。基于以上,我们通过肠道益生菌双歧杆菌对抑郁模型大鼠进行灌胃干预后行为学、脑组织中5-羟色胺(5-HT)、去甲肾上腺素(NE)和多巴胺(DA)及其代谢产物等浓度的改变,探讨双歧杆菌对抑郁症的作用,以期找到抑郁症治疗的新方案。
1 材料和方法
1.1材料本研究起止时间为2015年7月1日-10月25日,并经天津医科大学伦理委员会、天津市安定医院伦理委员会批准。
1.1.1实验动物清洁级成年雄性SD大鼠40只(许可证号:SYXK(京)2011-0039,北京维通利华实验动物技术有限公司),体质量为180~200 g,喂养于湿度40%~50%,温度(20±2)℃的独立通气笼(individual ventilated cages,IVC)系统,昼夜比为12 h/12 h(光照时间为7:00~19:00),食物和水充分供给,自由摄取。大鼠在动物房适应饲养3 d后正式开始实验。本研究所有对动物的实验操作,均遵守中国国家科学技术委员会颁布的中华人民共和国《实验动物管理条例》。
1.1.2药品及试剂双歧杆菌:来自天津中医药大学现代中药制剂中心。氟西汀(fluoxetine hydrochloride,FLX):购自礼来苏州制药有限公司,剂型20 mg/R。0.9%注射用生理盐水(0.9%saline,N.S):购自北京化工厂。去甲肾上腺素(NE)、多巴胺(DA)、5-羟色胺(5-HT)、5-羟基吲哚乙酸(5-HIAA)、高香草酸(HVA)、3,4-二羟基苯乙酸(DOPAC):购自Sigma公司。其余试剂均为实验室自制。
1.1.3主要设备与仪器Med旷场测验箱:购自美国MED Associates公司;电子秒表(型号HS-80TW-1DF):购自日本CASIO公司;-80℃低温冰箱(MDF-C8V(N)):购自日本SANYO公司;冷冻高速离心机(Himac CR 22):购自日本HITACHI公司;台式高速离心机(Eppendorf):购自日本HITACHI公司;组织匀浆器(ModelPR O 2000):购自美国Pro Scientific公司;振荡仪(Vortex-Genie 2):购自美国Scientific Industries公司;ESAModel5600A-HPLC系统:购自美国惠泽(ESA)公司;AG285电子分析天平等。
1.2方法
1.2.1动物分组40只SD大鼠适应性喂养3 d,按照随机数字表法分为对照组(Cotrol)、模型组(CUS)、双歧杆菌组(bifidobacterium,Bif)、氟西汀组(FLX),每组10只。对照组饲养6周,模型组、双歧杆菌组及氟西汀组单笼孤养并接受6周CUS,于第3周末至第6周末分别给予氟西汀组、双歧杆菌组以氟西汀、双歧杆菌灌胃。
1.2.2 CUS参考Liu等[5]的抑郁症造模方法:随机给予7种应激因子,每天1种,相同刺激不可连续出现,使大鼠不能预料刺激的发生,以避免产生适应性反应。应激方法包括:热应激(45℃,5 min/次,每天1次);潮湿垫料24 h;明暗颠倒24 h;夹尾巴(每次1min,尾部近体端1/3处,每天1次);禁食24 h;禁水24 h;电击足底(电压60 V,每次电击10次,每次间隔5 s,每只大鼠每天10次)。
1.2.3干预方法(1)双歧杆菌给药剂量:将含有1×1010个活菌细胞的双歧杆菌粉剂溶于50 mL生理盐水中,每天早上9:00-10:00灌胃;(2)氟西汀给药剂量:每天10 mg/kg氟西汀对应激所致的抑郁模型大鼠神经递质改变有较好的效果[6],因此氟西汀组均以该剂量溶于50 mL生理盐水中,每天早上9:00-10:00灌胃;(3)对照组及模型组均给予相同体积(50mL)的生理盐水,每天早上9:00-10:00灌胃。
1.2.4行为评估采用体质量测量、糖水消耗实验和旷场实验分别于CUS前后、干预后对大鼠行为进行评估。(1)体质量测量[7]:记录CUS前体质量,CUS后和干预后分别以本次体质量减上一次体质量,记录为体质量增加量;(2)糖水消耗实验[8]:禁水24 h后将所有大鼠均置于单笼内,给与1%浓度蔗糖水200 mL,1 h后取出水瓶并测量剩余糖水体积,糖水消耗量=消耗糖水体积/大鼠体质量×100 g;(3)旷场试验[9]:旷场设置于暗室,由不透明钢板制成,大小100 cm×100 cm×40 cm(长×宽×高),实验时将大鼠置于旷场的中心,由摄像机拍摄,Smart virsion2.5软件记录并分析大鼠5 min内的行为并记录大鼠运动的总路程,人工同步记录大鼠直立次数、粪便数。实验之前预跑30 s,每次实验后打扫旷场,清除粪便,并用医用酒精擦拭以消除大鼠遗留气味。
1.2.5大鼠处死及样本采集(1)大鼠最后一次行为学测试后各组大鼠断头取脑,置于预冷的PBS冲液中浸泡5 min,随即迅速于冰面上分离出前额叶(PFC)、纹状体(ST)、杏仁核(AM)和海马(HIP)组织,并根据实验要求分装2份于冻存管中,置于液氮中保存待测;(2)库伦列阵高效液相色谱法测定各组抑郁模型大鼠各脑区单胺递质(NE、5-HT、DA)的浓度及其代谢产物(DOPAC、HVA、5-HIAA)的浓度。
1.3统计学处理数据录入后使用excel 2010进行整理,采用SPSS16.0软件统计分析,以均值±标准差表示,实验数据均采用单因素方差分析(ANOVA),若存在差异,则进一步进行LSD法两两比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 CUS前大鼠行为学评估各组大鼠在糖水消耗量、体质量、水平运动距离、直立次数以及粪便粒数之间,差异均无统计学意义,各组大鼠抑郁样行为基本一致,结果见表1。
2.2 CUS后大鼠行为学评估第21天后,CUS组、双歧杆菌组、氟西汀组组间比较显示,大鼠糖水消耗量、体质量增加、水平运动距离、直立次数、粪便粒数的差异均无统计学意义(P>0.05),3组大鼠抑郁样行为基本一致;而与对照组比较大鼠糖水消耗量少、体质量增加少、水平运动距离短、直立次数多、粪便粒数多,差异均具有统计学意义(P<0.05),表示CUS组、双歧杆菌组、氟西汀组大鼠抑郁样行为较对照组明显,造模成功,结果见表2。
表1 CUS前各组大鼠行为学测试(±s±s)Tab 1 Behavioral assessment of rats before CUS(±s±s)
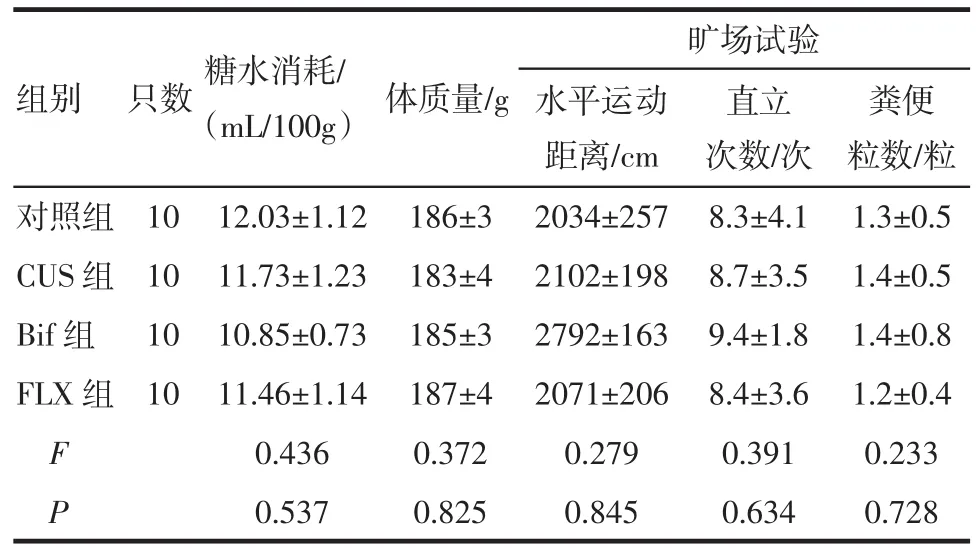
表1 CUS前各组大鼠行为学测试(±s±s)Tab 1 Behavioral assessment of rats before CUS(±s±s)
组别只数糖水消耗/(mL/100g)体质量/g 粪便粒数/粒对照组10 12.03±1.12 186±3 2034±257 8.3±4.1 1.3±0.5 CUS组10 11.73±1.23 183±4 2102±198 8.7±3.5 1.4±0.5 Bif组10 10.85±0.73 185±3 2792±163 9.4±1.8 1.4±0.8 FLX组10 11.46±1.14 187±4 2071±206 8.4±3.6 1.2±0.4 F 0.436 0.372 0.279 0.391 0.233 P 0.537 0.825 0.845 0.634 0.728旷场试验水平运动距离/cm直立次数/次
表2 CUS后各组大鼠行为学测试(±s±s)Tab 2 Behavioral assessm ent of rats after CUS(±s±s)
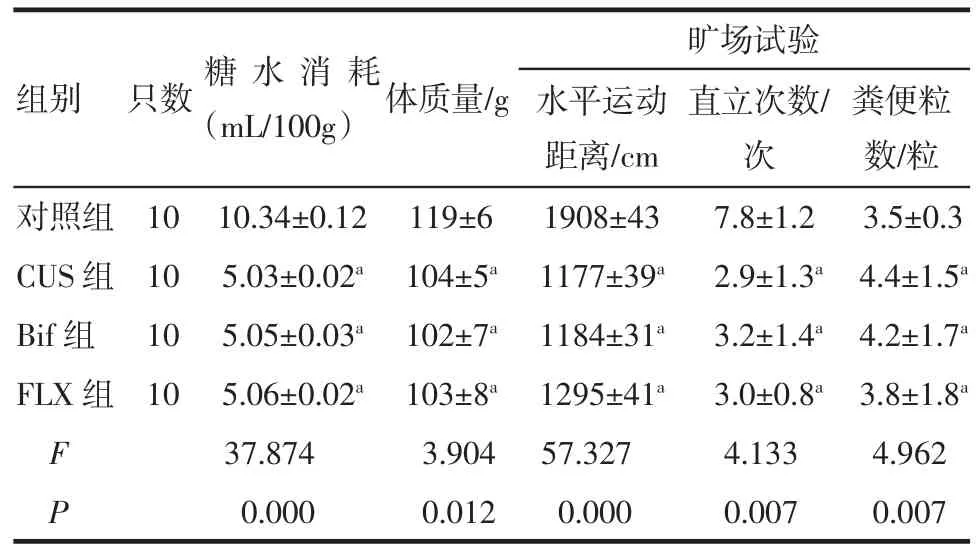
表2 CUS后各组大鼠行为学测试(±s±s)Tab 2 Behavioral assessm ent of rats after CUS(±s±s)
与对照组相比较,aP<0.05
组别只数糖水消耗(mL/100g)体质量/g 粪便粒数/粒对照组10 10.34±0.12 119±6 1908±43 7.8±1.2 3.5±0.3 CUS组10 5.03±0.02a104±5a1177±39a2.9±1.3a4.4±1.5aBif组10 5.05±0.03a102±7a1184±31a3.2±1.4a4.2±1.7aFLX组10 5.06±0.02a103±8a1295±41a3.0±0.8a3.8±1.8aF 37.874 3.904 57.327 4.133 4.962 P 0.000 0.012 0.000 0.007 0.007旷场试验水平运动距离/cm直立次数/次
2.3干预后大鼠行为评估与CUS组相比,对照组、双歧杆菌组、氟西汀组的糖水消耗量多、体质量增加多、水平运动距离大、直立次数多、粪便粒数少(均P<0.05)。而双歧杆菌组、氟西汀组较对照组的糖水消耗量少、体质量增加少、水平运动距离小(均P<0.05),双歧杆菌组与氟西汀组相比糖水消耗量、体质量增加量、水平运动距离、直立次数、粪便粒数等差异不明显(均P>0.05),提示CUS组大鼠抑郁样行为较另外3组明显,而双歧杆菌组、氟西汀组抑郁样行为基本一致但较对照组明显。结果见于表3。
表3 干预后各组大鼠行为评估结果(±s±s)Tab 3 Behavioral assessm ent of rats after interv-ention(±s±s)
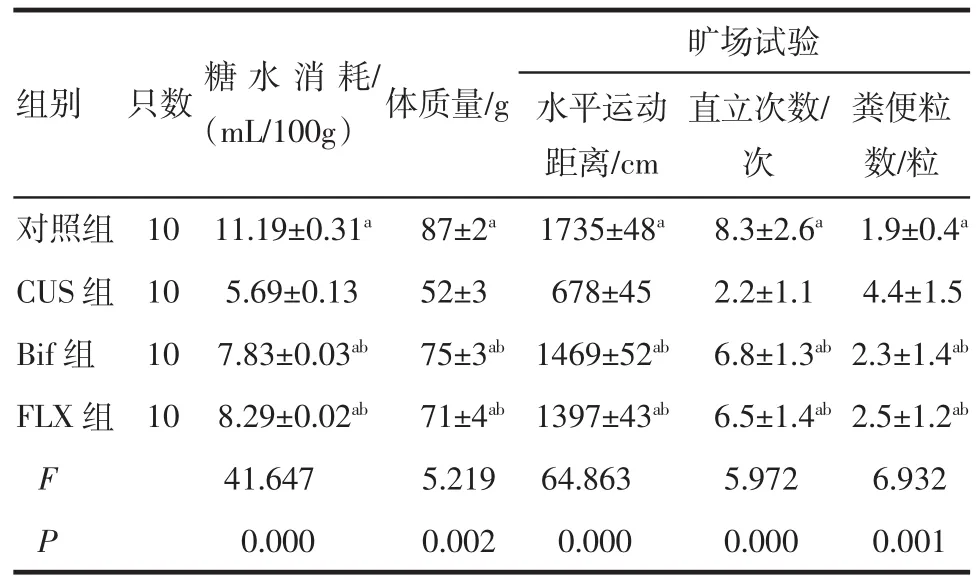
表3 干预后各组大鼠行为评估结果(±s±s)Tab 3 Behavioral assessm ent of rats after interv-ention(±s±s)
与CUS组相比,aP<0.05;与对照组相比,bP<0.05
组别只数糖水消耗/(mL/100g)体质量/g 粪便粒数/粒对照组10 11.19±0.31a87±2a1735±48a8.3±2.6a1.9±0.4aCUS组10 5.69±0.13 52±3 678±45 2.2±1.1 4.4±1.5 Bif组10 7.83±0.03ab75±3ab1469±52ab6.8±1.3ab2.3±1.4abFLX组10 8.29±0.02ab71±4ab1397±43ab6.5±1.4ab2.5±1.2abF 41.647 5.219 64.863 5.972 6.932 P 0.000 0.002 0.000 0.000 0.001旷场试验水平运动距离/cm直立次数/次
2.4干预后大鼠各脑区单胺类神经递质及其代谢产物结果分析
2.4.1各组大鼠单胺神经递质及其代谢产物浓度(DA、NE、5-HT、5-HIAA、DOPAC、HVA)总体上差异显著(均P<0.05)。与对照组相比,CUS组大鼠PFC区DA、NE、5-HT、5-HIAA、DOPAC、HVA浓度均减少,差异具有统计学意义(均P<0.05);杏仁核区DA、NE、5-HIAA、DOPAC浓度均减少,5-HT浓度增加,差异具有统计学意义(均P<0.05);海马区DA、NE、5-HT浓度减少,差异显著(均P<0.05);纹状体区DA、NE、5-HT、HVA、5-HIAA浓度减少,差异显著(均P<0.05)。
2.4.2与CUS组相比,双歧杆菌组、氟西汀组大鼠PFC区单胺神经递质DA、NE、5-HT浓度增加,5-HIAA浓度减少,差异均具有统计学意义(均P<0.05);杏仁核区DA、NE浓度增加,5-HT、DOPAC浓度减少,差异均具有统计学意义(均P<0.05);海马区DA、NE、5-HT浓度增加,差异均具有统计学意义(均P<0.05);纹状体区DA、NE、5-HT、HVA、5-HIAA浓度增加,差异均具有统计学意义(均P<0.05)。
2.4.3与双歧杆菌组相比,氟西汀组大鼠在PFC区、杏仁核区、海马区、纹状体区,DA、NE、5-HT、5-HIAA、DOPAC、HVA浓度增高,但差异不明显(均P>0.05)。结果见表4、5。
表4 各组大鼠各脑区单胺神经递质浓度(±s±s)Tab 4 Monoam ine neurotransm itter of brain region in rats(±s±s)
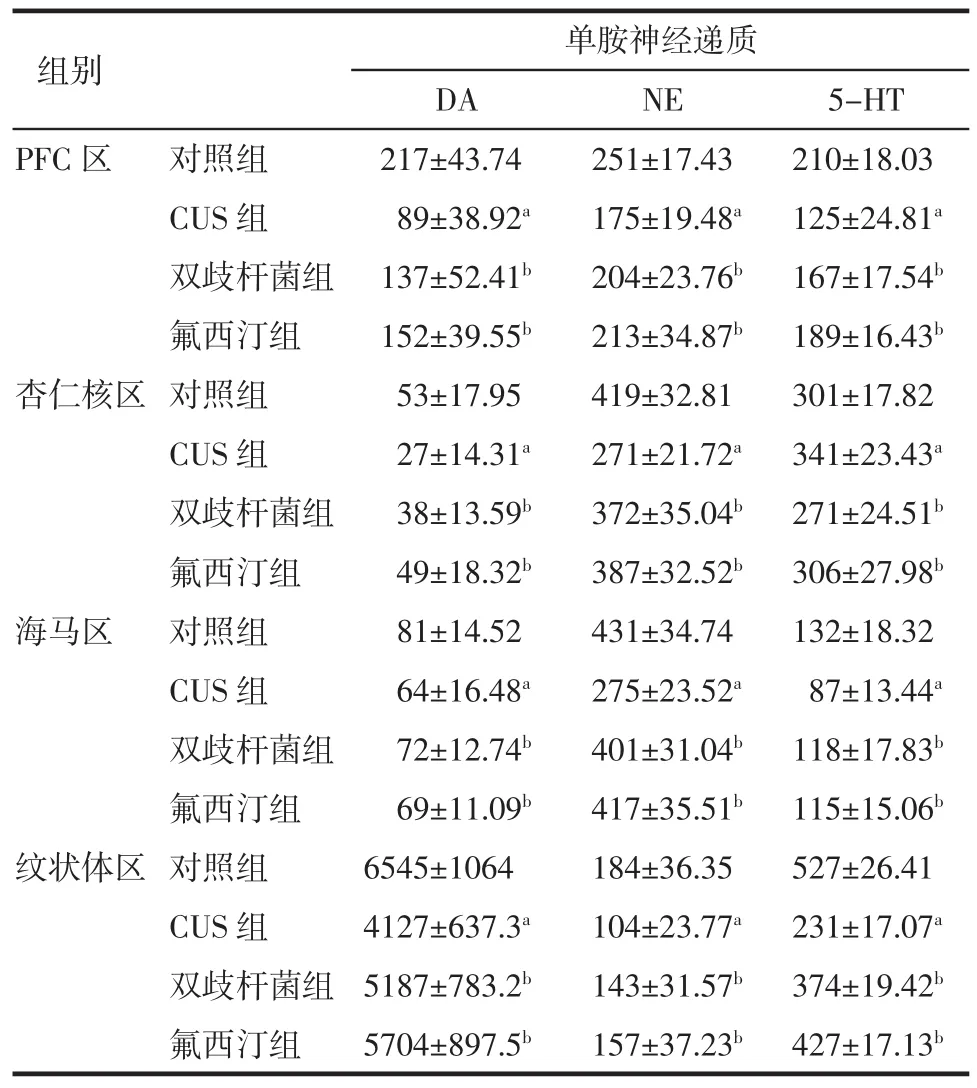
表4 各组大鼠各脑区单胺神经递质浓度(±s±s)Tab 4 Monoam ine neurotransm itter of brain region in rats(±s±s)
与对照组相比,aP<0.05;与CUS组相比,bP<0.05
组别单胺神经递质DA NE 5-HT PFC区对照组217±43.74 251±17.43 210±18.03 CUS组89±38.92a175±19.48a125±24.81a双歧杆菌组137±52.41b204±23.76b167±17.54b氟西汀组152±39.55b213±34.87b189±16.43b杏仁核区对照组53±17.95 419±32.81 301±17.82 CUS组27±14.31a271±21.72a341±23.43a双歧杆菌组38±13.59b372±35.04b271±24.51b氟西汀组49±18.32b387±32.52b306±27.98b海马区对照组81±14.52 431±34.74 132±18.32 CUS组64±16.48a275±23.52a87±13.44a双歧杆菌组72±12.74b401±31.04b118±17.83b氟西汀组69±11.09b417±35.51b115±15.06b纹状体区对照组6545±1064 184±36.35 527±26.41 CUS组4127±637.3a104±23.77a231±17.07a双歧杆菌组5187±783.2b143±31.57b374±19.42b氟西汀组5704±897.5b157±37.23b427±17.13b
表5 各组大鼠各脑区神经递质代谢产物浓度(±s±s)Tab 5 Metabolites of monoam ine neurotransm itter of brain region in rats(±s±s)
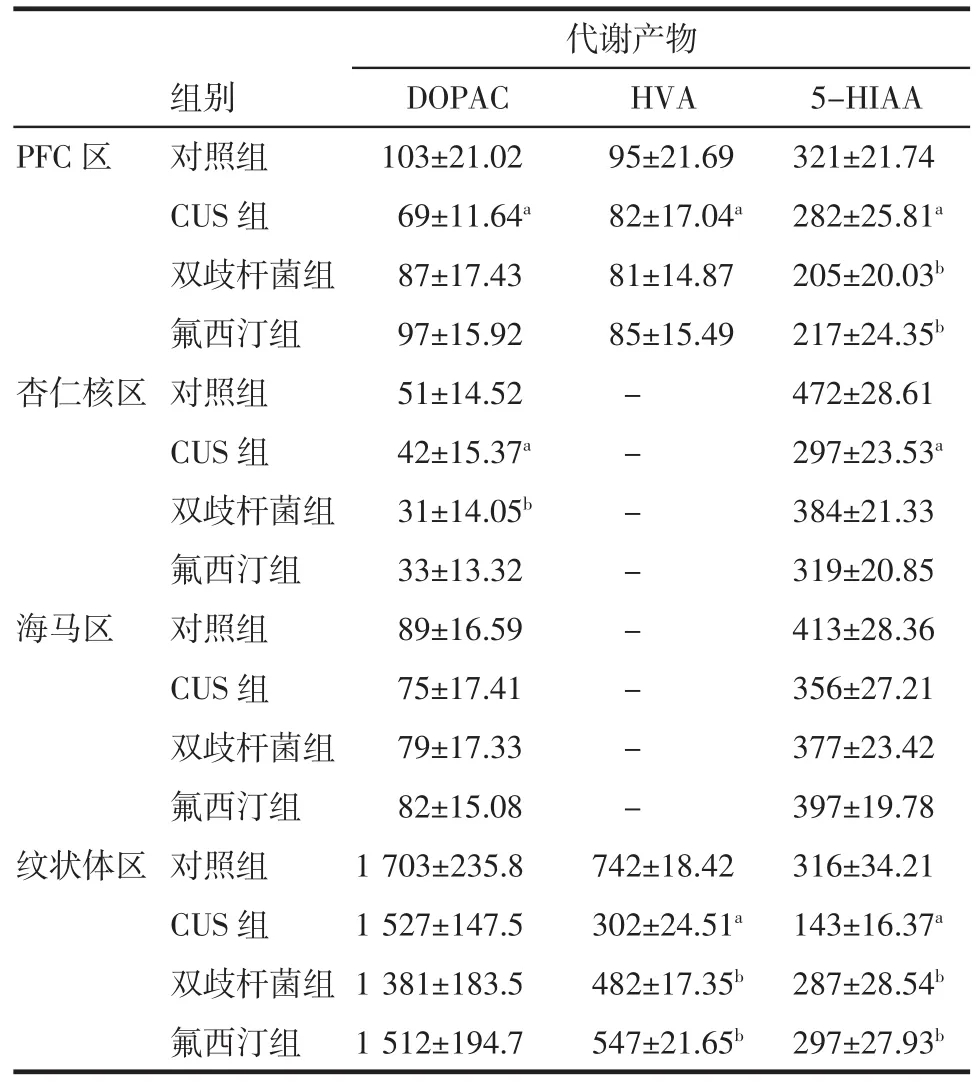
表5 各组大鼠各脑区神经递质代谢产物浓度(±s±s)Tab 5 Metabolites of monoam ine neurotransm itter of brain region in rats(±s±s)
与对照组相比,aP<0.05;与CUS组相比,bP<0.05
代谢产物组别DOPAC HVA 5-HIAA PFC区对照组103±21.02 95±21.69 321±21.74 CUS组69±11.64a82±17.04a282±25.81a双歧杆菌组87±17.43 81±14.87 205±20.03b氟西汀组97±15.92 85±15.49 217±24.35b杏仁核区对照组51±14.52-472±28.61 CUS组42±15.37a-297±23.53a双歧杆菌组31±14.05b-384±21.33氟西汀组33±13.32-319±20.85海马区对照组89±16.59-413±28.36 CUS组75±17.41-356±27.21双歧杆菌组79±17.33-377±23.42氟西汀组82±15.08-397±19.78纹状体区对照组1 703±235.8 742±18.42 316±34.21 CUS组1 527±147.5 302±24.51a143±16.37a双歧杆菌组1 381±183.5 482±17.35b287±28.54b氟西汀组1 512±194.7 547±21.65b297±27.93b
3 讨论
我们根据Desbonnet等[10]的研究,设计了本实验,结果显示首次行为评估各组大鼠行为差异无统计学意义;3周CUS后行为提示CUS可引起大鼠抑郁样行为;干预后的行为评估,CUS组大鼠抑郁样行为较对照组抑郁样行为多,提示CUS组抑郁样行为得到维持;CUS组大鼠抑郁样行为较双歧杆菌组、氟西汀组多,提示双歧杆菌、氟西汀均可能逆转CUS组大鼠抑郁样行为。其中,氟西汀对CUS大鼠抑郁样行为的作用与国内张国栋等[11]的研究一致,双歧杆菌对CUS组大鼠抑郁样行为的作用与Desbonnet等的研究一致,双歧杆菌组与氟西汀组相比差异无统计学意义,提示双歧杆菌对CUS大鼠抑郁样行为的逆转效果与氟西汀类似,这也进一步从行为学方面印证了Desbonnet等的研究结果。
既往研究指出,应激刺激如强迫游泳所产生的行为反应由大脑中神经回路调节,这种调节机制在很大程度上是通过神经内分泌、自主神经系统和免疫系统的作用[12]。Desbonnet等[10]的研究发现,双歧杆菌可降低外周白细胞介素(IL-6)的释放,导致正常化的免疫反应,同时细胞因子的浓度改变刺激下丘脑-垂体-肾上腺(HPA)轴,使脑中单胺类神经递质的含量发生变化。与CUS组大鼠行为学表现相比,双歧杆菌组在干预后行为学的改变,也是由中枢神经系统调节的。必须强调的是,这种行为学改变已被证明在抗抑郁药理方面是特别有效的评估[13]。与CUS组相比,双歧杆菌组、氟西汀组在前额叶区5-HT浓度增加,5-HIAA浓度减少。以往的研究数据充分表明,前额叶皮质血清素调节焦虑和情绪状态。前额叶区5-HT浓度增加而5-HIAA水平减少,表明这一脑区血清素降解降低,可能由于单胺氧化酶的活性降低。类似额叶皮层5-HIAA水平减少,与多种抗抑郁药干预Sprague-Dawley大鼠后的研究一致,如丙咪嗪[14]、氟西汀[15]。杏仁核参与大脑对记忆与情感反应的处理,主要功能有产生情绪、识别情绪和调节情绪、控制学习和记忆等。与CUS组相比,双歧杆菌组、氟西汀组在杏仁核DA浓度增加而DOPAC浓度减少。鉴于有研究显示,抑郁症在中脑边缘系统多巴胺能活性异常[16],有可能双歧杆菌及氟西汀是通过抑制杏仁核DA代谢来达到抗抑郁作用的。这种结果与一些文献相悖[17],其结果显示氟西汀可提高杏仁核DA代谢。所以还需进一步研究来揭示抗抑郁剂对杏仁核DA代谢的作用机制。海马是应激反应的作用靶区,参与情绪反应、学习、记忆、认知、行为和免疫调节等多种基本生理调节。双歧杆菌与氟西汀,可以有效提高大鼠大脑ST区NE、5-HT和DA等递质浓度,而发挥其抗抑郁作用。现有研究表明,这一大脑区域的单胺类神经递质减少与抑郁症的发病有关,海马NE浓度的增加,可以改善抑郁模型大鼠的学习任务[18]。纹状体作为基底神经节的主要组成部分,包括豆状核和尾状核,作为边缘系统-皮层-纹状体神经环路的组成部分,参与抑郁症病理生理改变。CUS组大鼠大脑纹状体区存在5-HT、DA、NE等神经递质功能的降低,与CUS组相比双歧杆菌、氟西汀可以有效提高大鼠大脑纹状体区5-HT、DA、NE等递质浓度,并且双歧杆菌、氟西汀可以改善5-HT的5-HIAA和DA的DOPAC、HVA代谢通路活性,从而发挥其抗抑郁作用。
本研究的不足之处:(1)样本量较小,仍需更多、更可靠的研究结果支持双歧杆菌对抑郁症的治疗效果;(2)初步阐明双歧杆菌抗抑郁的神经内分泌机制,仍需从免疫学、影像学、基因组学等方面进一步探讨。
[1]沈渔邨.精神病学[M].北京:人民卫生出版社,2009:548
[2]Qin J,Li Y,Cai Z,et a1.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature,2012,490(7418):55
[3]周政,王巧民,宋继中.肠易激综合征与抑郁症关系研究[J].安徽医药,2009,13(3):337
[4]Song C,Wang H.Cytokines mediated inflammation and decreased neurogenesis in animal models of depression[J].Prog Neuropsychopharmacol Biol Psychiatry,2011,35(3):760
[5]Liu D,Wang Z,Gao Z,et al.Effects of curcumin on learning and memory deficits,BDNF,and ERK protein expression in rats exposed to chronic unpredictable stress[J].Behav Brain Res,2014,271:116
[6]Bianchi M,Shah A J,Fone K C,et al.Fluoxetine administration modulates the cytoskeletal microtubular system in the rat hippocampus[J].Synapse,2009,63(4):359
[7]Ge J F,Qi C C,Zhou J N.Imbalance of leptin pathway and hypothalamus synaptic plasticity markers are associated with stressinduced depression in rats[J].Behav Brain Res,2013,249:38
[8]郭晓云,崔东红,傅迎美,等.文拉法辛对慢性轻度应激鼠海马基因表达的基因芯片研究[J].中华精神科杂志,2011,44(3):169
[9]叶缘苑,王高华,王惠玲,等.脑源性神经营养因子对慢性不可预见性温和应激大鼠行为和海马胶质纤维酸性蛋白表达的影响[J].中华精神科杂志,2012,45(5):299
[10]Desbonnet L,Garrett L,Clarke G,et al.Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression[J].Neuroscience,2010,170(4):1179
[11]张国栋,董娇,李晏,等.慢性应激抑郁模型大鼠海马组织S100B表达及氟西汀的干预作用[J].中华行为医学与脑科学杂志,2013,22(11):978
[12]Herman J P,Cullinan W E.Neurocircuitry of stress:central control ofthe hypothalamo-pituitary-adrenocorticalaxis[J].Trends Neurosci,1997,20(2):78
[13]Cryan J F,Page M E,Lucki I.Differential behavioral effects of the antidepressants reboxetine,fluoxetine,and moclobemide in a modied forced swim test following chronic treatment[J].Psychopharmacology,2005,182(3):335
[14]Xu Y,Ku J S,Yao H Y,et al.Antidepressant effects of curcumin in the forced swim test and olfactory bulbectomy models of depression in rats[J].Pharmacol Biochem Behav,2005,82(1):200
[15]Shishkina G T,Iudina A M,Dygalo N N.Effects of fluoxetine on locomotor activity:possible involvement of dopamine[J].Zh Vyssh Nerv Deiat Im I P Pavlova,2006,56(4):523
[16]Klimek V,Schenck J E,Han H,et al.Dopaminergic abcontrolities in amygdaloid nuclei in major depression:a postmortem study[J].Biol Psychiatry,2002,52(7):740
[18]Srikumar B N,Raju T R,Shankaranarayana Rao BS.The involvement of cholinergic and noradrenergic systems in behavioural recovery following oxotremorine treatment to chronically stressed rats[J].Neuroscience,2006,143:679
(2016-02-04收稿)
Effect of bifidobactera on behavior and monoam ine neurotransm itters in rats w ith unpredictable chronic stress
LUO Guo-shuai1,YANG Jian-li2,WANG Cheng-zhan1,SI Ji-jian2,WANG Li-li2
(1.Graduate School,Tianjin Medical University,Tianjin 300070,China;2.The Eighth Department of Psychiatry,Tianjin Anding Hospital,Tianjin 300074,China)
Objective:To investigate the changes in the behavior and the monoamine neurotransmitters in prefrontal cortex(PFC),striatum(ST),amygdala(AM)and hippocampus(HIP),and to explore the anti-depressive effect and the possible mechanisms related to bifidobacteria.M ethods:Forty male SD rats were divided into chronic unpredictable stress(CUS)group,control group,bifidobacteria group(Bif),fluoxetine group(FLX)and random ly according to random number table(n=10 each).Rats in CUS group,Bif group and FLX group were all fed separately and
CUS for 6 weeks.Rats in control group were fed in groups(5 rats in every cage)in standard environment for 6 weeks.Rats in Bif group and FLX group had a lavage with bifidobacteria and fluoxetine respectively during the last 3 weeks every day,while the CUS group and control group were given the same volume of solvent.Each rat went through a behavioral assessment before and after CUS and after intervention.Behavioral assessment included sucrose water consumption test,weight measurement and open field test(horizontal moving distance,number of vertical,number of faece).The concentration of the monoamine neurotransmitters(NE,5-HT,DA)and its metabolites(DOPAC,HVA,5-HIAA)in prefrontal cortex(PFC),striatum(ST),amygdala(AM)and hippocampus(HIP)with CoulArray HPLC were measured at last.Results:(1)Behavioral assessment after CUS:consumption of sucrose water,gain of body weight,distance of horizontal moving and number of vertical of rats in CUS group,Bif group and FLX group were all less than rats in control group,while the number of faece were more than rats in control group.(2)Behavioral assessment after intervention:consumption of sucrose water,gain of body weight,distance of horizontal moving and number of vertical of rats in control group,Bif group and FLX group were all higher than rats in CUS group while the number of faece were less than rats in control group.(3)Neurotransmitter index:Compared with the control group,the CUS group had significantly decreased monoamine neurotransmitter NE,DA and 5-HT and some of its metabolites in the brain region PFC,ST,AM and HIP.Compared with the CUS group,Bif group and FLX group had significantly increased monoamine neurotransmitter NE,DA and 5-HT and some of its metabolites in the brain region PFC,ST,AM and HIP(except the 5-HT decreased significantly in AM).
Conclusion:Bifidobactera and fluoxetine can effectively improve the depressive behavior of the CUS rats,increase the content of monoamine neurotransmitter NE,5-HT,DA and its metabolites in the PFC,AM,ST and HIP brain regions,indicating that the antidepressant effect and possible mechanism of bifidobactera is similar to fluoxetine and may be related to the neurotransmitters.
depression;bifidobactera;rats;fluoxetine;chronic unpredictable stress
R749
A
1006-8147(2016)05-0401-05
罗国帅(1988-),男,硕士在读,研究方向:精神病的发病机制及临床治疗;通信作者:杨建立,E-mail:yangjianli0722@163.com。
[17]杨怡.茶氨酸对抑郁模型大鼠行为学、神经递质的影响[D].长沙:中南大学,2013.10.7666/d.y2423469
