利拉鲁肽降低高脂喂养大鼠胰腺GRP78的表达
2016-11-08郭晓宇何建秋刘晓燕
王 平,郭晓宇,高 宇△,何建秋,宋 娜,刘晓燕
(1.承德医学院,河北承德 067000;2.承德医学院附属医院内分泌科)
利拉鲁肽降低高脂喂养大鼠胰腺GRP78的表达
王平1,郭晓宇2,高宇2△,何建秋2,宋娜2,刘晓燕2
(1.承德医学院,河北承德067000;2.承德医学院附属医院内分泌科)
目的:通过观察利拉鲁肽对高脂喂养大鼠胰腺GRP78表达的影响,探讨利拉鲁肽对胰腺内质网应激的作用。方法:雄性Wistar大鼠24只随机分为对照组、高脂组、干预组1(低剂量利拉鲁肽100μg/kg/ d皮下注射2周)、干预组2(高剂量利拉鲁肽200μg/kg/d皮下注射2周),每组6只。分别检测各组大鼠的空腹血糖(FBG)、空腹胰岛素(FINS)、血清游离脂肪酸(FFA)、总胆固醇(TC)、甘油三酯(TG),并计算HOMA-β。采用Western blotting法和Realtime-PCR技术检测胰腺GRP78蛋白和mRNA的表达。结果:与对照组相比,高脂组大鼠FBG、FINS、FFA、TC、TG以及胰腺GRP78蛋白和mRNA的表达明显升高,HOMA-β明显降低(P<0.01);利拉鲁肽可呈剂量依赖性地改善高脂喂养大鼠血脂代谢紊乱并降低胰腺GRP78蛋白和mRNA的表达(P<0.01,P<0.05)。结论:利拉鲁肽可能通过降低胰腺GRP78蛋白和mRNA表达,改善胰腺的内质网应激,从而保护胰岛β细胞。
利拉鲁肽;葡萄糖调节蛋白78;内质网应激
2型糖尿病是一种进展性疾病,β细胞功能进行性衰竭是主要原因之一,研究显示,高脂状态不仅使胰岛β细胞功能受损,并与内质网应激(ERS)密切相关[1]。胰高血糖素样多肽-1(GLP-1)类似物利拉鲁肽是治疗2型糖尿病的新型药物。有研究发现利拉鲁肽能保护胰岛β细胞,但具体机制尚不清楚[2]。本研究应用利拉鲁肽对高脂喂养大鼠进行干预,观察利拉鲁肽对大鼠胰腺葡萄糖调节蛋白78(GRP78)表达的影响,探讨利拉鲁肽保护胰岛β细胞的可能机制。
1 材料与方法
1.1动物与饲料Wistar雄性大鼠24只,体重230-260g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。普通饲料:总热量为337kCal/100g,碳水化合物64.19%、脂肪12.04%、蛋白质23.77%;高脂饲料:总热量为486kCal/100g,碳水化合物30.01%、脂肪53.75%、蛋白质16.24%;均购于北京科奥协力有限公司。
1.2实验分组大鼠适应性喂养3天,随机分为对照组、高脂组、干预组1和干预组2,每组6只。对照组使用普通饲料喂养,高脂组、干预组1和干预组2使用高脂饲料喂养;第9周起,干预组1和干预组2分别给予不同剂量利拉鲁肽(100μg/kg/d、200μg/kg/d)腹部皮下注射2周。用药结束后,大鼠用10%水合氯醛腹腔注射麻醉后打开腹腔,腹主动脉取血后处死大鼠,取胰腺入液氮速冻后移入-80℃冰箱保存。
1.3相关指标和测定方法
1.3.1血液指标:全血标本离心取上清,分别检测空腹血糖(FBG)、游离脂肪酸(FFA)、空腹胰岛素(FINS)水平、甘油三酯(TG) 和总胆固醇(TC)。FFA检测使用ELASIA试剂盒(南京建成生物工程研究所),检测FBG、FINS、TG和TC使用全自动生化分析仪。
1.3.2计算胰岛β细胞功能指数(HOMA-β):HOMA-β=20×FINS/(FBG-3.5)。
1.3.3Western blotting法检测GRP78蛋白表达:提取胰腺总蛋白,按BCA法测定蛋白浓度。10% SDS-PAGE凝胶电泳、转膜,加入一抗(GRP78 1:200,β-actin 1:400)和二抗(均购自武汉博士德生物工程有限公司),X光胶片曝光。应用Image J 1.49软件分析,以目的条带和β-actin条带的灰度比值作为目的蛋白的相对表达水平。
1.3.4Real-time PCR法检测GRP78 mRNA表达:提取胰腺总mRNA,逆转录合成cDNA。引物序列如下:GRP78:上游引物5-AACCCAGATGAGGCTGTAGCA-3,下游引物5-ACATCAAGCAGAACCAGGTCAC-3;β-actin:上游引物5-ATGCCATCCTGCGTCTGGACCTGGC-3,下游引物5-AGCATTTGCGGTGCACGATGGAGGG-3。以β-actin为内参,得出CT值,通过2-△△Ct法计算GRP78 mRNA的相对表达含量。
1.4统计分析使用SPSS 19.0软件进行统计处理,多组间均数的比较用单因素方差分析,两两比较采用SNK-q法,以P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠血液指标结果与对照组相比:高脂组大鼠的FBG、FFA、FINS、TC、TG明显升高,OMA-β明显降低(P<0.01,P<0.05)。与高脂组相比:干预组1大鼠FFA明显下降(P<0.05);干预组2大鼠FBG、FFA、FINS、TC、TG明显下降,HOMA-β明显升高(P<0.05, P<0.01)。与干预组1比较:干预组2大鼠的FBG、FFA、TC明显下降,HOMA-β明显升高(P<0.05)。见表1:
表1 四组大鼠血液指标检测结果(n=6±s )
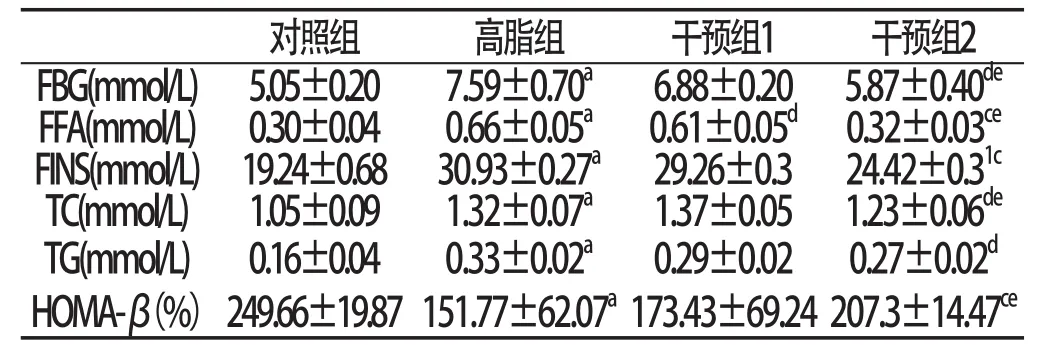
表1 四组大鼠血液指标检测结果(n=6±s )
与对照组比较:aP<0.01,bP<0.05;与高脂组比较:cP<0.01,dP<0.05;与干预组1比较:eP<0.05
对照组 高脂组 干预组1 干预组2 FBG(mmol/L)5.05±0.20 7.59±0.70a 6.88±0.20 5.87±0.40deFFA(mmol/L)0.30±0.04 0.66±0.05a 0.61±0.05d0.32±0.03ceFINS(mmol/L)19.24±0.68 30.93±0.27a29.26±0.3 24.42±0.31cTC(mmol/L)1.05±0.09 1.32±0.07a 1.37±0.05 1.23±0.06deTG(mmol/L)0.16±0.04 0.33±0.02a 0.29±0.02 0.27±0.02dHOMA-β(%)249.66±19.87 151.77±62.07a173.43±69.24 207.3±14.47ce
2.2各组大鼠胰腺GRP78的表达高脂组GRP78蛋白及mRNA表达较对照组大鼠明显升高(P<0.01)。干预组1和干预组2大鼠GRP78蛋白及mRNA表达较高脂组大鼠明显降低(P<0.01,P<0.05);并且,干预组2大鼠GRP78蛋白及mRNA表达较干预组1大鼠明显降低(P<0.05)。见附图,表2。
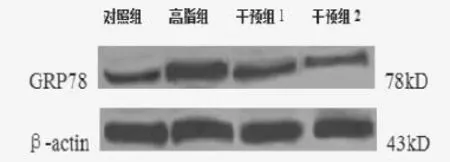
附图 各组大鼠胰腺GRP78蛋白的表达

与对照组比较:aP<0.01;与高脂组比较:bP<0.05,cP<0.01;与干预组1比较:dP<0.05
3 讨论
脂毒性可导致胰腺β细胞功能减退,而胰岛β细胞功能受损与内质网应激(ERS)密切相关[3-4]。GRP78是ERS的标志性因子,GRP78表达升高说明发生了ERS。GRP78表达升高,将激活下游肌醇需要酶1α(IRE1α)/X盒结合蛋白1 (XBP1)、RNA依赖的蛋白激酶样激酶(PERK)/真核翻译起始因子(elf2α)和转录激活因子6(ATF6)三条通路,并以不同方式造成胰腺的损伤,导致胰岛β细胞出现功能障碍[5-6]。本研究发现,高脂组大鼠血脂异常、胰腺GRP78蛋白和mRNA的表达明显升高、HOMA-β明显降低,说明高脂饮食喂养大鼠在出现血脂异常的同时,胰腺GRP78表达升高且胰岛β细胞功能下降。
GLP-1类似物利拉鲁肽是新型降糖药,以葡萄糖浓度依赖性来降低血糖。研究发现,利拉鲁肽除降糖外,还能改善血脂代谢紊乱[7-8]。本研究亦证实了这一点,利拉鲁肽可呈剂量依赖性地改善高脂饮食大鼠的血脂,与国内陈婷等[9]的研究结果一致。本研究还发现,利拉鲁肽干预可明显降低高脂喂养大鼠胰腺GRP78蛋白和mRNA的表达,并能升高HOMA-β,并且这种作用与利拉鲁肽的剂量有关。因此本研究提示,利拉鲁肽可能通过降低胰腺GRP78蛋白和mRNA表达,改善胰腺的ERS,从而保护胰岛β细胞。
[1]王子婧,宋光耀,李萍.不同脂肪酸饮食对大鼠胰岛β细胞功能及内质网应激影响的研究[J].中国糖尿病杂志,2015,23(6):562-564.
[2]Zhao L, Guo H, Chen H, et al. Effect of Liraglutide on endoplasmic reticulum stress in diabetes[J]. Biochem Biophys Res Commun, 2013, 441(1): 133-138.
[3]Cnop M, Ladrière L, Igoillo-Esteve M, et al. Causes and cures for endoplasmic reticulum stress in lipotoxic β-cell dysfunction[J]. Diabetes Obes Metab, 2010, 12(Suppl 2): 76-82.
[4]Tiano JP, Delghingaro-Augusto V, Le May C, et al. Estrogen receptor activation reduces lipid synthesis in pancreatic islets and prevents β cell failure in rodent models of type 2 diabetes[J].J Clin Invest, 2011,121(8): 3331-3342.
[5]Sommerweiss D, Gorski T, Richter S, et al. Oleate rescues INS-1E β-cells from palmitate-induced apoptosis by preventing activation of the unfolded protein response[J].Biochem Biophys Res Commun, 2013, 441(4): 770-776.
[6]Jung IR, Choi SE, Jung JG, et al. Involvement of iron depletion in palmitate-induced lipotoxicity of beta cells[J]. Mol Cell Endocrinol, 2015, 15(407): 74-84.
[7]Vinodraj K, Nagendra Nayak IM, Rao JV, et al. Comparison of the efficacy of liraglutide with pioglitazone on dexamethasone induced hepatic steatosis, dyslipidemia and hyperglycaemia in albino rats[J]. Indian J Pharmacol, 2015, 47(2): 181-184.
[8]Sélley E, Kun S, Kürthy M, et al. Para-Tyrosine Supplementation Improves Insulin- and Liraglutide-Induced Vasorelaxation in Cholesterol-Fed Rats[J]. Protein Pept Lett, 2015, 22(8): 736-742.
[9]陈婷,陈璐璐,郑涓,等.利拉鲁肽早期干预对高脂饮食追赶生长大鼠脂肪追赶生长的作用[J].中华内分泌代谢杂志,2014,30(5):417-421.
EFFECTS OF LIRAGLUTIDE ON REDUCING GRP78 EXPRESSION IN PANCREAS OF RATS WITH HIGH FAT DIET
WANG Ping, GUO Xiao-yu, Gao Yu, et al
(Chengde Medical College, Hebei Chengde 067000, China)
Objective: To investigate the effects of liraglutide on pancreatic endoplasmic reticulum stress by observing the effects of liraglutide on glucose regulated protein 78 (GRP78) expression in pancreas of rats fed with high fat diet. Methods: 24 male Wistar rats were randomly divided into control group, high fat group, intervention group 1 and intervention group 2 (100μg/kg/d or 200μg/kg/d liraglutide, subcutaneous injection for 2 weeks) with 6 rats in each group. The fasting blood glucose (FBG), fasting insulin (FINS), free fatty acid (FFA), total cholesterol(TC), triglyceride (TG) of rats were respectively determined and HOMA-β was calculated. Western blotting and realtime-PCR were used to detect the GRP78 protein and mRNA expression in pancreas of rats. Results: Compared with rats in control group, the FBG, FINS, FFA, TC, TG and GRP78 protein and mRNA expression in pancreas of rats in high fat group increased obviously, but HOMA-β decreased obviously (P<0.01). Liraglutide could improve blood lipid metabolism disorders and reduce GRP78 protein and mRNA expression in pancreas of rats fed with high fat diet in a dose-dependent manner (P<0.01,P<0.05). Conclusions: Liraglutide may improve pancreatic endoplasmic reticulum stress and protect islet beta cells by reducing expression of GRP78 protein and mRNA in pancreas.
Liraglutide; Glucose regulated protein 78 (GRP78); Endoplasmic reticulum stress
R589
A
1004-6879(2016)05-0361-03
△
(2016-01-31)
