白酒中邻苯二甲酸二乙酯的化学发光酶联免疫分析方法
2016-10-21黄少文羿利华孙远明雷红涛柳春红沈玉栋
黄少文,羿利华,孙远明,2,3,雷红涛,2,3,柳春红,2,3*,沈玉栋,2,3*
1(华南农业大学 食品学院,广东 广州,510642) 2(广东省食品质量安全重点实验室,广东 广州,510642) 3(农业部农产品贮藏保鲜质量安全风险评估实验室,广东 广州,510642)
白酒中邻苯二甲酸二乙酯的化学发光酶联免疫分析方法
黄少文1,羿利华1,孙远明1,2,3,雷红涛1,2,3,柳春红1,2,3*,沈玉栋1,2,3*
1(华南农业大学 食品学院,广东广州,510642)2(广东省食品质量安全重点实验室,广东 广州,510642)3(农业部农产品贮藏保鲜质量安全风险评估实验室,广东 广州,510642)
以邻苯二甲酸二乙酯(diethylphthalate,DEP)为研究目标,以4-氨基邻苯二甲酸二乙酯为半抗原,通过重氮法偶联载体蛋白并免疫动物,制备针对DEP的特异性兔多克隆抗体。通过棋盘滴定法和单因素实验确定最佳的实验参数,即包被抗原浓度为50ng/mL,4 ℃环境下包被12h;抗体用T液稀释;药物缓冲液选用pH5.4、0.005mol/L的PBS缓冲液;酶标二抗用P液稀释,稀释度为1/3000;反应时间是:一抗∶二抗=30min:40min。基于此建立了间接竞争化学发光酶联免疫法检测DEP。该方法对DEP的最低检测限(LOD)为3.09ng/mL,检测范围(IC20~IC80)为5.93~42.03ng/mL,半抑制浓度(IC50)值为16.57ng/mL,与14种结构类似物及功能类似物交叉反应均远低于0.5%,通过对白酒样品添加回收率的测定,证明了该方法的准确性,适用于白酒中DEP的快速检测。
邻苯二甲酸二乙酯;化学发光酶联免疫;间接竞争
邻苯二甲酸二乙酯(diethylphthalate,DEP)属于邻苯二甲酸酯类化合物中(phthalicacidesters,PAEs)的一种,主要用于塑料增塑剂、润滑剂、树脂溶剂、印刷油墨、胶黏剂、化妆品、农药载体等领域[1],在生产和加工过程中,作为增塑剂的DEP并未与PVC塑料基质或其他产品牢固结合,随着这些产品的使用或废弃,DEP就会不断的释放进入环境,成为普遍的环境污染物[2],并可通过食物链进入人体[3-4]。动物实验已证实,DEP对生殖系统有损害作用[6-13]。为了减少DEP对人类健康的潜在危害,美国环保总局(EPA)将包括DEP在内的6种PAEs列为环境中重点控制的污染物[14],我国将包括DEP在内的3种PAEs类化合物列入优先污染物黑名单,世界自然基金会(WWF)公布的68种环境类激素污染物中也包括了DEP等8种PAEs类化合物[15],2011年台湾地区多种饮料和果汁中先后检测出高剂量的DEP等PAEs类化合物,同年卫生部发布紧急通告,将包括DEP在内的17种邻苯二甲酸酯类物质列入“食品中可能违法添加的非食用物质和易滥用的食品添加剂名单”[16]。
目前,检测邻苯二甲酸二乙酯的方法主要是仪器分析法,包括气相色谱法[17-18]、气相色谱-质谱法[19-21]和高效液相色谱法[22-25]高效液相色谱-质谱法[26],但这类分析方法仪器昂贵、样品处理复杂、分析时间长,很难满足现场大规模及快速检测。而免疫分析法具有灵敏度高、特异性强、能适应大量样品的快速检测等特点。此前,已有对邻苯二甲酸二乙酯酶联免疫吸附方法的报道,ZHANG等[27]报道了纯牛奶、酸奶中DEP含量的间接竞争ELISA方法,检测限为0.004 9ng/mL。
化学发光酶免疫分析法是一种新型的免疫分析方法,该方法在进行检测时不需要外界光源,减少了背景干扰,可以进一步提高检测的灵敏度,具有简便、灵敏、无污染等特点[28]。目前尚无化学发光酶免疫法检测DEP的报道。而白酒在生产过程中由于没有完全杜绝塑料制品作为输送管道或以塑料制品来进行酒的存储,致使添加到塑料中的DEP有可能迁移到白酒中对白酒造成污染。因此,有必要加强对白酒中的DEP进行监测。本研究在合成DEP半抗原及多克隆抗体的基础上,建立了DEP化学发光酶免疫分析方法。该方法对于大规模快速筛查白酒类食品中的DEP具有实用价值。
1 材料与方法
1.1材料与仪器
MS1漩涡振荡仪,广州仪科实验室技术有限公司;星海旋转蒸发器,无锡市星海王生化设备有限公司;WellwashMK2洗板机,美国Thermo公司;MultiskanMK3酶标仪,美国Thermo公司;96孔可拆卸发光板,深圳金灿华实业有限公司;TGL-16G高速台式离心机,上海安亭科学仪器厂生产;移液枪,德国Eppendorf公司;DK-8D电热恒温水槽,上海医用恒温设备厂;其他玻璃器皿均为国产。
邻苯二甲酸二乙酯(Sigma公司);HRP标记的羊抗兔IgG抗体(武汉博士德生物工程有限公司);包被缓冲液(CB液,0.1mol/LpH9.6):称取NaHCO31.475g,Na2CO30.845g, 再用去离子水定容至500mL;磷酸缓冲液PBS(pH7.4,0.01mol/L):称取8.5gNaCl,2.9gNa2HPO4·12H2O,0.2gKCl,0.2gKH2PO4,再用去离子水定容至1L;PBST:上述PBS基础上,每1L添加500μL吐温20(Tween-20);洗涤液:称取40gNaCl,15gNa2HPO4·12H2O,3mL吐温-20,再用去离子水定容至5L;柠檬酸缓冲液(pH5.0, 0.05mol/L):称取18.4gNa2HPO4·12H2O,5.11g柠檬酸,溶于1L去离子水;醋酸缓冲液(pH4.0):称取29.25gNaCl,2.45gNaAC·3H2O,4.74mLHAC溶于1L去离子水;Tris-HCl缓冲液(0.01mol/LpH7.4):即T液,Tris1.21g,用800mL去离子水溶解;用1mol/L盐酸溶液调节溶液到所需pH值;用去离子水定容至1L;CLEIA底物液A:Luminol-Na4mg溶于20mL0.1moL/L的T液中;CLEIA底物液B:2mg对碘酚溶于100μL二甲基亚砜(DMSO),加入4μL3%的双氧水(H2O2)。
1.2实验方法
1.2.1半抗原及抗原合成
取543.5mg4-氨基邻苯二甲酸(4-APA)溶于14mL无水乙醇,室温下逐滴加入4mL氯化亚砜,于70 ℃反应过夜。反应结束后旋蒸除去反应液,得到的粗产物用10mL饱和Na2CO3调碱,再加入饱和NaCl/乙酸乙酯体系萃取3次,收集有机相,加无水硫酸钠粉末于有机相中除水,使用过滤的方法除去硫酸钠,得到的有机相经旋蒸浓缩后过硅胶柱(石油醚∶乙酸乙酯=40∶17),得到黄色固体(半抗原4-氨基邻苯二甲酸二乙酯即4-ADEP),产物经薄层层析鉴定纯度后,进一步用质谱(MS)及核磁共振(NMR)进行结构鉴定。通过重氮化法[29]偶联载体蛋白BSA和OVA,获得免疫原4-ADEP-BSA和包被原4-ADEP-OVA,用紫外扫描法对偶联物进行鉴定[30]。
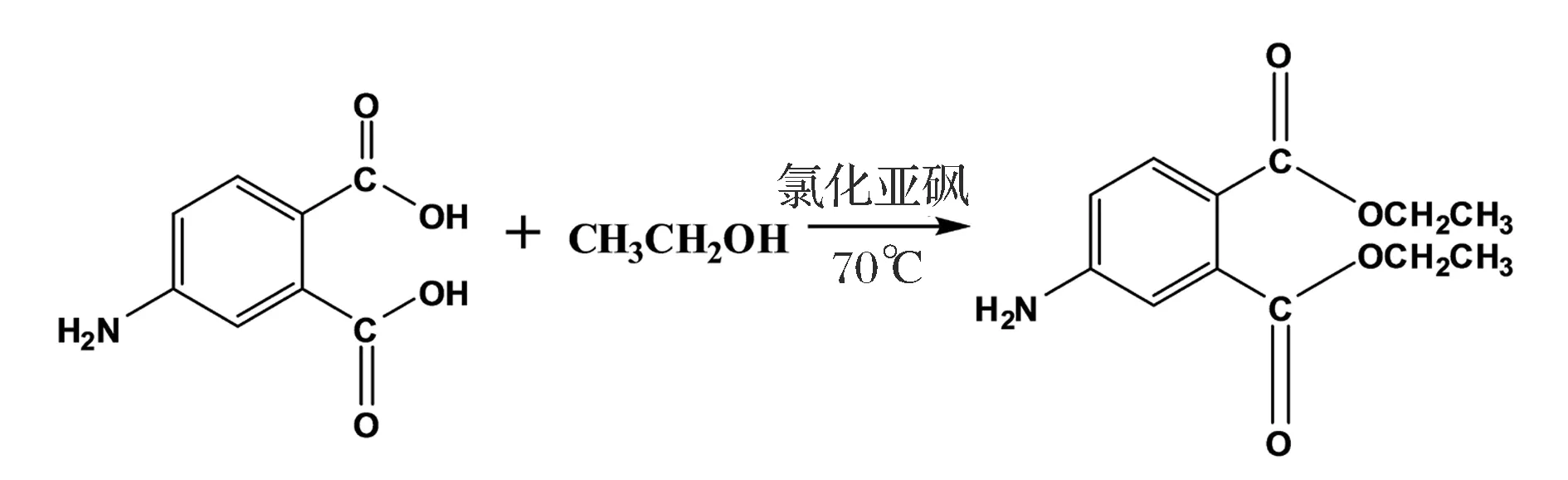
图1 邻苯二甲酸二乙酯半抗原合成设计Fig.1 The synthesis of 4-ADEP
1.2.2抗体的制备
合成的4-ADEP-BSA作免疫原免疫。将免疫原用生理盐水稀释至1mg/mL(以蛋白浓度计),分别免疫两只SPF级1.8~2.2kg雌性新西兰大白兔,实验前取阴性血清作为对照。首次免疫用1mg免疫原与等体积的弗氏完全佐剂混合,乳化成油包水结构后使用皮下多点注射。4周后用同样剂量的免疫原与弗氏不完全佐剂进行免疫,随后每隔3周注射1次直至抗血清效价稳定。最后1次免疫后7天心脏动脉取血,采用室温自然凝固分离抗血清,在4 ℃下放置过夜,12 000r/min离心15min,取上清液即得抗血清,加入等量甘油混匀分装,于-20 ℃冻存。用间接ELISA法测定上述兔抗血清效价和抑制。
1.2.3icCLEIA检测模式的建立
实验步骤:用包被缓冲液将包被抗原稀释到最佳使用浓度,加到酶标板孔中,100μL/孔,37 ℃(或4 ℃)包被过夜;倾去孔内液体,自动洗板机上洗涤2次,每孔加洗涤液300μL,甩干;分别加入封闭缓冲液120μL/孔,37 ℃培养箱中孵育3h;将封闭好的板取出,甩去各孔中的封闭液,再置37 ℃烘箱中0.5h,备用;平衡30min后加入梯度稀释标准溶液(或样品提取液)50μL/孔,同时加入抗体50μL/孔,轻摇混合,37 ℃培养箱中孵育40min;洗涤5次,甩干;加入100μL/孔羊抗兔IgG-HRP(1/5 000倍稀释),37 ℃培养箱中孵育40min;洗涤5次,甩干;每孔加入化学发光显色液100μL(A、B液等量混匀),立即用酶标仪读取425nm处的相对发光值(Relativelightunit,RLU)。
实验条件优化:为使CLEIA方法获得最好的灵敏度和稳定性,本研究用方阵试验法(棋盘滴定)确定包被抗原浓度和抗体稀释倍数,以单因素实验,考察药物缓冲液、pH、二抗浓度、竞争反应时间等对icCLEIA的影响,并采用RLU0/IC50来对比不同CLEIA反应条件下方法灵敏度的差异,RLU0/IC50的值越高,说明方法的灵敏度也越高。在最优条件下,以邻苯二甲酸二乙酯浓度的对数值IgC为横坐标,相应的发光值RLU为纵坐标,使用Origin8.0软件,按照RLU-IC50四参数对数拟合绘制邻苯二甲酸二乙酯icCLEIA方法的标准曲线。根据标准曲线计算出该方法的IC50和线性(IC20~IC80)。
1.2.4icCLEIA特异性分析
采用所建立的方法测定抗邻苯二甲酸二乙酯多克隆抗体与邻苯二甲酸二乙酯结构类似物的竞争反应,分别计算邻苯二甲酸二乙酯结构类似物的IC50,则交叉反应率为邻苯二甲酸二乙酯与其结构类似物的IC50之百分比。交叉反应率越高,特异性越差。
1.2.5样品前处理
称取一定量白酒于玻璃试管中,40 ℃下氮吹至近干,加入2mL超纯水洗1次,后加入6mL正己烷萃取,涡旋1min,静置2min,收集正己烷层,正己烷重复萃取1次,合并正己烷层,40 ℃旋转蒸发浓缩,1mL甲醇复溶,稀释后用于icCLISA方法进行测定。
1.2.6实际样品检测
在白酒样品中添加不同含量水平的标准品,另设1个空白样本,按照样品前处理方法对样品进行处理,计算样品添加回收率(Recovery,%)和变异系数(CV,%)。
2 结果与分析
2.1半抗原合成与鉴定
合成的半抗原4-氨基邻苯二甲酸二乙酯(4-ADEP)(相对分子质量为237)经电喷雾质谱和核磁共振扫描鉴定图谱分析结果(见图2和图3):合成产物的(+)ESI-MS质谱图,出现m/z 238.0的分子离子峰,与邻苯二甲酸二乙酯半抗原分子质量对应。1H-NMR(600MHz,CDCl3):7.72 (d, J = 8.44Hz, 1H,CH), 6.72 (d, J = 2.28Hz, 1H,CH), 6.68 (dd, J = 8.45, 2.30Hz, 1H,CH), 4.35 (q, J = 7.16Hz, 2H,CH2), 4.29 (q, J = 7.13Hz, 2H,CH2), 4.20 (s,br, 2H,NH2), 1.32~1.37 (m, 6H, 2CH3)。证明4-氨基邻苯二甲酸二乙酯合成成功。

图2 半抗原4-ADEP的ESI-MS图谱( [M-H]+)Fig.2 The ESI-MS spectrum of 4-ADEP

图3 半抗原4-ADEP的1H-NHR图谱Fig.3 The 1H-NHR spectrum of 4-ADEP
2.2人工抗原鉴定
采用重氮化法合成人工抗原,紫外可见光谱扫描鉴定人工抗原。从图4可以看出,相比半抗原(最大吸收275nm)和载体蛋白(最大吸收280nm),人工抗原的特征吸收(最大吸收339nm)已经发生明显的偏移。这是因为在载体蛋白上成功偶联半抗原后,半抗原最大吸收相互叠加,所以紫外光谱中峰形发生了改变,同时具备载体蛋白和半抗原的吸收特征。这说明在载体蛋白BSA和OVA上分别连接了半抗原,人工免疫抗原和包被抗原偶联成功。

图4 4-ADEP、蛋白及偶联物紫外扫描图谱Fig.4 The UV-scanning of 4-ADEP,protein and conjugates
2.3抗体的鉴定
采用间接竞争ELISA法测定抗血清效价为1∶32 000,抗DEP兔多抗具有很高的效价,对抗血清作效价抑制曲线,结果见图5。从图5可以看出,抗血清的效价为32K,抑制率为82.93%,对邻苯二甲酸二乙酯的特异性较好,因此,说明人工抗原成功诱导兔子体内产生免疫应答,其体内产生了相应的抗体,进一步证明全抗原合成非常成功,而且纯度较高。

图5 兔抗血清效价抑制曲线Fig.5 The titer and inhibition curve of rabbit antiserum
2.4邻苯二甲酸二乙酯icCLEIA方法建立
对影响icCLEIA的实验参数进行了优化,通过比较RLU0/IC50值大小(值越大方法的检测效果越好)[31],得到最佳反应条件,即包被抗原浓度为50ng/mL,4 ℃环境下包被12h;抗体用T液稀释;药物缓冲液选用pH5.4、0.005mol/L的PBS缓冲液;酶标二抗用P液稀释,稀释度为1/3 000;反应时间是:一抗∶二抗=30min∶40min。基于此构建了邻苯二甲酸二乙酯的icCLEIA标准曲线,结果如图6,拟合得到icCLEIA的检测限为3.09ng/mL,检测范围为5.93~42.03ng/mL,半抑制浓度为16.57ng/mL。

图6 邻苯二甲酸二乙酯icCLEIA标准曲线Fig.6 Sdandard curve of DEP
2.5抗体的特异性研究
对方法的特异性进行评价,其灵敏度(IC50)、交叉反应率(CR),如表1所示。可以看出,14种类似物中,除了与邻苯二甲酸二异丁酯和邻苯二甲酸二丁酯有一点交叉外,但交叉反应率均小于0.5%,与其他药物均没有交叉反应,表明以邻苯二甲酸二乙酯抗体建立的icCLEIA方法特异性良好,灵敏度高。
2.6实际样品检测
向阴性样品中添加0.3、1.0和2.0μg/g的DEP,采用所建立的icCLEIA方法对样品进行检测,同时上述样品同样采用HPLC进行检测比较, 结果表明(表2),icCLEIA方法的样品回收率在77.3%~94.2%之间,变异系数均小于12%,HPLC方法的样品回收率在83.33%~93.12%之间,变异系数均小于10%,说明所建立的icCLEIA方法的准确度和精密度好。

表1 邻苯二甲酸二乙酯结构类似物及功能类似物交叉反应率结果
3 结论
本文通过优化学发光酶免疫的各种条件,建立了邻苯二甲酸二乙酯间接竞争化学发光酶联免疫分析方法,该方法的IC50值为16.57ng/mL;样品回收率在78.9%~93.5%之间,与其他结构类似物未见明显交叉,检测范围为5.93~42.03ng/mL,最低检测限(LOD)为3.09ng/mL。采用icCLEIA和HPLC两种方法测定相同添加浓度的样品,结果与HPLC法的结果相符。该方法具有灵敏度高,操作时间短、操作简便等特点,适用于白酒样品中的DEP的大规模筛查。

表2 实际样品添加回收率(n=3)
[1]SCHETTLERTED.Humanexposuretophthalatesviaconsumerproducts[J].InternationalJournalofAndrology,2006,29(1):134-139.
[2]BLISSTV,GARDNER-MEDWINAR.Long-lastingpotentiationofsynaptictransmissioninthedentateareaoftheanaesthetizedrabbitfollowingstimulationoftheperforantpath[J].TheJournalofPhysiology,1973,232:331-356.
[3]刘册家,向兰,杨美华.我国环境中邻苯二甲酸酯分布状况研究进展[J].中国现代中药,2008(3):37-40.
[4]张蕴晖,林玲,阚海东,等.邻苯二甲酸二丁酯的人群综合暴露评估[J].中国环境科学,2007(5):651-656.
[5]EMAM,HARAZONOA,MIYAWAKIE,etal.Embryolethalityfollowingmaternalexposuretodibutylphthalateduringearlypregnancyinrats[J].BulletinofEnvironmentalContaminationandToxicology,1997,58(4):636-643.
[6]LEHMANNKP,PHILLIPSS,SARM,etal.Dose-Dependentalterationsingeneexpressionandtestosteronesynthesisinthefetaltestesofmaleratsexposedtodi(n-butyl)phthalate[J].ToxicologicalSciences,2004,81(1):60-68.
[7]SINGHAR,LAWRENCEWH,AUTIANJ.Teratogenicityofphthalateestersinrats[J].JournalofPharmaceuticalSciences,1972,61(1):51-55.
[8]常兵,刘德瑜,梁玉香,等.邻苯二甲酸二丁酯对青春期雄性大鼠的生殖毒性研究[J].中国自然医学杂志,2007, 9(3):164-168.
[9]李玲,田晓梅,宋琦如,等.邻苯二甲酸二丁酯和邻苯二甲酸二 (2-乙基己基) 酯联合染毒对雌性大鼠的生殖毒性[J].环境与健康杂志,2010,27(10):857-860.
[10] 林玲,王玉柱,丁训诚,等.邻苯二甲酸二丁酯对斑马鱼胚胎发育毒性的研究[J].卫生研究,2008,37(3):278-280.
[11]张蕴晖,陈秉衡,丁训诚,等.邻苯二甲酸二丁酯宫内和哺乳期染毒对F1 代雄性大鼠的生殖发育毒性[J].卫生研究,2004,33(1):9-14.
[12]WHO/IPCS.Globalassessmentofthestate-of-the-scienceofendocrinedisruptors[M].Geneva:WorldHealthOrganization,2002.
[13]王连生.环境污染化学[M].北京:化学工业出版社,1995:316-318.
[14]EPA.Supplementaryguidanceforconductinghealthriskassessmentofchemicalmixtures(EPA/630/R-00/002)[M].OfficeofResearch&Development,NationalCenterforEnvironmentalAssessment,EnvironmentalProtectionAgency,2000.
[15]林兴桃,王小逸,吕文涛,沈婷.邻苯二甲酸酯代谢研究进展[J]. 环境与健康杂志,2009(2):182-184.
[16]中华人民共和国卫生部.关于公布食品中可能违法添加的非食用物质和易滥用的食品添加剂名单(第六批)的公告(卫生部公告2011年第16号)[EB/OL].2011-06-01.
[17]CINELLIG,AVINOP,NOTARDONATOI,etal.StudyofXAD-2adsorbentfortheenrichmentoftracelevelsofphthalateestersinhydroalcoholicfoodbeveragesandanalysisbygaschromatographycoupledwithflameionizationandion-trapmassspectrometrydetectors[J].FoodChemistry,2014,146(3):181-187.
[18]SUNMeng,DAIJin-na,WANGXiao-fang,etal.DeterminationofphthalateestersinpolyvinylchlorideinfusionbagbystirbarsorptiveextractioncombinedwithGC[J].JournalofSeparationScience,2012,35(24):3 486-3 491.
[19]国家食品质量安全监督检验中心北京市海淀区产品质量监督检验所.GB/T21911—2008食品中邻苯二甲酸酯的测定[S].北京:中国标准出版社,2008.
[20]施雅梅,徐敦明,周昱,等.QuEChERS/高效液相色谱测定食品中17种邻苯二甲酸酯[J]. 分析测试学报,2011(12):1 372-1 376.
[21]YEQing,LIULin-hai,CHENZhong-bao,etal.Analysisofphthalateacidestersinenvironmentalwaterbymagneticgraphenesolidphaseextractioncoupledwithgaschromatography-massspectrometry[J].JournalofChromatographyA,2014,1 329(3):24-29.
[22]佟晓波,李莹,矫筱曼,等.HPLC法测定化妆品中十六种邻苯二甲酸酯类化合物[J].香料香精化妆品,2012(3):33-35.
[23]徐振东,金尉,顾娟红,等.快速液相分析法测定化妆品中邻苯二甲酸酯类化合物[J].香料香精化妆品,2012(2):33-36.
[24]FANYing-ying,LIUShu-hui,XIEQi-long.Rapiddeterminationofphthalateestersinalcoholicbeveragesbyconventionalionicliquiddispersiveliquid-liquidmicroextractioncoupledwithhighperformanceliquidchromatography[J].Talanta,2014,119(119):291-298.
[25]LIANYuan-pei,QIUXiao-yan,YANGYa-ling.Vortex-assistedliquid-liquidmicroextractioncombinedwithHPLCforthesimultaneousdeterminationoffivephthalateestersinliquorsamples[J].FoodAnalyticalMethods,2014,7(3):636-644.
[26]国家食品质量安全监督检验中心北京市海淀区产品质量监督检验所.GB/T21928—2008食品塑料包装材料中邻苯二甲酸酯的测定[S].北京:中国标准出版社,2008.
[27]ZHANGMing-cui,YUXiao-na,WANGYue,etal.Ahighlysensitiveindirectcompetitiveenzyme-linkedimmunosorbentassay(ic-ELISA)byantigencoatingfordiethylphthalateanalysisinfoods[J].FoodAnalyticalMethods,2013,6(4):1 223-1 228
[28]金茂俊,邵华,金芬,王静.化学发光免疫分析方法的研究及应用[J].农产品质量与安全,2012(2):42-46.
[29]ZHANGMing-cui,LIUBo-lin,CONGYing,etal.Developmentofhighlyspecificfluorescenceimmunoassayandenzyme-linkedimmunosorbentassayfordetectionofdimethylphthalateinwatersamples[J].FoodandAgriculturalImmunology,2011,22( 4):297-309
[30]LUOLin,SHENYu-dong,WANGHong,etal.Productionofpolyclonalantibodyanddevelopmentofacompetitiveenzyme-linkedimmunosorbentassayforbenzoicacidinfoods[J].FoodAnalyticalMethods,2015,8( 5):1 101-1 111
[31]孙文佳,沈玉栋,孙远明,等.化学发光酶免疫法检测猪肉中氯丙嗪残留[J].分析化学,2012(9):1 397-1 402.
Developmentofanindirectcompetitivechmiluminescenceenzymeimmunoassayfordiethylphthalateinliquor
HUANGShao-wen1,YILihua1,SUNYuan-ming1,2,3,LEIHong-tao1,2,3,LIUChun-hong1,2,3*,SHENYu-dong1,2,3*
1(FoodCollege,SouthChinaAgriculturalUniversity,Guangzhou510624,China)2(GuangdongProvincialKeyLaboratoryofFoodQualityandSafety,Guangzhou510642,China)3(LaboratoryofQualityandSafetyRiskAssessmentforAgro-productsonStorageandPreservation(Guangzhou),MinistryofAgriculture,Guangzhou510642,China)
4-Aminodiethylphthalate(4-ADEP)asthehaptenwascoupledtobovineserumalbumin(BSA)orovalbumin(OVA)andthenusedtoimmunizeNewZealandwhiterabbits.Polyclonalantibodywhichshowedspecificbindingtodiethylphthalate(DEP)wasthusobtained,andonthebasisofthis,anindirectcompetitivechemiluminescentenzyme-linkedimmunoassay(icCLEIA)wasdevelopedasfollows.Theoptimalconcentrationofcoatingantigenwas50ng/mLat4 ℃.TsolutionwasusingastheantibodybufferandPBSasthestandardbufferwiththepH5.4.TheIgG-HRPdilutionwas1∶3 000.Theincubationtimefortheprimaryantibodywas30minsandtheIgG-HRPreactiontimewas40mins.Underthebestconditions,theicCLEIAexhibitedalinearworkingrangefrom5.93to42.03ng/mL(IC20-IC80)withthelimitofdetectionof3.09ng/mLandthesensitivityIC50of16.57ng/mL.Thecrossreactivityrateswerelessthan0.5%.Theaveragedrecoveriesofliquorwere77.3%~94.2%.Thecoefficientofvariationofintra-assayandinter-assaywaslessthan12%.Inaddition,theaccuracyoftheassaywasvalidatedbydeterminationoftherecoveryinliquor.ThismethodhasagoodcorrelationwiththeHPLCmethod,whichindicateditshighsensitivityandspecificity.
DEP;chmiluminescence;icCLEIA
10.13995/j.cnki.11-1802/ts.201608031
硕士研究生(柳春红,沈玉栋为通讯作者,E-mail:liuch@scau.edu.cn,syd_tyx@163.com)。
农业部农产品质量安全风险评估专项
(GJFP201501202);广东省科技计划项目(2013B020204001)
2016-01-29,改回日期:2016-04-03
