牛初乳中免疫球蛋白G双抗夹心ELISA检测方法的建立
2016-08-06王丽威岳喜庆沈阳农业大学食品学院辽宁沈阳0866辽宁工程技术大学理学院辽宁阜新23000
刘 金,王丽威,2,岳喜庆,*(.沈阳农业大学食品学院,辽宁 沈阳 0866;2.辽宁工程技术大学理学院,辽宁 阜新 23000)
牛初乳中免疫球蛋白G双抗夹心ELISA检测方法的建立
刘 金1,王丽威1,2,岳喜庆1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.辽宁工程技术大学理学院,辽宁 阜新 123000)
将牛免疫球蛋白G(immunoglobulin G,IgG)作为免疫原免疫BALB/c小鼠,通过细胞融合、筛选获得分泌抗牛IgG单克隆抗体的细胞株。制备小鼠腹水抗体,进一步纯化获得抗牛IgG单克隆抗体。建立双抗夹心酶联免疫吸附法检测牛初乳中IgG质量浓度,该方法在7.8~1 000 ng/mL范围内有良好的线性关系,最低检出限为7.06 ng/mL,批内变异系数为4.52%,批间变异系数为4.94%,回收率为91.85%~102.45%。此法操作简便、准确度高、稳定性好,可用于实际牛初乳样品的快速检测。
牛初乳;免疫球蛋白G;单克隆抗体;双抗夹心酶联免疫吸附法
牛初乳一般是指奶牛分娩7 d内的乳汁。牛初乳不但含有常乳中的营养物质(蛋白质、脂肪、乳糖、脂肪酸、氨基酸和矿物质),还富含多种生理活性因子,包括免疫球蛋白、乳铁蛋白、生长因子、乳过氧化氢酶和溶菌酶等[1]。其中,免疫球蛋白是最重要的一类免疫因子,牛初乳中的免疫球蛋白主要是IgG、IgM和IgA,其中IgG的含量最高,约占80%~90%[2-3]。因此,IgG含量成为衡量牛初乳及其制品质量的重要指标。目前,牛初乳中IgG检测方法主要包括免疫扩散法[1,3-6]、免疫比浊法[1,6-8]、高效液相色谱法[1,9-10]、酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法[1,11-16]和表面等离子体共振法[16]等。这些方法中免疫扩散法应用最为广泛。但此法检测时间长、精确度不高。高效液相色谱法操作繁琐,不适合大批量检测。ELISA法是近年来迅速发展的一类检测方法,其操作简便、特异性好、准确度高,适合大量样品检测,在多个领域都得到了广泛应用。在牛初乳IgG含量检测中,国外已成功开发了试剂盒,反应模式多数是竞争模式,也有夹心模式。我国在这方面起步较晚,目前主要依赖进口检测试剂盒。本研究采用单克隆抗体和多克隆抗体,建立双抗夹心ELISA法检测牛初乳中IgG含量,为牛初乳的生产加工和质量监控提供可靠的检测方法。
1 材料与方法
1.1 材料与试剂
牛初乳样品为奶牛分娩3 d内所分泌的乳汁,采自辽宁辉山乳业,-20 ℃贮存。
BALB/c小鼠 白求恩医科大学动物试验中心;标准牛IgG、弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇、鸡卵清白蛋白、冷水鱼明胶、辣根过氧化物酶标记羊抗鼠IgG抗体 美国Sigma公司;辣根过氧化物酶标记兔抗牛IgG多克隆抗体 博奥森公司;3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)、96 孔酶标板、小鼠单隆抗体亚类鉴定试剂盒 鼎国昌盛生物技术公司;其他试剂纯度均为分析纯。
1.2 仪器与设备
Epoch微孔板分光光度计 美国Bio-Tex公司;移液器 美国Thermo公司;Milli-Q超纯水系统 美国Millipore公司。
1.3 方法
1.3.1 溶液的配制
包被液:0.05 mol/L碳酸盐缓冲液(pH 9.6);缓冲液:0.01 mol/L 磷酸盐缓冲液(phosphatebuffered saline,PBS)(pH 7.4)、0.05 mol/L Tris-HCl缓冲液(pH 8.0);稀释液:0.01%、0.05%磷酸盐吐温缓冲液(phosphate-buffered saline with Tween-20,PBST)(0.01 mol/L PBS溶液中分别加入0.01%、0.05% Tween-20)、0.05% Tris-HCl吐温缓冲液(Tris-HCl with Tween-20,TBST)(0.05 mol/L Tris-HCl溶液加入0.05% Tween-20);底物:TMB底物;终止液:2 mol/L H2SO4。
1.3.2 抗体的制备
选择6~8 周龄的雌性BALB/c小鼠,首次免疫时用标准牛IgG与等量弗氏完全佐剂充分乳化,腹腔注射,100 μg/只;2 周后进行二次免疫,与等量弗氏不完全佐剂充分乳化,腹腔注射,100 μg/只;二次免疫1周后尾尖采血,间接ELISA测定血清效价,血清效价达到6 000用于细胞融合。在融合前不加佐剂加强免疫,3 d后取鼠脾细胞,与sp20骨髓瘤细胞用聚乙二醇诱导融合后培养。采用间接ELISA法筛选阳性孔,克隆化培养[17]。选取效价最高的杂交瘤细胞注射于小鼠腹腔中,1 周后采集腹水,采用辛酸-硫酸铵法粗提纯后,使用Protein G亲和层析柱纯化并进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrymide gelelectrophoresis,SDS-PAGE)电泳分析[18]。测定单抗亚类、蛋白质质量浓度及纯度,间接ELISA法测定纯化前后效价、抗体亲和力[18]。
1.3.3 双抗夹心法的建立
包被:用包被液将1.3.2节制备的小鼠抗牛IgG单抗稀释至一定质量浓度,每孔100 μL包被酶标板,4 ℃过夜;洗涤:弃去孔内溶液并拍打,每孔加入洗涤液200 μL后,洗板60 s,重复3 次,在每两步骤之间均需洗涤,以下同;封闭:每孔200 μL封闭剂,37 ℃孵育;加样:每孔加100 μL标准牛IgG或,37 ℃孵育;加酶标抗体:每孔加100 μL辣根过氧化物酶标兔抗牛IgG多克隆抗体(以下简称酶标抗体),37 ℃孵育,洗涤4 次;加底物显色:各反应孔中加入刚刚配制的TMB底物溶液100 μL,37 ℃暗处反应10 min;终止反应:每孔加2 mol/L硫酸50 μL,酶标仪450 nm波长条件下读取OD值。以不加牛IgG的空白孔作为阴性对照。
1.3.4 包被抗体及酶标抗体工作质量浓度的确定
采用方阵法确定单抗包被质量浓度和酶标抗体质量浓度,将纯化后单抗按500、1 000、2 000、4 000 倍稀释,包被酶标板;将酶标抗体分别稀释至2 000、4 000、8 000、10 000 倍,选取阳性值(P值)1.0~1.5之间左右为最佳质量浓度条件。
1.3.5 样品稀释液的确定
按照最优条件进行操作,将稀释液为分为3 组:a.0.01% PBST;b.0.05% PBST;c.0.05% TBST,测定OD450 nm值并计算阳性值/阴性值(P/N值),选择P/N最大值对应的稀释液作为最佳稀释液。
1.3.6 封闭剂及封闭时间的确定
分别用0.1 mol/L氯化铵溶液、1%脱脂奶粉、1% OVA、1%冷水鱼明胶作为封闭剂,计算P/N值。选择最优封闭剂;封闭时间分别在设置37℃ 30、60、90、120 min,其余步骤按照夹心ELISA法,计算P/N值。
1.3.7 抗原及酶标抗体作用时间的确定
根据已确定的条件进行操作,分别设置抗原与抗体作用时间:37 ℃ 30、45、60、90 min;酶标抗体作用时间:37 ℃ 15、30、45、60 min,计算P/N值。
1.3.8 标准曲线的建立及灵敏度
将标准牛IgG连续稀释至7.8、15.625、31.25、62.5、125、250、500、1 000 ng/mL质量浓度,按优化后的双抗夹心ELISA方法,测定OD450 nm值。每个质量浓度设3 个平行。以标准品质量浓度值的对数为横坐标,OD值为纵坐标,采用Excel计算回归方程,绘制标准曲线,并根据结果计算最低检出限,即灵敏度。
1.3.9 精密度实验
采用优化后的双抗夹心ELISA方法,检测0.2 μg/mL标准牛IgG样品,同一批次选取不同孔重复10 次,计算标准差和变异系数,表示批内差异;逐批重复10 次,计算标准差和变异系数,表示批间差异。
1.3.10 加标回收率实验
取3 份同样的牛初乳样品,稀释106倍后,取1 mL,分别加入0.2 mg/mL标准牛IgG 0.5、1、2.5 μL,使终质量浓度分别为100、200、500 ng/mL,按优化后的方法测定,每个质量浓度做3 次重复,计算加标回收率。
1.3.11 实际样品检测
按优化的ELISA方法测定10 份牛初乳样品中IgG的含量。将样品稀释106倍后按优化后的方法测定后进行计算,每个样品重复3 次,结果以平均值表示。
2 结果与分析
2.1 单克隆抗体鉴定
经亚类鉴定试剂盒测定,单抗亚类为IgG1;纯化前单抗蛋白质量浓度为46.85 mg/mL,辛酸-硫酸铵法纯化后质量浓度为10.88 mg/mL,亲和层析纯化后质量浓度为2.21 mg/mL,两种方法纯化后效价均为2.56×106,将原腹水及辛酸-硫酸铵法、亲和层析两种纯化后的抗体进行SDS-PAGE电泳,结果如图1、2所示,可直接观察出纯化前腹水中杂蛋白较多,辛酸-硫酸铵法纯化后,可去除一部分杂蛋白,目的蛋白条带逐渐清晰,而亲和层析纯化法后,条带清晰,只有重链及轻链两部分,分别位于50、25 kD处,纯度较高,进一步测定亲和力常数为8.92×108L/mol。

图1 亲和层析纯化腹水Fig.1 Affinity chromatography of purified ascite

图2 腹水单抗纯化 SD S-P AG E凝胶电泳图Fig.2 SDS-PAGE gels electrophoresis of purified ascites
2.2 双抗夹心ELISA法的建立
2.2.1 包被单抗及酶标抗体质量浓度的确定
反应体系中此条件最为关键,优化方法采用方阵法,结果如表1所示,根据经验值OD值在1.0~1.5之间建立标准曲线比较合适,综合判断选择单抗稀释1 000 倍,酶标抗体稀释2 000 倍。

表1 包被单抗及酶标抗体质量浓度Table1 Coat in g c on centrati on s of McAb and diluti on of H RP-Ab
2.2.2 样品稀释液的确定
为降低空白值,提高准确性,故对稀释液进行优化,由图3可以看出,a组与b组P值相近,c组略低,但是b组与c组N值较低,且b组P/N值最大,因此确定0.05% PBST为样品稀释液。

图3 稀释液的确定Fig.3 Determination of the appropriate diluent
2.2.3 封闭剂及封闭时间的确定
在包被后,一般采用化学试剂或无关蛋白作为封闭剂,将酶标板未结合的位点进行封闭,减少非特异性吸附,提高灵敏度,本实验研究4 种封闭剂效果,结果如图4所示。由图4可以看出,0.1 mol/L氯化铵作为封闭剂时,P/N值最大,说明0.1 mol/L氯化铵封闭效果最佳。进一步研究氯化铵的封闭时间,结果如图5所示,可以看出,37 ℃、60 min为最佳封闭时间。
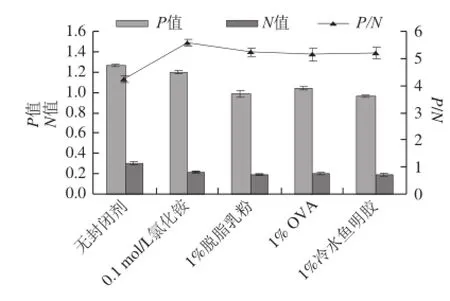
图4 封闭剂的确定Fig.4 Determination of sealant

图5 封闭时间的确定Fig.5 Determination of blocking time
2.2.4 抗原及酶标抗体作用时间的确定
不同反应时间其OD450 nm值相差较大,为提高灵敏度及重复性,需对抗原、酶标抗体反应时间进行优化,结果如图6所示,可以看出,抗原作用60 min时,P/N值最大,故抗原最佳作用时间为60 min;酶标抗体作用时间如图7所示,酶标抗体最佳作用时间为30 min。
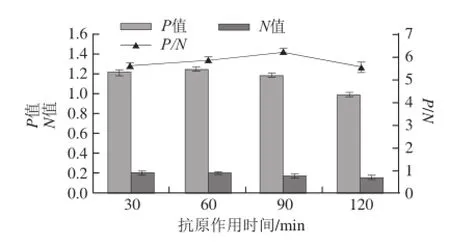
图6 抗原作用时间的确定Fig.6 Determination of antigen action time

图7 酶标抗体作用时间的确定Fig.7 Determination of reaction time of enzyme linked antibody
2.2.5 标准曲线及最低检出限实验结果
牛IgG在7.8~1 000 ng/mL范围内,OD值与牛IgG质量浓度的对数值呈良好的线性关系。经计算,回归方程为y = 0.470 3 lgx-0.158 2,相关系数R2= 0.992 6。随机选择20 个孔做空白孔检测,求出平均值和变异系数s,最低检出限为平均值加3 倍变异系数(+3s),经计算最低检出限为7.06 ng/mL。
2.2.6 精密度实验结果
对200 ng/mL标准牛IgG样品分别进行批内和批间重复检测,结果如表2所示,所建立的双抗夹心ELISA法,其批内检测平均值为197 ng/mL,变异系数为4.52%;批间检测平均值为205 ng/mL,变异系数为4.94%,精密度符合要求。

表2 批内与批间的变异系数Table 2 Intra-assay and in ter-assayC Vs
2.2.7 加标回收率实验结果
以100、200、500 ng/mL三个添加量测定样品中IgG含量及回收率,结果见表3,可以看出,牛初乳样品IgG含量为53.56 ng/mL,回收率为91.85%~102.45%,在80%~120%之间均在合理范围内;变异系数为3.30%~5.32%,均在10%以下。

表3 加标回收率测定结果Table 3 Results of spiked recovery
2.2.8 实际样品检测结果
按优化的ELISA方法测定10 份样品中牛IgG的含量,结果如表4所示。由于不同奶牛个体差异,所产牛初乳中IgG含量各不相同,IgG含量为50.29~79.68 mg/mL,平均值为65.40 mg/mL。

表4 牛初乳样品中IgG含量Table 4 C on centrati on s of bov in e IgG in colostrum samples
3 讨 论
牛初乳因含有大量的免疫球蛋白而备受关注,其检测方法不断发展,其中免疫学方法已成为主要的测定方法。其中免疫扩散法最为普遍,此方法是将样品或标准牛IgG滴加于含兔抗牛IgG抗体的琼脂板小孔中,经24 h扩散后,形成肉眼沉淀环,然后测量沉淀环的直径,在一定质量浓度范围内,牛IgG的含量与沉淀环的直径呈正比,该方法操作简便,设备要求低,结果直观,但由于扩散直径的测量误差较大,导致结果准确度和灵敏度都较低,检测效率低。我国保健食品中IgG的测定采用高效亲和色谱法,主要是借助于偶联Protein A或Protein G的亲和色谱柱进行定量,线性范围为0.2~1.0 mg/mL[19],准确度高,但操作相对繁琐。ELISA法具有特异性强、检测效率高等优点,适用于牛IgG的检测。在出口牛乳制品中IgG测定的标准中,采用间接竞争ELISA法,检测线性范围为0~51.2 mg/L[20],可满足目前国内牛初乳制品的质量要求,但是竞争法为两种抗原竞争有限抗体,故与夹心法存在一定差别。研究表明,对于分子质量较大的蛋白物质的测定,夹心ELISA比竞争ELISA灵敏度高,而夹心ELISA测定牛IgG时,需要两种抗体,即包被抗体和酶标抗体。若都采用同一动物来源的多克隆抗体,竞争表位,反应值低;若采用不同动物来源的抗体,易产生交叉反应,使背景值高,降低了方法的灵敏度。在夹心ELISA研究开发中,获得亲和力强、特异性好的配对抗体成为首要的技术步骤。单克隆抗体与多克隆抗体相比,具一定的优越性,具有特异性强、效价高、重复性好等优点。本研究制备特异性强的单克隆抗体,经纯化后纯度高,效价为2.56×106,亲和力常数为3.9×108L/mol,在107~1012范围内,属高亲和力抗体。另外,由于测定目标物质为牛初乳中IgG,封闭剂分为化学试剂或无关蛋白,在包被酶标板后,对酶标板未结合的位点进行封闭,减少非特异性结合,相对于化学试剂,蛋白试剂储存效果不好,而一般市面蛋白封闭剂,例如牛血清白蛋白等蛋白试剂可能残留IgG,如果采用进口试剂,成本较高,且实验结果显示氯化铵溶液封闭效果较好。
在此基础上,对ELISA反应体系中的抗体质量浓度、稀释液、封闭条件及反应时间等进行了优化,并对方法的准确性、精确性和适用性进行了评价。优化后的ELISA方法为:将单抗稀释1 000 倍在4 ℃过夜包被后,加0.1 mol/L氯化铵37 ℃封闭60 min,加样品后37 ℃反应60 min,加入2 000 倍稀释的酶标兔抗牛抗体后37 ℃反应30 min,最后加底物显色测值,此法回归方程为y= 0.470 3 lgx-0.158 2,R2= 0.992 6,在7.8~1 000 ng/mL范围内有良好的线性相关,最低检出限能达到7.06 ng/mL,加标回收率平均值为95.87%,变异系数低于10%,稳定性好。在实际检测中,奶牛在分娩后第一次分泌的乳汁牛初乳IgG最高,含量为50~100 mg/mL,然后将快速下降,1~2周后其含量基本与常乳一致[21-23],采用此研究方法分别检测10份牛初乳样品,IgG含量在为50.29~79.68 mg/mL。奶牛虽存在个体差异,但此牛场奶牛分娩3 d内所分泌的初乳能满足初乳制品加工要求。综合结果,本研究利用所获抗体,建立了双抗夹心ELISA方法,操作简便,结果灵敏度高、准确性好、重复性强,可用于牛初乳中IgG的检测。
[1] GAPPER L W, COPESTAKE D J, OTTER D E, et al.Analysis of bovine immunoglobulin G in milk, colostrums and dietary supplements: a review[J].Analytical and Bioanalytical Chemistry,2007, 389(1): 93-109.DOI:10.1007/s00216-007-1391-z.
[2] 徐丽, 生庆海, 王玉良, 等.牛初乳制品功能性成分的分析[J].中国乳品工业, 2004, 32(4): 18-20.DOI:10.3969/ j.issn.1001-2230.2004.04.005.
[3] GOMES V, MADUREIRA K M, SORINANO S, et al.Factors affecting immunoglobulin concentration in colostrum of healthy Holstein cows immediately after delivery[J].Pesquisa Veterinária Brasileira, 2011, 31(Suppl 1): 53-56.DOI:10.1590/S0100-736X2011001300009.
[4] MORETTI D B, NORDI W M, LIMA A L, et al.Lyophilized bovine colostrum as a source of immunoglobulins and insulin-like growth factor for newborn goat kids[J].Livestock Science, 2012, 145(1/2/3): 223-229.DOI:10.1016/j.livsci.2012.02.007.
[5] NEAVE H W, VICKERS L, VEIRA D M.Preparation of a highimmunoglobulin product from bovine colostrum[J].Animal Feed Science and Technology, 2013, 179(1/2/3/4): 133-137.DOI:10.1016/ j.anifeedsci.2012.11.007.
[6] QUIGLEY J D, LAGO A, CHAPMAN C E, et al.Evaluation of the Brix refractometer to estimate immunoglobulin G concentration in bovine colostrum[J].Journal of Dairy Science, 2013, 96(2): 1148-1155.DOI:10.3168/jds.2012-5823.
[7] GODDEN S, MCMARTIN S, FEIRTAG J, et al.Heat-treatment of bovine colostrum.Ⅱ Effects of heating duration on pathogen viability and immunoglobulin G[J].Journal of Dairy Science, 2006, 89(9): 3476-3483.DOI:10.3168/jds.S0022-0302(06)72386-4.
[8] DONAHUE M, GODDEN S M, BEY R, et al.Heat treatment of colostrum on commercial dairy farms decreases colostrum microbial counts while maintaining colostrum immunoglobulin G concentrations[J].Journal of Dairy Science, 2012, 95(5): 2697-2702.DOI:10.3168/jds.2011-5220.
[9] ABERNETHY G, OTTER D.Determination of immunoglobulin G in bovine colostrum and milk powders, and in dietary supplements of bovine origin by protein g affinity liquid chromatography: collaborative study[J].Journal of AOAC International, 2010, 93(2): 622-627.
[10] HOLLAND P T, CARGILL A, SELWOOD A L, et al.Determination of soluble immunoglobulin g in bovine colostrum products by protein g affinity chromatography-turbidity correction and method validation[J].Journal of Agricultural and Food Chemistry, 2001, 59(10): 5248-5256.DOI:10.1021/jf200839b.
[11] LEE S H, JAEKAL J, BAE C S, et al.Enzyme-linked immunosorbent assay, single radial immunodiffusion, and indirect methods for the detection of failure of transfer of passive immunity in dairy calves[J].Journal of Veterinary Internal Medicine, 2008, 22(1): 212-218.DOI:10.1111/j.1939-1676.2007.0013.x.
[12] TEIXEIRA A G V, BICALHO M L S, MACHADO V S, et al.Heat and ultraviolet light treatment of colostrum and hospital milk: effects on colostrum and hospital milk characteristics and calf health and growth parameters[J].The Veterinary Journal, 2013, 197(2): 175-181.DOI:10.1016/j.tvjl.2013.03.032.
[13] SOUSA S G, SANTOS M D, FIDALGO L G, et al.Effect of thermal pasteurisation and high-pressure processing on immunoglobulin content and lysozyme and lactoperoxidase activity in human colostrum[J].Food Chemistry, 2014, 151: 79-85.DOI:10.1016/ j.foodchem.2013.11.024.
[14] VERWEIJ J J, KOETS A P, EISENBERG S W F.Effect of continuous milking on immunoglobulin concentrations in bovine colostrum[J].Veterinary Immunology and Immunopathology, 2014, 160(3/4): 225-229.DOI:10.1016/j.vetimm.2014.05.008.
[15] GOSCH T, APPRICH S, KNEIFEL W, et al.A combination of microfiltration and high pressure treatment for the elimination of bacteria in bovine colostrum[J].International Dairy Journal, 2014,34(1): 41-46.DOI:10.1016/j.idairyj.2013.06.014.
[16] MILA H, FEUGIER A, GRELLETA, et al.Immunoglobulin G concentration in canine colostrum evaluation and variability[J].Journal of Reproductive Immunology, 2015, 112: 24-28.DOI:10.1016/ j.jri.2015.06.001.
[17] 任立松, 卢士英, 周玉, 等.柠檬黄色素免疫学检测方法的研究[J].食品科学, 2009, 30(12): 258-261.DOI:10.3321/ j.issn:1002-6630.2009.12.059.
[18] 张莹, 周玉, 李岩松, 等.抗κ-酪蛋白单克隆抗体的制备及其特性鉴定[J].中国畜牧兽医, 2014, 41(3): 24-27.
[19] 卫生部.GB/T 5009.194—2003 保健品中免疫球蛋白IgG的测定[S].北京: 中国标准出版社, 2003: 537-542.
[20] 国家质量监督检验检疫总局.SN/T 3132—2012 出口牛乳制品中牛免疫球蛋白G的测定: 酶联免疫法[S].北京: 中国标准出版社,2012.
[21] CONESA C, LAVILLA M, SANCHEZ L, et al.Determination of IgG levels in bovine bulk milk samples from different regions of Spain[J].European Food Research and Technology, 2005, 220(2): 222-225.DOI:10.1007/s00217-004-1016-0.
[22] ABDEL-SALAMA Z, GHANY S H, HARITH M A.Evaluation of immunoglobulins in bovine colostrum using laser induced fluorescence[J].Talanta, 2014, 129: 15-19.DOI:10.1016/ j.talanta.2014.04.033.
[23] 马燕芬, 陈志伟, 魏晓兵, 等.高效液相色谱法测定牛初乳中IgG含量的方法研究[J].饲料工业, 2007, 28(5): 33-38.DOI:10.3969/ j.issn.1001-991X.2007.05.010.
Development of Double Antibody Sandwich ELISA for Detection of Bovine Colostrum Immunoglobulin G
LIU Jin1, WANG Liwei1,2, YUE Xiqing1,*
(1.College of Food Science, Shenyang Agricultural University, Shenyang 110866, China;2.College of Science, Liaoning Technology University, Fuxin 123000, China)
The hybridoma cells secreting monoclonal antibody (McAb) against bovine colostrum immunoglobulin G (IgG)were developed by cell fusion technology after immunization of BALB/c mice with bovine IgG.McAbs were obtained by purification of mouse ascites.A double antibody sandwich enzyme-linked immunosorbent assay (ELISA) technique was established for the detection of bovine colostrum IgG.The linear range was 7.8-1 000 ng/mL and the limit of detection (LOD)was 7.06 ng/mL.The intra-assay and inter-assay coefficient of variations were 4.52% and 4.94%, respectively.The recovery rate was 91.85%-102.45%.The ELISA method can provide a simple, accurate and stabile approach for the rapid detection of bovine colostrum IgG.
bovine colostrum; immunoglobulin G (IgG); monoclonal antibody; sandwich ELISA
10.7506/spkx1002-6630-201614013
TS252.7
A
1002-6630(2016)14-0074-06
刘金, 王丽威, 岳喜庆.牛初乳中免疫球蛋白G双抗夹心ELISA检测方法的建立[J].食品科学, 2016, 37(14): 74-79.
DOI:10.7506/spkx1002-6630-201614013. http://www.spkx.net.cn
LIU Jin, WANG Liwei, YUE Xiqing.Development of double antibody sandwich elisa for detection of bovine colostrum immunoglobulin G[J].Food Science, 2016, 37(14): 74-79.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201614013. http://www.spkx.net.cn
2015-10-03
2011年度国家星火计划项目(2011GA650001)
刘金(1991—),女,硕士研究生,研究方向为动物性产品加工。E-mail:liujin911216@163.com
*通信作者:岳喜庆(1966—),男,教授,博士,研究方向为动物性产品加工。E-mail:yxqsyau@126.com
