新生大鼠肠神经嵴干细胞的体外培养和鉴定
2016-08-04刘远梅高明娟
尚 卿,刘远梅,高明娟
(1.河南省新乡市中心医院 普通外科,河南 新乡 453003;2.遵义医学院附属医院 小儿普胸泌外科,贵州 遵义 563099)
技术与方法
新生大鼠肠神经嵴干细胞的体外培养和鉴定
尚卿1,刘远梅2,高明娟2
(1.河南省新乡市中心医院 普通外科,河南 新乡453003;2.遵义医学院附属医院 小儿普胸泌外科,贵州 遵义563099)
[摘要]目的 探索体外分离培养新生大鼠肠神经嵴干细胞(ENCSCs)的方法,观察肠神经嵴干细胞神经球(NLBs)的原代及分化情况。方法 取新生SD大鼠,无菌环境下解剖分离从小肠至直肠的肠管,胰酶消化成单细胞悬液后,接种于培养瓶行原代培养,并传代;传到第3代时,加入分化培养基进行分化培养。观察ENCSCs原代培养及分化培养的情况,免疫荧光染色观察NLBs巢蛋白(nestin)的表达以及分化后ENCSCsHuD蛋白、胶质纤维酸性蛋白(GFAP)的表达情况。结果 ENCSCs原代培养第1天,可见细胞贴壁成长,第2天,贴壁细胞减少,出现大量悬浮的细胞团,第4天,悬浮细胞团增大,形成体积稍小的NLBs,7 d后,大量NLBs漂浮于培养液中。未分化的NLBs行免疫荧光染色可见nestin阳性表达;NLBs分化后贴壁的细胞可见HuD、GFAP阳性表达。结论 新生大鼠肠道可提取出ENCSCs,培育出ENCSCs神经球,并能够分化成神经元和神经胶质细胞。
[关键词]肠神经嵴干细胞;细胞培养;细胞分化
肠道的运动由肠神经系统(enteric nervous system,ENS)控制,其所有神经元和神经胶质细胞均起源于神经嵴干细胞(neural crest stem cell,NCSCs),各种原因引起的神经嵴干细胞迁移、增殖和分化异常,均会造成肠神经元解剖和功能异常,可导致先天性巨结肠(Hirschsprung’s disease,HD)发生。目前国外研究较多的是胚胎肠神经嵴干细胞(enteric neural crest stem cells,ENCSCs)的分离培养、诱导分化和移植,但是胚胎ENCSCs的提取存在伦理学上的争议,以及异体干细胞移植所带来的免疫排斥反应,因此,成体ENCSCs的体外研究将为以后的移植试验带来新的契机。本研究通过细胞培养和免疫荧光染色方法观察新生大鼠肠道ENCSCs的分离培养、诱导分化以及增殖情况,检测NLBs的nestin及分化后贴壁细胞的HuD蛋白、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的表达,探讨成体ENCSCs体外增殖、分化的特性,为移植治疗巨结肠提供可靠的供体细胞。
1材料与方法
1.1实验动物选用出生24 h内的SD大鼠,由第三军医大学大坪医院医学实验动物中心提供的成年健康未经产雌鼠所产。本实验设计符合动物保护条例并经遵义医学院动物保护委员会批准。
1.2主要试剂ENCSCs完全培养基:每100 mL DMEM/F12培养基(美国Hyclone公司)含B27添加剂2 mL,β巯基乙醇5 μmol(美国Gibco公司),重组人碱性成纤维细胞生长因子(bFGF)2 μg,表皮生长因子(EGF)2 μg(美国peprotech公司),青链霉素各10 000 U(北京索莱宝科技有限公司);ENCSCs分化培养基:90 mL完全培养基加10 mL胎牛血清(美国Hyclone公司)混合。胰酶(北京索莱宝科技有限公司),一抗小鼠抗鼠HuD多克隆抗体、兔抗鼠Nestin多克隆抗体、兔抗鼠GFAP多克隆抗体(美国Santa Cruz公司),二抗FITC标记的山羊抗小鼠抗体、FITC标记的山羊抗兔二抗(美国Proteintech Group公司),DAPI荧光染料(瑞士Roche公司)。
1.3试验方法
1.3.1提取ENCSCs进行原代培养于无菌环境中,取一窝新生24 h内的乳鼠,取出从小肠至直肠的全部肠管组织,剪碎、胰酶分别消化2次后,取得肠管组织细胞悬浮液,调整细胞浓度为1×106个/mL后接种至25 cm培养瓶,置于37 ℃,5%CO2水平培养箱中行原代培养;孵育24 h后,3/4量换液,之后每2天半量换液1次,观察记录ENCSCs的生成神经球(NLBs)的情况并及时传代,传至3代进行Nestin免疫荧光染色。
1.3.2进行ENCSCs的分化培养将传至第3代的NLBs接种于35 mm细胞培养皿,添加分化培养基1 mL,置于37 ℃,5%CO2水平培养箱中行分化培养,每2天半量换液1次,观察记录分化细胞生长情况,待细胞长满皿底后行HuD、GFAP免疫荧光染色。
2结果
2.1ENCSCs的原代培养及分化培养原代培养第1天,可见不同形态的贴壁细胞,大量悬浮死细胞及细胞碎片,培养基浑浊(见图1A);第2天,贴壁细胞数量减少,可见许多由几个或十几个细胞组成的细胞团悬浮,体积小,形态不规则,培养瓶底可见大量细胞碎片(见图1B);第4~5天时,细胞团增大,形态规则,成球状,经多次换液后,瓶底较之前清晰(见图1C);至第7天时,可见培养液中大量NBLs形成,呈悬浮生长(见图1D、E)。添加分化培养基后1 d,NLBs开始贴壁,可见单个细胞从NLBs中爬出呈贴壁生长,至第7天,NLBs基本消失,贴壁细胞基本长满培养皿,呈单层细胞生长,细胞形态多样。

A:原代第1天(×100);B:原代第2天(×100);C:原代第4天(×100);D:原代第7天(×40);E:原代第7天(×400)。图1 ENCSCs经原代培养后不同时间段的镜下观察结果
2.2NLBs的nestin以及分化后的HuD、GFAP免疫荧光染色结果可见NLBs细胞核呈明亮的蓝色荧光(DAPI染色),nestin表达阳性,呈黄绿色荧光,提示存在神经干细胞(见图2)。分化后的贴壁细胞经HuD、GFAP免疫荧光染色后,镜下见分化后的贴壁细胞HuD、GFAP阳性表达,呈黄绿色荧光、DPAI染色呈蓝色荧光(见图3~4)。
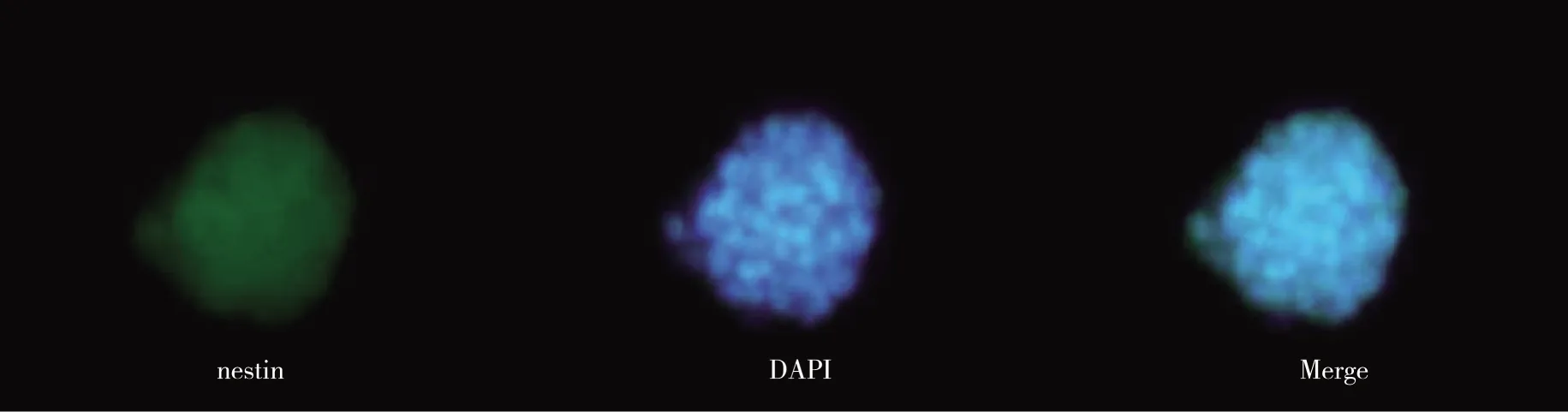
图2 NLBs的nestin免疫荧光染色结果(×200)
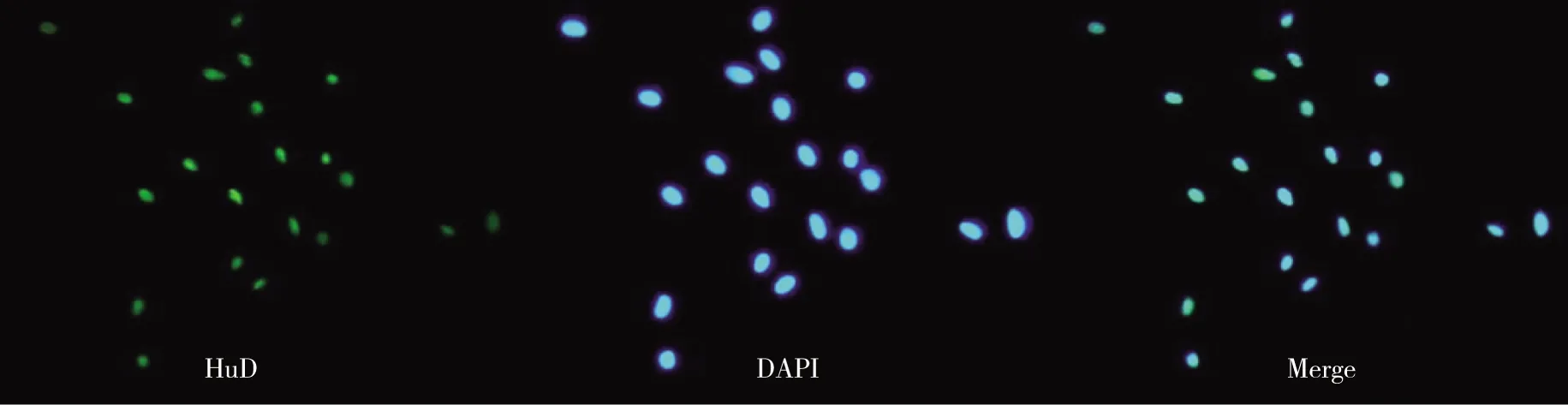
图3 NBLs分化后的HuD免疫荧光染色结果(×200)
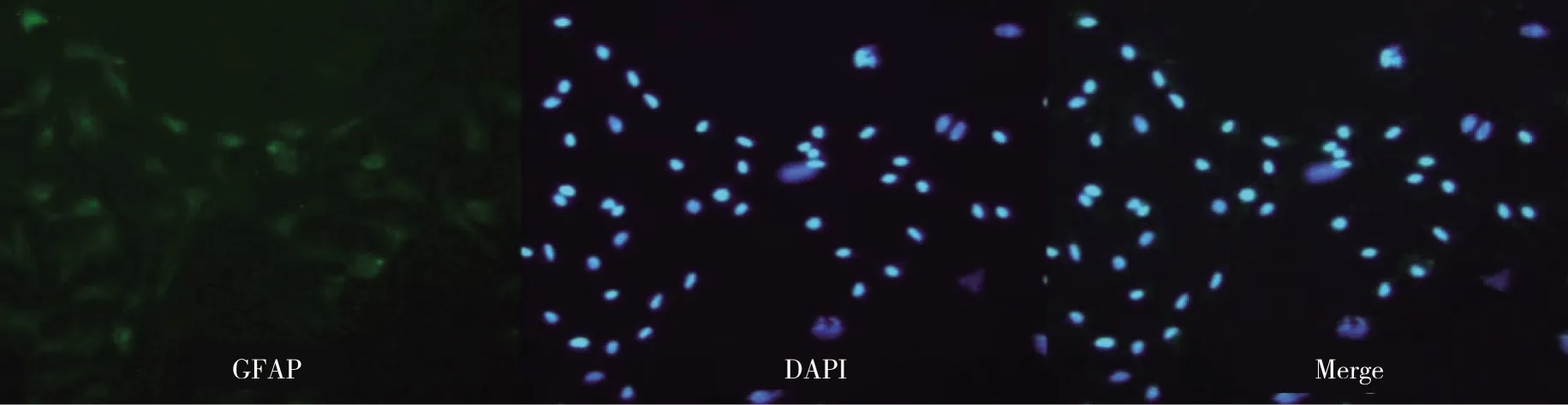
图4 NBLs分化后的GFAP免疫荧光染色结果(×200)
3讨论
人体胃肠道受到中枢神经系统(central nervous system,CNS)和肠神经系统(enteric nervous system,ENS)共同支配,虽然后者受到前者的调控,但肠神经系统存在独立的反射弧,具有神经元信号整合功能,可直接接受胃肠道内的各种信息,并调控胃肠道功能,可以说是一个相对独立的神经系统,同时,消化道壁内的神经细胞数量仅次于大脑,因此,肠神经系统也被称作肠脑。肠神经系统包含胃肠道的黏膜下神经丛和肠肌间神经丛的神经节细胞、中间连结纤维以及神经丛发出供应胃肠道平滑肌、腺体和血管的神经纤维,这些神经元细胞及神经胶质细胞均起源于ENCSCs。胚胎第5周开始神经管原ENCSCs通过迷走神经由口端向尾端迁徙,约第12周时完成迁徙,最后定居于全部肠道,形成肠神经系统的主要组成部分[1]。因此,各种因素导致ENCSCs的迁徙、分化和存活障碍,均会造成肠神经系统的功能异常[2]。
现今,国内外学者已对ENCSCs进行了大量的研究,李仲荣等[3]利用神经干细胞特异性标志来研究ENCSCs的增殖、凋亡、迁徙和分化特性,证实了大鼠胚胎肠管培养出的ENCSCs移植到同种幼鼠的结肠和幽门基层后能够存活,并向四周迁移的同时分化成神经细胞和神经胶质细胞,肖莉等[4]依据神经干细胞经典培养法,联合应用特殊培养基和连续传代法成功地进行了小鼠胚胎及成体小鼠ENCSCs的体外分离培养及鉴定,且证明均能在体外分化成肠神经系统中的细胞类型,Lindley等[5]从胚胎鼠及巨结肠患儿肠管中分离出ENCSCs并移植入无神经节胚胎鼠肠管,发现移植细胞能够协调肠环形肌层钙离子活动、并部分恢复肠管的收缩性,Metzger等[6-7]也从80岁老人肠管分离出ENCSCs,并分化为具有肠神经系统特征的神经元及其亚型和神经胶质细胞,Azan等[8]和张建军等[9]的实验分别证实了成人和HD患儿正常肠黏膜下层存在可以修复外周神经系统肠神经干细胞,甚至可以从肠黏膜活检标本中分离、体外培养肠神经干细胞。这些方法都为ENCSCs移植治疗HD提供了可靠的理论基础,因此将ENCSCs移植到神经元发育缺陷肠段,通过干细胞在肠壁内迁移、分化、增殖,恢复正常肠神经系统和神经元的结构和功能,达到根治HD的目的,可能是一种理想的方法。
神经干细胞标记物nestin是一种中间丝状蛋白(神经巢蛋白),是早期胚胎神经上皮干细胞和神经干细胞的特异性生物学标记物[10],到目前为止,大多数研究仍然用nestin阳性作为神经干细胞的标记。有研究表明HuD的表达可以加速胚胎19d大鼠表皮神经元的轴突生长[11],而HuD缺陷小鼠则表现出胚胎脑神经发育障碍,提取了这种小鼠的脑组织培养出的神经球,其分化成神经元的数量明显小于正常小鼠[12],这证明HuD在神经元的发育过程中发挥重要作用,此外,林中等[13]的研究发现HuD可以较明显的标记出豚鼠肠肌间神经节细胞,表明HuD完全可以作为肠道神经元的标记物。GFAP是一种酸性蛋白,属细胞骨骼蛋白,以中间微丝蛋白和可溶性蛋白两种形式存在于胶质细胞胞质中,被认为是星形胶质细胞的特异性标记物[14],常被用于神经胶质细胞的标记。
本实验通过提取出生24 h内的新生鼠肠管组织,体外培养形成NLBs,且表达神经干细胞标记物nestin,表明我们所培养的细胞有一定的干细胞特性,与此同时,我们对该NLBs进行了分化诱导,通过免疫荧光染色发现,分化后的细胞内HuD蛋白、GFAP表达阳性,说明新生鼠肠管组织可以提取出ENCSCs并于体外分化为肠神经系统的细胞类型,这为我们以后移植治疗巨结肠动物模型提供了可靠的供体。
但是,本研究我们只单纯检测了nestin的表达,若要完全证实神经嵴干细胞的存在,尚需检测多种神经干细胞不同时期的标记物。此外由于取材部位的广泛,即使经过培养基的选择作用以及反复传代后的纯化,仍然无法保证培育出的NLBs的纯度。Becker等[15]对鼠类肌层和粘膜层分别取材培养出来的NLBs进行比较,无论从大小、生长速度、神经干细胞标记物表达含量上,肌层均明显优于粘膜层,而Binder等[16]通过流式细胞仪技术在小鼠和人身上提取出肠神经嵴干细胞及非肠神经嵴干细胞,再对这两类细胞进行体外培养后发现,两者形成NLBs的形态、大小无明显差异,而且nestin染色均为阳性,但前者p75、Sox100(均为神经干细胞标记物)表达阳性,后者却表达阴性,这也进一步说明取材不同,培育出的NLBs存在本质的差别。同时Hotta等[17]的实验还证明,纯的ENCSCs移植进入宿主肠管后,不仅能够迁移分化,而且还可以与宿主ENS整合到一起,更有利于ENS功能的发挥。可以看出纯的ENCSCs的分离培养为移植治疗HD提供了一种新的研究方向,也为我们今后的实验提供了着手点,可以相信,对ENCSCs的深入研究将给未来完全治愈HD带来可能。
[参考文献]
[1] 施成仁,金先庆,李忠智.小儿外科学[M]. 北京:人民卫生出版社,2009:312-314.
[2] 高明娟,刘远梅. 肠神经嵴干细胞移植治疗巨结肠的研究现状[J]. 遵义医学院学报,2013,36(1):97-100.
[3] 李仲荣,朱利斌,刘征,等. 大鼠肠神经干细胞同种消化道移植的实验研究[J]. 中华小儿外科杂志,2007,28(7):366-369.
[4] 肖莉,刘勇,高亚.小鼠胚胎肠神经嵴干细胞的分离培养及鉴定[J].西安交通大学学报:医学版,2007,28(5):595-597.
[5] Lindley R M,Hawcutt D B,Connell M G,et al. Human and mouse enteric nervous system neurosphere transplants regulate the function of aganglionieemhryonic distal colon[J].Gastroenterology,2008,135(1):205-216.
[6] Metzger M,Caldwell C,Barlow A J,et al. Enteric nervous system stem cells derived from human gut mucosa for the treatment of aganglionic gut disorders[J]. Gastroenterology,2009,136(7):2214-2225.
[7] Metzger M,Bareiss P M,Dankcr T,et al. Expansion and differentiation of neural progenitors derived from the human adult enteric nervous system[J].Gastroenterology,2009,137(6):2063-2073.
[8] Azan G,Low W C,Wendelschafer-Crabb G,et a1. Evidence for neural progenitor cells in the human adult enteric nervous system[J]. Cell Tissue Res,2011,344(2):217-225.
[9] 张建军,郑百俊,高亚,等.先天性巨结肠患儿切除肠管肠黏膜ENS干细胞的初步鉴定[J].中华小儿外科杂志,2011,32(8):558-572.
[10] Holmin S,Von Gertten C,Sandberg-Nordqvist A C,et al. Induction of astrocytic nestin expression by depolarization in rats[J].Neurosci Lett,2001,314(3):151-155.
[11] Anderson K. D,Sengupta J,Morin M,et al. Overexpression of HuD accelerates neurite outgrowth and increases GAP-43 mRNA expression in cortical neurons and retinoic acid-induced embryonic stem cells in vitro[J]. Exp Neurol,2001,168(2):250-258.
[12] Akamatsu W,Fujihara H,Mitsuhashi T,et al. The RNA-binding protein HuD regulates neuronal cell identity and maturation[J]. Proc Natl Acad Sci USA,2005,102(12):4625-4630.
[13] 林中,胡宏镇,Jackie D Wood. Hu蛋白作为豚鼠小肠肌间丛神经元标志物的研究[J].基础医学与临床,2002,22(3):257-260.
[14] Gomes F C,Paulin D,Moura Neto V. Glial fibrillary acidiprotein(GFAP):modulation by growth factors and its implication in astroeyte differentiation[J]. Braz J Med Biol Res,1999,32(5):619-631.
[15] Becker L,Kulkarni S,Tiwari G,et al. Divergent fate and origin of neurosphere-like bodies from different layers of the gut[J]. Am J Physiol Gastrointest Liver Physiol,2012,302(9):958-965.
[16] Binder E , Natarajan D , Cooper J ,et al. Enteric neurospheres are not specific to neural crest cultures:Implications for neural stem cell therapies[J]. Plos One,2015,10(3):e0119467.
[17] Hotta R,Stamp L A,Foong J P,et al. Transplanted progenitors generate functional enteric neurons in the postnatal colon[J]. J Clin Invest,2013,123(3):1182-1191.
[收稿2016-03-24;修回2016-04-20]
(编辑:王福军)
[基金项目]贵州省科科学技术基金资助项目(NO:黔科合J字[2012]2364)。
[通信作者]刘远梅,女,主任医师,硕士生导师,研究方向:先天性肛门直肠畸形及先天性巨结肠,E-mail:yuanmei116@aliyun.com。
[中图法分类号]R656.9
[文献标志码]A
[文章编号]1000-2715(2016)03-0314-05
Culture and identify enteric neural crest stem cells from neonatal rats in vitro
ShangQing1,LiuYuanmei2,GaoMingjuan2
(1.Department of General Surgery,Xinxiang Central Hospital,Xinxiang Henan 453003,China;2.Department of Pediatric General,Thoracic and Urinary Surgery,Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China)
[Abstract]Objective To explore the method of ENCSCs’culture invitro,observe the primary culture cells and the differentiated cells.Methods Gut tissues of the neonatal rats within 24 h after birth were collected, digested into single cell suspension by trypsin, and transfered into culture bottles for primary cultures,subcultures and differentiation cultures at the 3rd generations.Observed and recorded the each period of cells, the expression of nestin in NLBs and the expression of HuD protein,GFAP in ENCSCs after differentiation was examined through immunofluorescence(IF) staining.Results The primary cultures: few cells attached to the bottom on the first day; the adherent cells were decreased and small cell clusters suspension formed on the second day; the suspension cell clusters increased in size and formed little NLBs after 4 days;a large number of NLBs floating in the medium at 1 week.The immunofluorescence staining: positive expression of nestin in NLBs and positive expression of Hud and GFAP in differentiated cells.Conclusion The intestine of postnatal rats could be used to extract ENCSCs successfully,and generate NLBs in vitro,which could differentiate into neurons and glial cells.
[Key words]enteric neural crest stemcells;cell culture;cell differentiation
