体外培养条件下不同氧浓度对几种细胞生长的影响
2015-04-09李璟等
李璟等

摘 要 观察多级氧浓度对体外培养条件下小鼠原代骨髓基质细胞、小鼠3T3-L1前脂细胞及大鼠BRL肝细胞生长的影响,探究不同类型细胞体外增殖的最佳O2体积分数以及对低氧和高氧耐受力的差异.实验结果显示,在10%~18%O2范围内骨髓基质细胞增殖最快、活力最强,而3T3-L1前脂细胞及BRL肝细胞生长的最适O2体积分数为5%.O2浓度过低严重损害这几种细胞在培养下的生存能力,O2浓度过高有致死性毒性作用.这些结果表明,原代与长期传代细胞最佳生长的适宜氧浓度有一定的差异,对低氧和高氧的耐受力也强弱不同.
关键词 氧浓度;细胞培养;增殖;细胞活力
中图分类号 Q256 文献标识码 A 文章编号 1000-2537(2014)06-0013-06
Abstract The effects of various oxygen concentrations on population growth of mouse bone-marrow primary stromal cells, murine 3T3-L1 preadipocytes and rat BRL hepatocytes during the 48 h-culture period were examined in order to explore the optimal oxygen concentration and difference in tolerance limits to hypoxia and hyperoxia for cell proliferation in vitro. The results show that the primary stromal cells had the highest proliferative activity and greatest viability at oxygen concentrations of 10% and 18%, while 3T3-L1 preadipocytes and rat BRL hepatocytes did at oxygen concentration of 5%. Too low oxygen greatly impaired survival of these cell types, and too high oxygen exerted lethal toxicity on them. These data suggest that the primary cells and the immortal cell lines require different concentrations of oxygen for their optimal growth, and they have different tolerance limits to hypoxia and hyperoxia as well.
Key words oxygen concentration; cell culture; proliferation; cell viability
氧是细胞生存的必要条件之一,也是细胞生物学行为和生理功能的一种重要调节因子[1-2].细胞在体外培养下的生存和生长也必须有适宜的氧浓度,细胞培养本身又是研究氧生物学作用的重要方法.然而,多种细胞体外培养所需的最适氧浓度还不确定,不同氧浓度对细胞的作用及其机制尚不完全清楚.细胞的类型和机能状态、技术条件等因素都可影响细胞对氧浓度变化的反应[3-5].本文利用作者所在实验室建立的细胞体外培养的一种新方法,研究不同氧浓度对几种原代和传代细胞生长的影响,为体外细胞培养最适氧体积分数的选择和与氧相关细胞病理及生理的深入研究提供参考.
1 材料与方法
1.1 实验动物和细胞系
昆明种小鼠,雌雄不限,4周龄,体重18~22 g,购于中南大学实验动物学部;小鼠前脂细胞3T3-L1系和大鼠肝细胞BRL系分别由本院心脏发育研究室和衰老生物化学研究室惠赠.
1.2 主要试剂
DMEM培养基为Invitrogen-Gibco公司产品,胎牛血清(FBS)购自杭州四季青生物公司,二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)和胰蛋白酶(typsin)为Sigma产品.
13 方法
1.3.1 骨髓基质细胞的原代培养 颈椎脱臼法处死小鼠,无菌条件下分离出股骨和胫骨,用DMEM培养液冲出骨髓.依次用6、5、4号针头吸打冲出的骨髓,制成单细胞悬液,作有核细胞计数.骨髓有核细胞于20%(体积分数)FBS的DMEM培养液中,以1×107/mL的细胞密度种入12.5 cm2培养瓶,每瓶3 mL,在37 ℃、5%CO2、饱和湿度下培养.48h后吸出上悬液中未贴壁细胞,将贴壁细胞用于不同氧浓度条件下的培养实验.
1.3.2 MSC集落形成实验 取上述小鼠骨髓单细胞悬液,调有核细胞密度为2×106/mL,接种于12.5 cm2培养瓶,每瓶3 mL,培养基和培养环境条件同前.48 h后换液,采用本研究室所创培养器皿内定量混配气体的抽气-注气法(专利申报中),在培养瓶中配制不同体积分数的6组混合气体:1%O2、5%O2、10%O2、18%O2(标准CO2培养箱内O2体积分数)、30%O2、95%O2组.细胞培养至第9天,Wright-Giemsa 染色.光镜下计数间充质干细胞(mesenchymal stem cell, MSC)集落个数(≥10个成纤维样细胞的聚合计为1个集落),点析分法测算平均集落面积.
1.3.3 小鼠3T3-L1细胞系和大鼠BRL肝细胞系的传代培养 将冻存于液氮的3T3-L1细胞和BRL肝细胞复苏,种入12.5 cm2培养瓶,在上述培养基和培养环境中培养,每3 d换液,细胞贴壁生长接近融合状态时,用胰蛋白酶消化法作分瓶传代.获得足够细胞时,取60%左右融合状态的细胞,做不同氧浓度条件下的培养实验.
1.3.4 不同氧浓度培养条件下的细胞培养 将上述骨髓基质细胞、3T3-L1细胞和BRL肝细胞分为6个组进行培养,各组气相培养环境的CO2体积分数、培养基和温度同前.
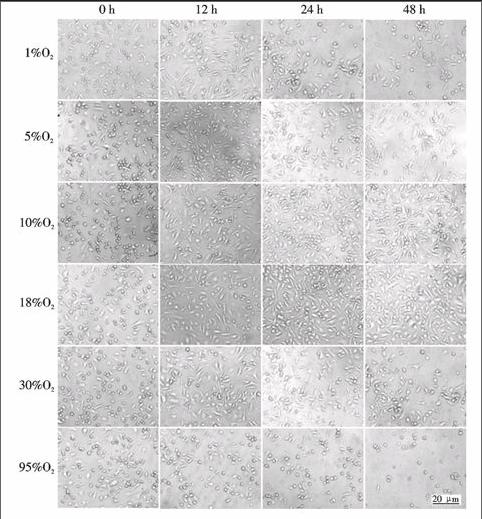
1.3.5 骨髓基质细胞培养中实时观察和拍照 在骨髓基质细胞受不同氧浓度处理前(0 h)和处理后12、24、48 h,于倒置显微镜下观察细胞生长状态并拍照.
1.3.6 细胞计数 各组细胞培养48 h后,胰蛋白酶消化法收获贴壁细胞,用细胞计数板进行计数,算出每培养瓶的细胞总数.
1.3.7 MTT比色法 用胰蛋白酶消化法收取培养48 h的各氧浓度组细胞,每一12.5 cm2培养瓶均收获2 mL细胞悬液,将细胞悬液加入96孔板,0.5 mL/孔,每孔加入5 g/L的MTT溶液20 μL孵育4 h,吸弃悬液,每孔再加入150 μL二甲基亚砜(DMSO),避光轻轻振荡15 min.用酶联免疫检测仪测取各孔的490 nm吸光值.
1.3.8 统计学处理 所有数据均以平均值±标准差(±s)表示,组间比较采用方差分析和LSD-t检验,检验水准α=0.05.用SPSS 13.0软件做统计分析,SigmaPlot软件作图.
2 结果
2.1 不同氧体积分数下骨髓基质细胞的形态学变化
各组小鼠骨髓基质细胞在48 h培养过程中的形态学变化如图1所示.18%O2组细胞贴壁生长状态最好,细胞伸展较长较宽,胞体明亮;随时间延长,细胞数量增加.在O2体积分数小于18%的3个组,细胞形态与18%O2组基本相同,但随氧浓度降低和培养时间延长,细胞伸展的长度和宽度略为变小,细胞亮度渐见减低.10%O2组细胞数量逐渐增加,但增速略小于18%O2组;5%O2和1%O2组的细胞数逐渐减少,且1%O2组的细胞数目减少较快.在O2体积分数大于18%的两个组中,30%O2组细胞形态的变化与小于18%O2组相似,细胞数量渐见减少;而95%O2组细胞随培养时间延长较快地变圆,数量快速减少,培养至24 h,只观察到少数细胞沉于瓶底及漂浮在悬液中,至48 h,视野中的细胞所剩无几.
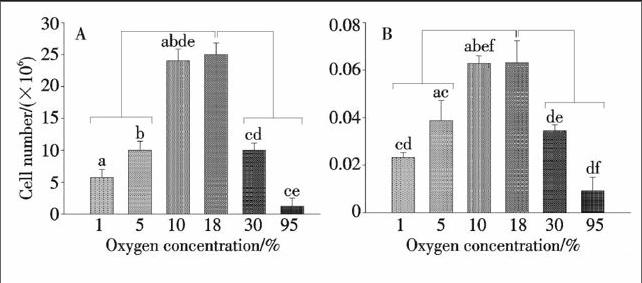
2.2 不同氧体积分数对骨髓基质细胞体外增殖和活力的影响
注:柱上方的连线表示18%O2组与其余各组之间的差异有统计学显著性;柱上方标记相同字母表示对应两组间的差异有统计学显著性,下同.
各组小鼠骨髓基质细胞在培养48 h后,18%O2组细胞计数最多、MTT试验吸光值最高.与18%O2组比,10%O2组的细胞计数和MTT试验吸光值无明显差异.5%O2和1%O2组的细胞计数和MTT试验吸光值均显著低于18%O2组和10%O2组;1%O2组的细胞计数和MTT试验指标比5%O2组更低,两组之间的差异也有显著性意义.与18%O2组或10%O2组比,30%O2和95%O2组的细胞计数和MTT试验吸光值都显著减低,95%O2组减低程度更大,30%O2组与95%O2组之间的差异也有显著性(图2).
2.3 不同氧体积分数对MSC集落形成的影响
如表1、图3所示,18%O2组的小鼠骨髓MSC集落形成率高于其余组,而10%O2组的MSC平均集落面积高于其余组;18%O2组与10%O2组之间,这两项实验指标无明显差异.与18%O2组或10%O2组比,5%O2组和1%O2组的集落形成率均显著减低,1%O2组的集落形成率还显著低于5%O2组;O2体积分数低于10%后,平均集落面积随O2体积分数降低而减小,但无统计学显著性.30%O2组的集落形成率显著低于18%O2组或10%O2组;平均集落面积也减小,但没有显著性意义.95%O2组无集落生成.
2.4 不同氧体积分数对3T3-L1细胞体外增殖和活力的影响
培养48 h后,5%O2组的3T3-L1细胞计数最多、MTT试验吸光值最高.其余各组与5%O2组的细胞计数和MTT试验吸光值差异均有显著性.在10%、18%、30%和95%组,随O2体积分数递增,3T3-L1细胞数递减,两两组间差异均有显著性意义;MTT试验吸光值也随O2体积分数递增而递减,10%O2组与30%O2组、30%O2组与95%O2组、95%O2组与其余3组之间的差异具有显著性(图4).
2.5 不同氧体积分数对大鼠BRL肝细胞体外增殖和活力的影响
培养48 h后,各组BRL肝细胞增殖和活力状况与3T3-L1细胞相似,5%O2组的细胞计数和MTT试验吸光值高于其余各组;与5%O2组比,除1%O2组细胞数的减少无统计学意义外,其余指标的差异均有显著性.在10%、18%、30%和95%O2组,BRL肝细胞的计数值和MTT试验吸光值都随O2体积分数递增而递减,95%O2组与其余3组之间的细胞数差异具有显著性,两两组间的MTT试验吸光值差异均有显著性意义(图5).
3 讨论
人和哺乳动物细胞体外培养的气相环境条件一般是恒温37 ℃,含5%~10%CO2及饱和水蒸汽的空气[6].在细胞培养实验领域,人们普遍将标准CO2培养箱内空气的O2体积分数作为细胞培养气相环境的正常或常规氧体积分数,简称常氧(normoxia).低于和高于常氧的氧浓度分别称为低氧(hypoxia)和高氧(hyperoxia)[2].氧条件变化对培养细胞的影响已有大量研究,其中主要是低氧研究.由于现有技术条件及费用的限制,实验中设置的氧条件往往较少,很少在同一培养实验中研究低氧和高氧对细胞的影响[7].本工作应用所在研究室所创培养器皿内建立气相条件的新方法,观察多个氧条件对不同类型细胞体外增殖的影响.其中,18%O2为培养箱内温度37 ℃、CO2体积分数5%条件下的氧体积分数(本实验所用CO2培养箱为Forma 3110型,氧传感器实测O2体积分数显示(17.6±5)%).需要说明的是,很多文献称标准CO2培养箱内的氧体积分数是21%,或认为是19.95%;前者即空气中的氧体积分数,后者是考虑到培养箱气相空间内CO2占了5%的体积.但后者还忽略了培养箱内的饱和水蒸汽,如37 ℃的一个大气压气相空间,饱和水蒸汽的体积分数约为6%.因此,在普通CO2培养箱内温度为37 ℃、CO2为5%的条件下,较精确的O2体积分数为187%,或约为18%[8].
近年来,人们对细胞培养的“常氧”提出了疑问,因为在这种条件下细胞周围培养基的氧条件与正常组织中不符.平均而言,正常人体和哺乳动物组织中的氧体积分数约为5%(PO2 40 mmHg),远低于常氧培养条件下细胞周围的氧浓度.而且,组织中不同区间或不同类型细胞微环境的氧条件又有差异.例如骨髓内干细胞微环境的氧体积分数测定值,在间充质干细胞壁龛中为2%~8%,在造血干细胞壁龛中为1%~6%[2].由此可知,在机体生理稳态下不同类型细胞具有自身微环境的氧条件.有人新造了生理氧(physioxia)这一术语,以区别于常氧.掌握体外培养下各种细胞相应的最适氧条件,对细胞培养技术、氧相关细胞生理和病理的研究都至关重要.
本实验选择小鼠骨髓基质细胞(MSCs)、小鼠3T3-L1前脂细胞及大鼠BRL肝细胞为受试对象,除了用原代细胞和长期传代细胞作比较研究之外,还考虑了在组织内骨髓基质细胞一般处于分裂休止或停滞状态下耗氧率较低; 3T3-L1细胞与骨髓基质细胞同属间充质谱系;肝细胞的代谢活跃,耗氧率较高[9].实验结果显示,这几种细胞最佳生长的适宜氧体积分数有明显差异.在10%~18%O2下,骨髓基质细胞的活力最强、增殖最快;而对于3T3-L1细胞系及大鼠BRL肝细胞系,生长的最适氧条件为5%.当氧条件显著低于或高于各种细胞相应的最适水平时,细胞的生长乃至存活受到不利的影响.
低氧培养对本实验所用几种细胞的影响已有一些研究.徐承熊等[10]较早报道在5%O2下小鼠骨髓基质集落形成细胞(CFU-F)形成率显著增高.最近,Berniakovich等[11]的研究显示,3%O2促进小鼠骨髓基质细胞的体外增殖和集落形成.此外,Valorani等[12]在2%O2条件下培养小鼠脂肪组织MSCs,观察到增殖速率高于常氧条件.而且,不少研究者报道低氧有利于人骨髓MSCs的生长,也有研究显示低氧对大鼠、绵羊、家兔MSCs具有促增殖作用[13-14].然而,有两个研究组分别报告,低氧通过影响细胞周期运行而抑制人MSCs的体外增殖[15-16].近来,Chung等[17]的实验结果表明,在5%和1%O2的培养条件下,狗骨髓和脂肪组织MSCs的增殖都受到负性影响.至今,尚未见低氧培养抑制小鼠MSCs生长的研究报道.本研究的培养实时观察、细胞计数、MTT比色测定和MSC集落形成实验结果表明,在≤5%O2的培养条件下,小鼠骨髓基质细胞的增殖抑制.低氧对细胞生长的影响有不一致的实验结果,与多种因素有关,细胞本身的差异可能是重要的原因.本研究的结果表明,与5%O2培养条件相比,3T3-L1前脂细胞及BRL肝细胞在1%O2条件下的细胞活力减低和增殖抑制.与这一结果不同,Macfarlane等[18]的实验显示,3T3-L1细胞系在5%O2培养条件下即发生生长抑制.Yin等[19]则报告1%O2培养导致3T3-L1细胞坏死和凋亡.关于培养体系中氧浓度降低对肝细胞活力和生长的影响,不同实验室的研究结果也不一致[20-21].
高氧对本实验所用几种细胞影响的研究报道甚少.据迄今为止的文献检索,尚无骨髓基质细胞在高氧下培养的研究,一个密切相关的动物实验是Gomez等[22]将2月龄雌性小鼠暴露于高压氧(2.8 atm)或常压纯氧,每天90 min,连续5 d之后,骨髓CFU-F形成率显著高于对照组.关于高氧培养对肝细胞存活和生长的影响,几个研究组分别报道了正性或负性结果[23-24].不过,在这几组实验中,高氧水平、压强和处理时间等实验条件不尽相同.这些因素与细胞高氧暴露效应差异的相关性也见于其他类型细胞的培养研究[25].目前,还未见高氧对3T3-L1前脂细胞影响的研究报道.在本研究中,小鼠骨髓基质细胞在30%O2条件下培养48 h后大量死亡,95%O2下培养48 h后几乎无细胞存活;肝细胞系BRL和前脂细胞系3T3-L1在10%~ 95%O2条件下培养48 h后,细胞数随氧浓度增加而不断减少.这与以往多种细胞的高氧培养研究结果一致,过高浓度氧的长时间暴露对细胞具有严重的损害和毒性作用.
参考文献:
[1] CARREAU A, EL HAFNY-RAHBI B, MATEJUK A, et al. Why is the partial oxygen pressure of human tissues a crucial parameter? Small molecules and hypoxia[J]. J Cell Mol Med, 2011,15(6):1239-1253.
[2] MOHYELDIN A, GARZN-MUVDI T, QUIONES-HINOJOSA A. Oxygen in stem cell biology: a critical component of the stem cell niche[J]. Cell Stem Cell, 2010,7(2):150-161.
[3] SALLER M M, PRALL W C, DOCHEVA D, et al. Increased stemness and migration of human mesenchymal stem cells in hypoxia is associated with altered integrin expression[J]. Biochem Biophys Res Commun, 2012,423(2):379-385.
[4] KARLSEN T A, MIRTAHERI P, SHAHDADFAR A, et al. Effect of three-dimensional culture and incubator gas concentration on phenotype and differentiation capability of human mesenchymal stem cells[J]. J Cell Biochem, 2011,112(2):684-693.
[5] OLIVEIRA P H, BOURA J S, ABECASIS M M, et al. Impact of hypoxia and long-term cultivation on the genomic stability and mitochondrial performance of ex vivo expanded human stem/stromal cells[J]. Stem Cell Res, 2012,9(3):225-236.
[6] 王芳妹,杨子剑,韩 梅,等.阿司匹林对人慢性粒细胞白血病细胞株K562的生长抑制作用[J].湖南师范大学自然科学学报, 2013,36(5):75-80.
[7] NISHIKAWA M, UCHINO J, MATSUSHITA M, et al. Optimal oxygen tension conditions for functioning cultured hepatocytes in vitro[J]. Artif Organs, 1996,20(2):169-177.
[8] MATHER J P, ROBERTS P E. Introduction to cell and tissue culture: theory and technique[M]. New York: Plenum Press, 1998.
[9] BALIS U J, BEHNIA K, AWARAKANATH B, et al. Oxygen consumption characteristics of porcine hepatocytes[J]. Metab Eng, 1999,1(1):49-62.
[10] 徐承熊,韩 锐. 培养条件对小鼠骨髓基质集落形成细胞在体外生长的影响[J]. 中国医学科学院学报, 1990,12(4):257-261.
[11] BERNIAKOVICH I, GIORGIO M. Low oxygen tension maintains multipotency, whereas normoxia increases differentiation of mouse bone marrow stromal cells[J]. Int J Mol Sci, 2013,14(1):2119-2134.
[12] VALORANI M G, GERMANI A, OTTO W R, et al. Hypoxia increases Sca-1/CD44 co-expression in murine mesenchymal stem cells and enhances their adipogenic differentiation potential[J]. Cell Tissue Res, 2010,341(1):111-120.
[13] HUNG S P, HO J H, SHIH Y R, et al. Hypoxia promotes proliferation and osteogenic differentiation potentials of human mesenchymal stem cells[J]. J Orthop Res, 2012,30(2):260-266.
[14] FU W L, JIA Z Q, WANG W P, et al. Proliferation and apoptosis property of mesenchymal stem cells derived from peripheral blood under the culture conditions of hypoxia and serum deprivation[J]. Chin Med J (Engl), 2011,124(23):3959-3967.
[15] ZENG H L, ZHONG Q, QIN Y L, et al. Hypoxia-mimetic agents inhibit proliferation and alter the morphology of human umbilical cord-derived mesenchymal stem cells[J]. BMC Cell Biol, 2011,12:32.
[16] HOLZWARTH C, VAEGLER M, GIESEKE F, et al. Low physiologic oxygen tensions reduce proliferation and differentiation of human multipotent mesenchymal stromal cells[J]. BMC Cell Biol, 2010,11:11.
[17] CHUNG D J, HAYASHI K, TOUPADAKIS C A, et al. Osteogenic proliferation and differentiation of canine bone marrow and adipose tissue derived mesenchymal stromal cells and the influence of hypoxia[J]. Res Vet Sci, 2012,92(1):66-75.
[18] MACFARLANE C M. In vitro influence of sublethal hypoxia on differentiation of the 3T3-L1 preadipose cell line and its physiological implications[J]. Life Sci, 1997,60(21):1923-1931.
[19] YIN J, GAO Z, HE Q, et al. Role of hypoxia in obesity-induced disorders of glucose and lipid metabolism in adipose tissue[J]. Am J Physiol Endocrinol Metab, 2009,296(2):E333-342.
[20] LILLEGARD J B, FISHER J E, NEDREDAL G, et al. Normal atmospheric oxygen tension and the use of antioxidants improve hepatocyte spheroid viability and function[J]. J Cell Physiol, 2011,226(11):2987-2996.
[21] SULEIMAN S A, STEVENS J B. The effect of oxygen tension on rat hepatocytes in short-term culture[J]. In Vitro Cell Dev Biol, 1987,23(5):332-338.
[22] GOMEZ C R, KNUTSON G J, CLIFTON K B, et al. Age-dependent response of murine female bone marrow cells to hyperbaric oxygen[J]. Biogerontology, 2012,13(3):287-297.
[23] FARISS M W. Oxygen toxicity: unique cytoprotective properties of vitamin E succinate in hepatocytes[J]. Free Radic Biol Med, 1990,9(4):333-343.
[24] MIZUGUCHI T, OSHIMA H, IMAIZUMI H, et al. Hyperbaric oxygen stimulates cell proliferation and normalizes multidrug resistance protein-2 protein localization in primary rat hepatocytes[J]. Wound Repair Regen, 2005,13(6):551-557.
[25] CONCONI M T, BAIBUERA S, GUIDOLIN D, et al. Effects of hyperbaric oxygen on proliferative and apoptotic activities and reactive oxygen species generation in mouse fibroblast 3T3/J2 cell line[J]. J Investig Med, 2003,51(4):227-232.
(编辑 王 健)
