经皮肾镜经腹膜后途经治疗重症急性胰腺炎胰周感染
2016-08-01徐涛唐才喜谢智钦冯斌赵志坚
徐涛,唐才喜,谢智钦,冯斌,赵志坚
·经验交流·
经皮肾镜经腹膜后途经治疗重症急性胰腺炎胰周感染
徐涛,唐才喜,谢智钦,冯斌,赵志坚
(株洲市中心医院 肝胆胰外科,湖南 株洲 412007)
[摘 要]目的 总结经皮肾镜经腹膜后途经对重症急性胰腺炎(SAP)胰周感染的治疗体会。方法 回顾性分析我科从2014年2月至2015年8月收治的SAP患者,收集患者一般资料、病因、感染部位、手术后住院时间、引流液培养结果、预后结果等。结果 25例SAP患者中有8例为SAP并发胰周感染,其中5例行经皮肾镜经腹膜后途经行胰腺坏死感染组织清除和引流术,其中行1次肾镜手术2例,2次肾镜手术3例。术后平均住院时间为30 d(21~38 d),5例患者恢复良好,感染得到控制,脓肿得到有效引流,随访无死亡病例。结论 在恰当的时机选择经皮肾镜经腹膜后途经治疗SAP并胰周感染是有效的、安全的,但仍需大样本研究来提供更高质量的证据。
[关键词]经皮肾镜;腹膜后途经;重症胰腺炎;胰周感染
重症急性胰腺炎(severe acute pancreatitis,SAP)是一种可导致多器官、多系统功能障碍或衰竭的严重疾病,其病死率高达20%[1]。SAP死亡的主要原因之一是后期继发胰腺或胰周感染(secondary pancreatic infection,SPI),SPI包括3种类型,即感染性胰腺坏死、胰周脓肿和胰腺假性囊肿并感染,总发生率在15%~50%,通常见于SAP发病后2~3周,是SAP的第2个死亡高峰期,如不进行干预治疗,病死率几乎为100%[2]。传统的干预治疗方法是开腹手术,进行坏死组织清除术及术后冲洗引流,手术效果确切,但同时存在创伤大、患者无法耐受手术打击而加重病情等并发症[3]。近年来,各种微创手术方式不断出现,成为解决这一问题的新的有效途径[4-5]。其中,经皮肾镜经腹膜后途径行胰腺坏死感染组织清除和引流术是一项新兴且相对成熟的技术,手术并发症少,对患者创伤小,可取得较好的临床效果。2014年2月至2015年8月,我科采用该方法治疗SPI患者共5例,均取得较好的疗效,现总结报道如下。
1 资料和方法
1.1 一般资料
2014年2月至2015年8月我科共收治SAP患者25例,其中SAP并SPI 8例。其中男5例,女3例,年龄平均为41.4(22~62)岁,行APACHE I I评分平均为15.1(10~20)分。所有患者均于发病后3~4周开始出现发热等感染症状,白细胞计数(18.3×109~36.4×109/L)及中性粒细胞分类(87.4%~96.8%)明显升高,均行全腹增强CT证实为胰腺坏死组织呈蜂窝样改变并胰周渗出液积聚,其中7例并腹腔积液。其中5例行经皮肾镜经腹膜后途经行胰腺坏死感染组织清除和引流术,5例中胆石性2例,酒精性1例,高脂性2例。5例患者均有不同程度的肾功能衰竭。
在5例患者中,均行超声或CT引导下经皮经腹腔或腹膜后穿刺置管引流术,2例行ERCP胆总管取石术及鼻胆管引流术。5例患者行经皮肾镜经腹膜后途经胰腺坏死感染组织清除和引流术时间为发病后5~12周。胰腺坏死范围为40%~80%,且均合并胰周坏死组织感染表现。患者具体临床特征、手术次数、细菌培养结果及住院时间见表1。
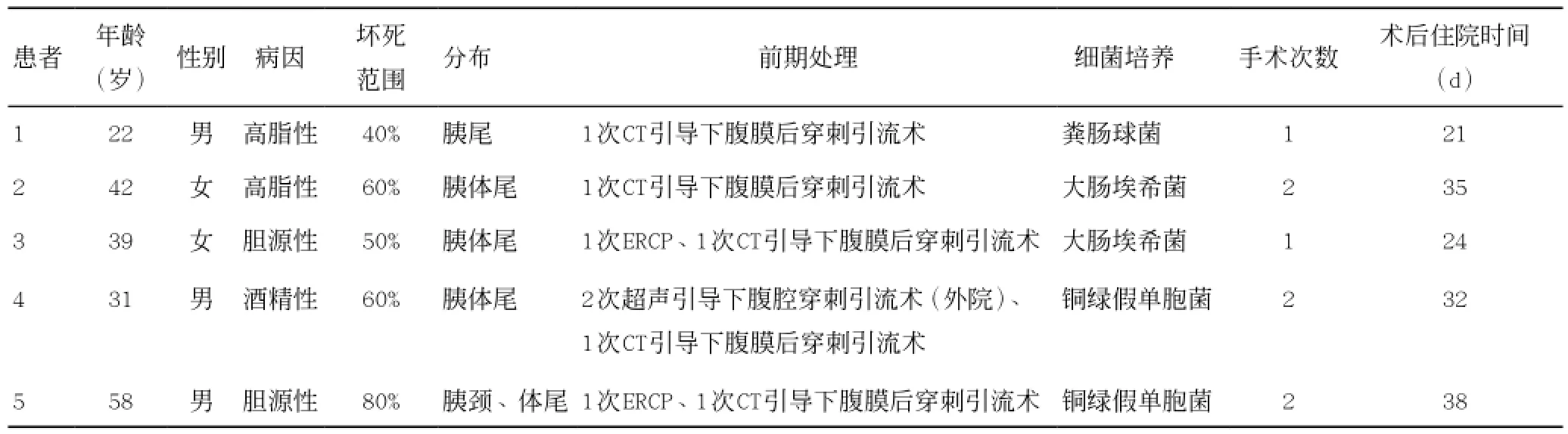
表1 患者临床特征
1.2 术前评估和麻醉方式
术前行全腹增强CT检查以明确胰腺坏死部位、范围,胰周组织感染及腹腔积液情况。术前均对患者行抗感染、纠正内环境紊乱及营养支持等内科治疗。经皮穿刺引流术采用局麻,经皮肾镜手术采用全麻下进行,以备迅速处理术中出血、临近脏器损伤等严重并发症。
1.3 手术方式
首先,在CT引导下行经皮经腹膜后途经穿刺置管引流术。CT下观察胰周病变的情况,定位穿刺点,采用18 G COOK公司PTC针穿刺脓腔,穿刺到位后拔出针芯,抽吸脓液,然后放入硬泥鳅导丝,拔出穿刺针,顺导丝使用COOK公司扩条扩张孔道后,放入16 F 或18 F引流管,冲洗引流脓液2~4周后重新评价CT,感染加重或无明显好转行经皮肾镜经腹膜后途径胰腺坏死感染组织清除和引流术。
肾镜手术采用平卧位,左侧身体稍抬高10°~15°,插入硬泥鳅导丝,拔出引流管,沿窦道切开皮肤1.5 cm左右,使用COOK公司扩张条逐渐扩张窦道至30 F,顺窦道放置26 F硅胶管,冲洗脓液。然后,沿窦道插入肾镜,低压冲洗,脓液吸尽后,使用抓钳从外向内钳夹坏死组织。局部脓腔清理基本干净,停止清创,检查手术视野,确定无活动性出血后,顺窦道放置双腔引流管。术中钳取坏死组织及脓液送细菌学培养。
1.4 术后管理
术后冲洗和保持通畅引流至关重要,予专人管理。冲洗液选择生理盐水,用量在3~6 L,持续冲洗。因首次肾镜手术时胰腺坏死组织清除通常不彻底(为防止术中出血),后续冲洗时可有大块坏死组织脱落,导致引流管堵塞,必要时及时更换引流管。术后根据患者感染症状、引流液情况、以及腹部CT情况综合评估引流效果。术后首次CT通常选择在手术后1~2周。如患者感染症状无好转或再次加重,引流效果不佳,或CT提示坏死感染范围无缩小或有所扩大,可再次行肾镜下坏死组织清除术。如患者感染症状有效控制,引流液持续变为清亮,CT下可见脓腔明显缩小,可逐渐更换较细的引流管,直至拔管。
2 结果
2.1 疗效
本组5例患者中行1次肾镜手术2例,2次肾镜手术3例。所有患者术后感染症状得到有效控制,白细胞计数(8.2×109~12.3×109/L)及中性粒细胞分类(62.3%~78.6%)明显下降或达到正常,一般情况均明显好转。术后复查CT表明胰周感染情况较手术前明显好转(图1)。术后平均住院时间为30 d。
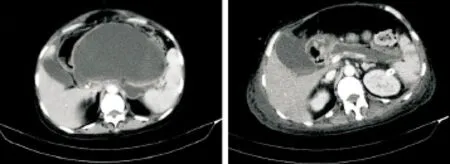
A:术前胰腺和胰周液体积聚,可见蜂窝样坏死组织,正常胰腺组织很少;B:术后胰周积液和坏死组织明显较少,胰腺轮廓有所恢复,可见胰腺组织,腹膜后引流管影图1 手术前后胰腺及胰周CT扫描情况
2.2 术后并发症和随访
所有患者术后均未出现手术部位出血、消化道瘘等近期并发症。患者出院后按手术后1、3、6及12个月的时间返院复查腹部CT。所有患者恢复均良好,未出现假性囊肿等并发症。
3 讨论
SAP后期继发胰周感染(SPI)是SAP最严重的并发症之一,主要原因是肠黏膜屏障功能障碍引起肠道细菌移位,在胰周坏死组织中大量繁殖而导致。临床表现常有发热、腹痛加重、腹部包块、白细胞及中性粒细胞分类升高,腹部CT可见胰腺周围呈蜂窝样改变或胰周液体积聚或有气泡存在,行腹部超声或CT引导下经皮穿刺胰腺坏死组织,将穿刺物送细菌涂片或细菌培养可有助于确诊。有效的治疗方法是及时清除感染坏死组织并进行彻底的通畅引流。目前国内外常用的手术方法为开腹坏死组织清除和术后持续冲洗引流,然而,开腹手术创伤大,会给患者造成新的打击,可加重病情,导致术后并发症多、病死率高的结局[3,6]。
近年来,随着微创理念迅速渗透到外科领域和微创技术的发展,各种单纯置管引流的方法及微创坏死组织清除技术不断出现。超声或CT引导下单纯置管引流术是临床上常用且患者易于接受的方法,但是,由于胰腺坏死组织中常存在块状组织不易液化,导致引流管堵塞,引流不通畅,该方法有效率仅约30%[7]。微创坏死组织清除技术目前常用的有腹腔镜技术、窦道内镜技术和经皮肾镜技术。因为胰腺是腹膜后器官,急性胰腺炎时大量含胰酶的渗液主要向腹膜后间隙蔓延,导致广泛的脂肪坏死和感染。这就为经皮肾镜经腹膜途经行胰腺坏死感染组织清除和引流术提供了理论依据。该技术首次报道于2000年[8],在国内尚属于起步阶段,目前仅有少数几家单位的肝胆外科或普外科有报道[9-10]。我科室2014年2月至2015年8月成功使用该技术完成5例SAP合并SPI的治疗,术后患者腹腔感染症状明显好转,疗效确切,可明显缩短住院时间。经皮肾镜经腹膜后途经手术存在创伤小、感染局限在腹膜后不易扩散、引流效果好、手术易于重复等优点,经过总结,我们具体有以下几点体会。
3.1 适应证和手术时机
SAP以胰腺体尾部坏死为主,胰酶渗出和坏死感染组织大部分局限在腹膜后的患者。如患者无继发感染表现,单纯无菌性坏死以内科保守治疗为佳。一旦患者出现感染症状,经腹部CT、经皮穿刺细菌学检测确诊后,需考虑外科干预。对于SAP患者,传统方法是开腹行胆囊、胆道手术及胰腺坏死组织清除术,但该方法创伤大、死亡率极高。我们的经验是在患者发病早期尽快行ERCP内镜取石术,待后期出现继发胰周感染后再行经皮肾镜微创手术。虽然患者经历多次手术,但总体创伤小,恢复快,且符合疾病本身的病程发展变化。
根据本研究经验及国内研究表明[11],手术时机多考虑在发病后3~4周,此时患者基本已渡过急性炎症和多器官功能衰竭期,病情相对平稳,坏死组织开始局限包裹,这将有助于减少术中发生出血、胃肠道瘘等并发症的几率。结合患者临床表现和腹部CT,如怀疑坏死胰腺和胰周组织合并感染,即可行CT引导下经腹膜后PTC针穿刺,如抽出脓液可确诊并进行细菌培养、药敏实验指导治疗,同时行置管引流术。经皮肾镜手术一般在经皮穿刺置管引流术后2~4周进行,此时已形成较好的窦道,有利于肾镜的插入。如单纯引流不通畅、感染症状控制欠佳、或更换管径更大的引流管后仍无法改善时,即可考虑经皮肾镜手术。
3.2 术中注意要点
在插入肾镜前,先让脓液自行流出,然后可插入26 F硅胶管冲洗吸引脓液,这可降低脓腔内压力,且有利于肾镜插入时视野的观察。插入肾镜后需注入CO2气体,保持腹腔气压低于1.33 kPa(10 mmHg),整个手术过程中采用间断的低压冲洗,低压操作有助于减少术后脓毒血症的发生。为减少术中出血,手术中钳取坏死组织时,动作要轻柔,以钳取已脱落坏死组织为主,如钳取时遇到阻力,可轻柔松动,仍未脱落可待再次手术予以处理。钳取过程中间断冲洗,有利于坏死组织脱落和保持视野清晰。如术中发生少量渗血,可暂停操作,予以观察,一般很快可止血。如出血量较大,可行肾镜下喷凝止血术。本组有1例患者在首次肾镜手术时出现了术中出血,量中等,灭菌用水冲洗确定出血部位后,立即行喷凝止血术,效果好。
3.3 术后管理
术后管理专人负责。通常我们放置14 F和26 F双腔引流管,14 F硅胶管用于冲洗,26 F硅胶管为引流管。每天用3~6 L生理盐水持续冲洗,如有较大块坏死脱落组织堵塞引流管,需及时拔出引流管,清洗疏通后可再次放回,必要时可更换引流管。注意观察引流液性状、颜色等,并做观察记录。
本组5例患者术后1~2周首次复查腹部CT,同时密切观察患者发热、血常规等感染表现。如患者发热好转、白细胞及中性粒细胞分类下降、引流液逐渐变清亮,以及CT见脓腔明显缩小,可逐渐更换较细的引流管,直至拔管。如患者持续发热,或体温下降后再次升高,白细胞无明显下降,引流不畅,或CT提示坏死感染范围无缩小或有新的脓腔出现,可再次行肾镜下坏死组织清除术。
3.4 缺点
对于SAP坏死组织以胰头或胰体为主,主要坏死感染组织位于腹腔内,无法从腹膜后途经进行操作者,该手术不适合。且因该手术局限在腹膜后,无法同时处理胃肠系统和胆道系统疾病。另外,因肾镜操作孔径有限,每次清除坏死组织量较小,对于坏死感染组织范围大且有多个脓腔的病例,手术时间较长,有时需多次手术。
综上所述,从我们目前的经验来看,选择合适的病例,在恰当的时机,进行经肾镜经腹膜后途经胰腺坏死感染组织清创引流术,同时结合内科综合治疗、经皮穿刺置管引流术和ERCP等微创技术,可让SAP继发胰周感染的患者在创伤小和恢复快的情况下获得良好的疗效。由于我们的病例数较少,尚缺乏较大数量的病例研究,对手术适应证和相关并发症仍需要进一步的探索和评价。
参考文献:
[1] MAHESHWARI R, SUBRAMANIAN R M. Severe acute pancreatitis and necrotizing pancreatitis [J]. Criti care Clin,2016, 32(2): 279-290.
[2] ZEREM E. Treatment of severe acute pancreatitis and its complications [J]. World J Gastroenterol, 2014, 20(38): 13879-13892.
[3] VAN SANTVOORT H C, BAKKER O J, BOLLEN T L, et al. A conservative and minimally invasive approach to necrotizing pancreatitis improves outcome [J]. Gastroenterology,2011, 141(4): 1254-1263.
[4] PANNALA R, ROSS A S. Pancreatic endotherapy and necrosectomy [J]. Curr Treat Options Gastroenterol, 2015, 13(2): 185-197.
[5] HART P A, BARON T H. What is the role of noninvasive treatment for infected pancreatic necrosis: Still an unanswered question [J]. Gastroenterol, 2013, 144(7): 1574-1575.
[6] KOSTKA R, HAVLUJ J. [acute necrotizing pancreatitis: Traditional laparotomy vs. Minimally invasive procedures] [J]. Rozhl Chir, 2015, 94(4): 160-165.
[7] VAN BAAL M C, VAN SANTVOORT H C, BOLLEN T L,et al. Systematic review of percutaneous catheter drainage as primary treatment for necrotizing pancreatitis [J]. Br J Surg,2011, 98(1): 18-27.
[8] CARTER C R, MCKAY C J, IMRIE C W. Pereutaneous necrosectomy and sinus tract endoscopy in management of infected pancreatic necrosis: an initial experience [J]. Ann Surg,2000, 232(2): 175-180.
[9] 蔡守旺, 刘志伟, 黄志强, 等. 腹膜后入路经皮肾镜下感染性胰腺坏死的治疗 [J]. 中华肝胆外科杂志, 2010, 16(8): 597-599.
[10] 李强, 蒋奎荣, 卫积书, 等. 经皮肾镜微创技术治疗坏死感染性胰腺炎 [J]. 南京医科大学学报自然科学版, 2013, 33 (11): 1631-1634.
[11] 刘大晟, 罗羽宏, 李接兴. 重症急性胰腺炎早期手术与延期手术治疗效果Meta分析 [J]. 肝胆胰外科杂志, 2014, 26(4): 289-292.
(本文编辑:鲁翠涛)
[中图分类号]R657.5
[文献标识码]B
Doi:10.11952/j.issn.1007-1954.2016.04.012
[收稿日期]2016-01-04
[第一作者简介]徐涛(1981-),男,湖南株洲人,主治医师。
[通讯作者简介]唐才喜,主任医师,教授,E-mail:tcx0826@163.com。
