PEG-CAT改善门静脉高压症全身高动力循环的实验探索
2016-08-01何越施丹丽秦骏罗蒙
何越,施丹丽,秦骏,罗蒙
·论著 基础研究·
PEG-CAT改善门静脉高压症全身高动力循环的实验探索
何越1,施丹丽2,秦骏1,罗蒙3
(1.上海交通大学医学院附属仁济医院 普通外科,上海 200011;2.上海交通大学医学院附属第三人民医院 普通外科,上海 201999;3.上海交通大学医学院附属第九人民医院 普通外科,上海 200127)
[摘 要]目的 研究聚乙二醇过氧化氢酶(polyethylene glycol-catalase,PEG-CAT)对肝硬化门静脉高压症大鼠脏器血流动力学的影响,并探明活性氧产物在肝硬化门静脉高压症治疗中的作用。方法 实验分为正常大鼠(正常组,共6只)、CCl4诱导的肝硬化门静脉高压症大鼠(门静脉高压组,共7只)以及PEG-CAT处理的门静脉高压症大鼠(PEG-CAT组,共6只)。采用插管法测动脉及门静脉压力,彩色微球法检测心出量及内脏器官血流变化,过氧化氢检测试剂盒检测小肠及肠系膜过氧化氢含量变化,并用Western blotting测小肠及肠系膜血管形成标志物VEGF、VEGFR2及CD31蛋白表达。结果 (1)门静脉压力:与正常组比,门静脉高压组和PEG-CAT组明显升高(P<0.05),但后两组差异无统计学意义(P>0.05);(2)脏器血流:与正常组比,除胰腺及结肠血流无明显差别外(P>0.05),实验组其他各内脏血流均显著升高(P<0.05),PEGCAT干预则能显著降低上述各内脏血流量;(3)过氧化氢含量:与正常组比,门静脉高压组小肠及肠系膜中过氧化氢含量显著升高(P<0.05),在PEG-CAT干预后其含量显著降低(P<0.05),但与正常组比无统计学差异(P>0.05);(4)使用PEG-CAT降低组织过氧化氢含量后,VEGF、VEGFR2及CD31三种蛋白表达均显著降低(P<0.05)。结论 CCl4致肝硬化门静脉高压症大鼠小肠及肠系膜过氧化氢含量增高,从而导致VEGF、VEGFR2及CD31蛋白表达增加及门静脉血流阻力减少和血流量增加。PEG-CAT干预虽不能降低门静脉压力,但可显著降低门静脉血流量。这一实验结果肯定了过氧化氢在肝硬化门静脉高压症内脏高血液动力状态形成中的作用,并为以降低内脏组织过氧化氢含量为宗旨的肝硬化门静脉高压症临床治疗提供了初步实验依据。
[关键词]肝硬化;高血压,门静脉;过氧化氢;大鼠
肝硬化门静脉高压症为多种慢性肝脏疾病病程的终末阶段[1],表现为肝内肝脏结构紊乱假小叶形成,肝窦受到压迫致血液流通受阻[2];肝外则为全身高动力循环、门静脉血流流入增多从而导致压力升高。慢性肝脏疾病患者体内出现门静脉高压症状后,则极易出现胃底-食管静脉曲张破裂出血、腹水等并发症,严重危害患者生命安全及生活质量[3]。因此减缓甚至逆转门静脉高压症的发展从而减少相关并发症的发生一直是这一领域的研究重点。
许多研究表明,肝硬化门静脉高压症机体内氧化应激水平是增高的,通过使用NADPH抑制剂抑制活性氧的产生或直接使活性氧产物降解为无活性物质可显著降低门静脉压力[4-6],证明过高的氧化应激产物含量与门静脉高压症的病理变化有关;但这些研究对于活性氧的定量标准值得商榷,且未能探明其潜在机制,使将这些研究结果应用到临床实际治疗中的可能大大减少。在本实验中,我们探索通过改善肝外高动力循环从而降低门静脉压力作为未来控制门静脉高压症发生的可能性;同时,通过使用过氧化氢抑制剂—聚乙二醇过氧化氢酶(polyethylene glycol-catalase,PEG-CAT),进一步阐明活性氧作用于门静脉高压症全身高动力循环的潜在机制及作用靶点。现报道如下。
1 材料和方法
1.1 动物和试剂
体重为350~400 g雄性SD大鼠19只,购自上海交通大学医学院实验动物中心。过氧化氢抑制剂聚乙二醇过氧化氢酶(PEG-CAT),美国Sigma公司。兔抗VEGF多克隆抗体、兔抗VEGFR2多克隆抗体、兔抗CD31多克隆抗体以及GAPDH内参抗体均购自美国Sant Cruz公司。抗兔抗体,美国Cell Signaling Technology公司。血溶血试剂(blood hemolysis reagent,BHR)由无水乙醇与10% Triton X-100溶液以1∶5的比例配置。碱性消化试剂(alkaline digestion reagent,ADR)由每112.22 g氢氧化钾溶于2 L蒸馏水配制而成。酸化乙醇试剂(acidified ethanol reagent,AE)由37%浓度盐酸与无水乙醇以1∶500的比例混合而得。彩色微球,加拿大圣地亚哥Triton Technologies公司。微球悬浮溶液(microsphere carrier solution,MCS;10%吐温80与生理盐水以1∶200的比例混合)的配置均按照Triton Technologies公司给出的步骤配置。
1.2 动物模型制备与分组
将SD大鼠分为3组。(1)正常组:6只,生理盐水2 mL/kg皮下注射,每周2次,共14周。(2)门静脉高压组:7只,采用CCl4皮下注射法诱导肝硬化门静脉高压症模型[7],50% CCl4玉米油溶液2 mL/kg皮下注射,每周2次,共14周,同时自第8周起饮5%乙醇至14周。(3)PEG-CAT组:6只,造模方法同实验组,同时自第12周起,每天腹腔注射PEG-CAT 10 000 U/kg (40 000 U溶于5 mL生理盐水,并于注射前经0.22 μm滤网过滤)。
1.3 检测方法
1.3.1 血流动力学测定[8]:大鼠腹腔注射3%戊巴比妥钠(生理盐水配置,2 mL/kg)麻醉后固定于手术台,右侧颈动脉插入PE-50导管至左心室用于注射黄色微球,右侧股动脉插入PE-50导管,上述操作结束后稳定30 min,经左心室导管匀速注入180 μL含30万U黄色微球溶液并用120 μL生理盐水冲洗,注射持续时间为50 s。黄色微球注入前10 s,用注射器泵以1 mL/min的速度从右侧股动脉抽取标准血样,持续75 s。10 min后氯化钾处死大鼠。将大鼠肺、肝脏、小肠、胃、胰腺、脾脏、结肠及肠系膜取出,吸干多余水分及清除肠道内容物后精确称重。
标准血样及所取组织均按照Triton Technologies公司给出的步骤分别使用BHR以及ADR、AE消化,并加入1000 U蓝色微球作为质控。将所得微球用MCS悬浮后检测吸光度(黄色及蓝色微球吸光波长分别为448及672 nm),并按照如下公式求得血流动力学指标。总外周阻力(total peripheral resistance,TPR)=MAP/CO(mmHg·min·mL-1);组织(小肠、肠系膜等)血流=Qr×(As/Ar),AS代表组织标本黄色微球吸光度值,单位为mL/min;门脉血流(portal flow,PF)为所取内脏血流总和,单位为mL/min;门脉血流阻力(portal flow resistance,PFR)=(MAP-PP)/ PF(mmHg·min·mL-1)。
1.3.2 组织过氧化氢含量测定:依据碧云天公司所提供产品使用说明,使用过氧化氢检测试剂盒检测小肠组织、肠系膜组织过氧化氢含量。计算并除以样品蛋白含量,所得比值即为组织过氧化氢含量,单位nmol/mg。
1.3.3 Western blotting法检测蛋白表达:检测小肠及肠系膜组织VEGF(抗体1∶200配置)、VEGFR2(抗体1∶100配置)及CD31(抗体1∶200配置)表达并用GAPDH作为上样参照。
1.4 统计学分析
应用SPSS 16.0统计软件进行数据分析,计量资料采用(±s)表示,多组间均数比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PEG-CAT对大鼠脏器血流动力学影响
实验组大鼠平均动脉压(MAP)较正常组显著降低(P<0.05),与门静脉高压组比,PEG-CAT干预对血压无明显改变(P>0.05),且三组间心输出量(CO)及总外周阻力(TPR)无统计学差异(P>0.05),说明PEG-CAT干预对全身血流动力学无显著影响。见表1和图1。
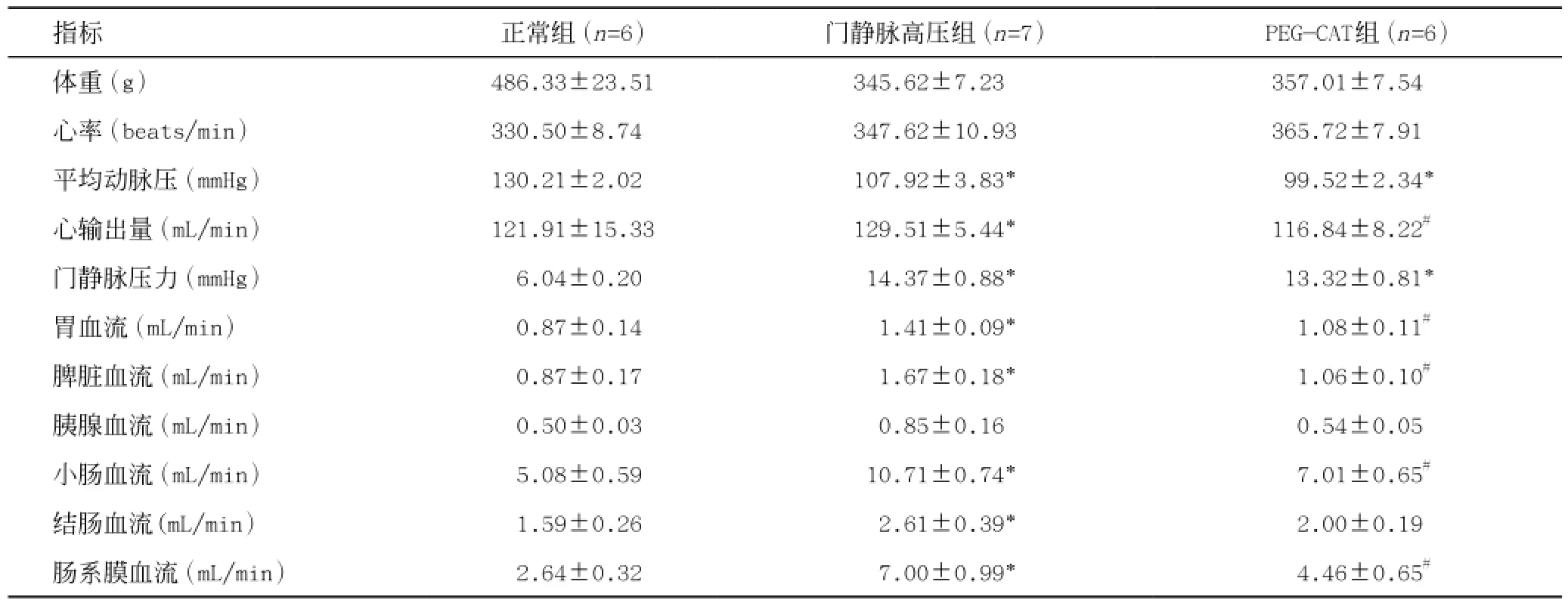
表1 三组体重及血流动力学资料
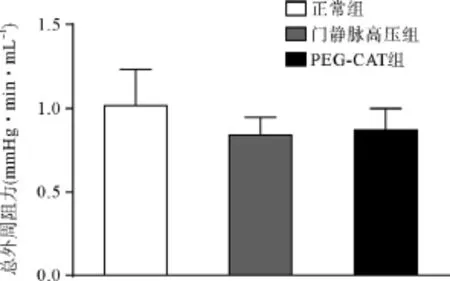
图1 三组大鼠间总外周阻力比较
同时,我们分别检测了三组大鼠主要内脏血流变化(表1),发现与正常组相比,实验组大鼠除胰腺及结肠血流无统计学差异外(P值分别为0.078和0.058),其他各内脏血流均较正常组显著升高(P<0.05),PEG-CAT治疗后可显著降低上述各内脏器官血流量。之后我们进一步计算了各内脏器官血流量总和并进行三组间比较(图2a),发现PEG-CAT治疗后的确可显著降低肝硬化门静脉高压症大鼠总门静脉血流。由于PEG-CAT治疗对已升高的门静脉压力无显著影响(P>0.05,表1),进一步比较了各组大鼠门静脉血流的阻力,即血液流入门静脉时受到的阻力,我们发现PEG-CAT治疗后,可显著增加门静脉血流阻力,但依然显著低于正常组大鼠(P<0.05,图2b),其原因可能是由于肝硬化门静脉高压症的降血压作用以及PEG-CAT治疗并无明显升压作用所造成的,但以上实验结果足以提示,过氧化氢对肝硬化门静脉高压症大鼠内脏异常高血流动力状态的形成具有明显促进作用,而PEG-CAT治疗可显著改善门静脉高压症异常的血流动力学变化。
2.2 PEG-CAT对小肠及肠系膜过氧化氢含量的影响
实验结果如图3所示,肝硬化门静脉高压症大鼠小肠及肠系膜中过氧化氢含量显著升高,分别高出正常组约2倍和0.7倍,PEG-CAT干预后其含量显著降低(P<0.05),且与正常组相比差异无统计学意义(P >0.05)。结合图2所示,这些结果进一步明确清除过氧化氢对肝硬化门静脉高压症具有明显治疗作用。
2.3 PEG-CAT对血管形成相关蛋白表达的影响
我们进一步检测了三组大鼠小肠及肠系膜VEGF、VEGFR2及CD31三种血管形成相关蛋白表达的变化情况(图4a),图4b则为三次免疫印记测定的合计定量数值。统计表明,VEGF、VEGFR2及CD31三种血管新生相关蛋白在门高压大鼠均显著升高。在小肠组织,三种蛋白表达升高约4倍,在肠系膜其升高约达2倍。使用PEG-CAT降低组织过氧化氢含量后,三种蛋白表达均显著降低(P<0.05),说明PEG-CAT可以通过降低氧化氢含量而减少新生血管形成,从而减少门高压大鼠内脏血流量的升高。
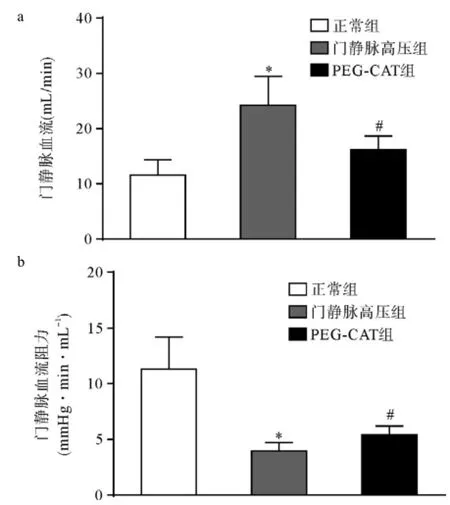
与正常组比,*P<0.05;与门静脉高压组比,#P<0.05 图2 三组大鼠门静脉血流及阻力的比较
与正常组比,*P<0.05;与门静脉高压组比,#P<0.05 图3 小肠及肠系膜组织过氧化氢(H2O2)含量测定
3 讨论
在本研究中,我们主要探索了机体氧化应激的产物过氧化氢在门静脉高压症肝外环境中的作用。通过使用结合有聚乙二醇的过氧化氢抑制剂PEGCAT,不仅可以使细胞内外的过氧化氢得到降解,降低过氧化氢含量。通过过氧化氢检测试剂盒检测小肠及肠系膜过氧化氢的含量,我们也验证了这一药物的有效性。更重要的是,本研究证实了在门静脉高压症大鼠小肠及肠系膜组织中,过氧化氢含量显著增高,而活体注射PEG-CAT可以使过氧化氢含量恢复至正常水平(图3)。这不仅与之前的研究中提到的门静脉高压症机体内氧化应激水平增高观点相符合[4-5],同时本实验更进一步研究了过氧化氢这一特定的氧化应激产物,并通过定量的方式明确了不同组织氧化应激的水平是不同的,为我们之后研究门静脉高压症肝外高动力循环打下了坚实的方法学基础。
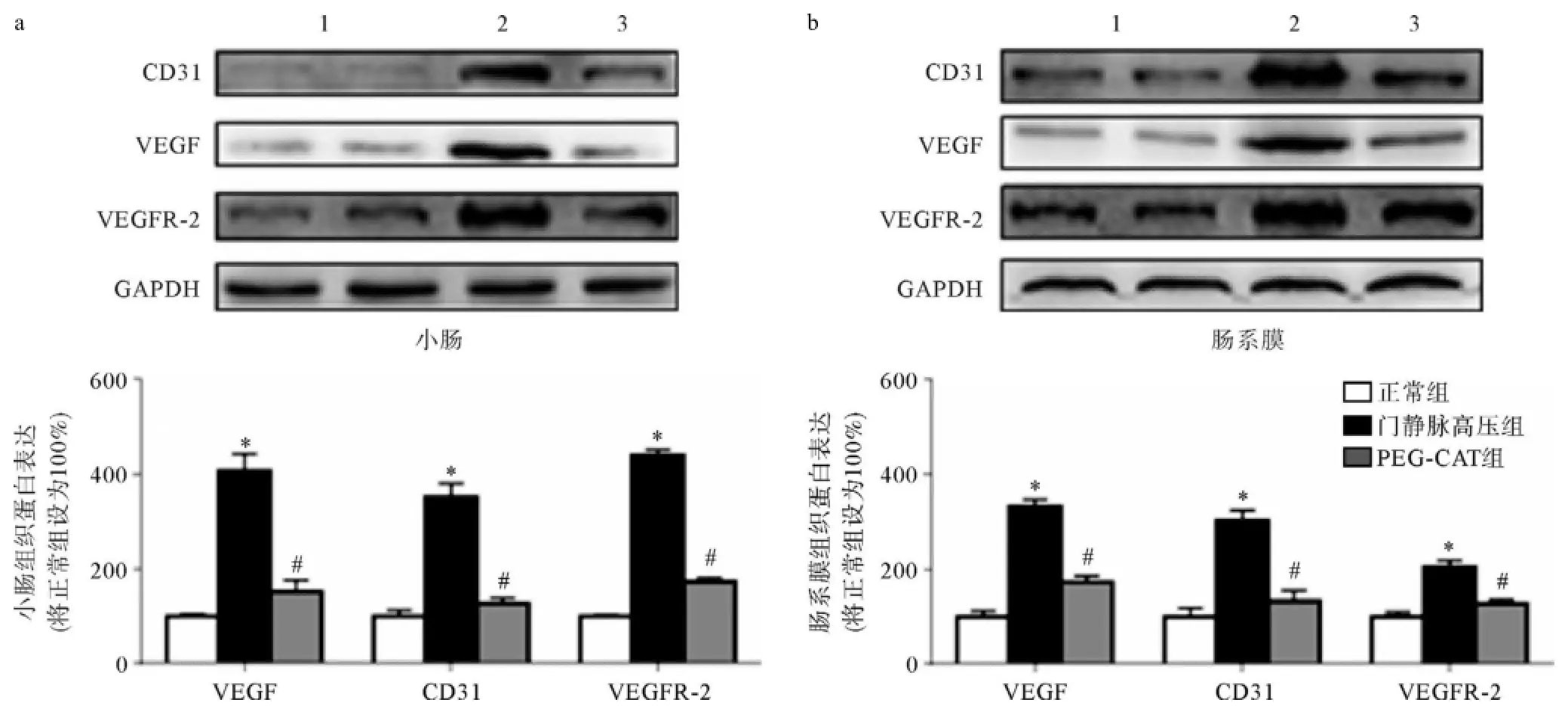
1:正常组;2:门静脉高压组;3:PEG-CAT组;a:小肠;b:肠系膜与正常组比,*P<0.05;与门静脉高压组比,#P<0.05图4 Western blotting法检测CD31,VEGF以及VEGFR2蛋白表达情况
过氧化氢已在其他疾病的相关研究中被证实具有促进血管生成的作用[9],其本身更是一种重要的细胞内第二信使[10],与细胞增殖密切相关。而在门静脉高压症机体的肠系膜及小肠中,血管形成相关蛋白VEGF及CD31已被证实是升高的[11],肠系膜上动脉血流量也相应增多。因此小肠及肠系膜组织中升高的过氧化氢与增多的新生血管之间的联系值得进一步探索。通过使用PEG-CAT抑制过氧化氢含量后,不仅是VEGF、CD31以及VEGFR-2的表达也下降(图4),这不仅证实了过氧化氢确实在肝硬化门静脉高压症体内参与了新生血管的形成,也使PEG-CAT未来进一步临床应用的可能性得到肯定。本实验的不足之处在于我们并未进一步探索其他肝外脏器过氧化氢的含量,但这些脏器的血流量也是改变的(表1),主要是由于通过数据统计后,我们发现小肠及肠系膜血流量的改变对门静脉压力的影响最为显著。关于其他脏器过氧化氢含量的改变对门静脉高压症发生发展的影响将会是我们之后的研究内容,并结合现有研究结果得出更加详实的结论。
在新生血管形成因PEG-CAT的使用而得到缓解后,门静脉高压症大鼠的门静脉压力却未得到降低(图1),但结合其他数据如门静脉血流阻力及门静脉血流量(图2),我们可以证实抑制过氧化氢确实能够有效地改善门静脉高压症机体内异常的全身血流循环。因为在临床实际治疗及疾病严重程度评定中,门静脉压力早已不是作为评判门静脉高压症严重程度的标准之一,肝静脉楔压(hepatic venous pressure gradient,HVPG)已被证实与门静脉高压症并发症的发病风险相关并作为提示患者预后标准之一[12]。而本实验中并未改变的门静脉压力本身存在受其他多种因素影响的可能性,而器官血流量的改变已足以证明过氧化氢的作用以及PEG-CAT作为未来治疗肝外异常血流药物的可能性。在我们之后的研究中,我们将考虑采用测量HVPG进一步确保实验结果的可靠性。
本研究提示,氧化应激及活性氧确实可作为治疗门静脉高压症的治疗靶点,同时PEG-CAT活体使用的可行性也得到了论证[13]。
参考文献:
[1] BOSCH J, GARCÍA-PAGÁN J C. Complications of cirrhosis and portal hypertension [J]. J Hepatol, 2000, 32(1 Suppl): 141-156.
[2] MARUYAMA H, YOKOSUKA O. Pathophysiology of portal hypertension and esophageal varices [J]. Int J Hepatol, 2012,2012: 895787.
[3] IWAKIRI Y, GROSZMANN R J. The hyperdynamic circulation of chronic liver diseases: from the patient to the molecule [J]. Hepatology, 2006, 43(2 Suppl 1): 121-131.
[4] CHEN W, LIU D J, HUO Y M, et al. Reactive oxygen species are involved in regulating hypocontractility of mesenteric artery to norepinephrine in cirrhotic rats with portal hypertension [J]. Int J Biol Sci, 2014, 10(4): 386-395.
[5] QIN J, SUN D, JIANG H, et al. Inhibition of soluble epoxide hydrolase increases coronary perfusion in mice [J]. Physiol Rep, 2015, 3(6): e12427.
[6] ANGERMAYR B, MEJIAS M, GRACIA-SANCHO J, et al. Heme oxygenase attenuates oxidative stress and inflammation, and increases VEGF expression in portal hypertensive rats [J]. J Hepatol, 2006, 44(6): 1033-1039.
[7] 罗蒙, 陈炜, 秦骏, 等. 一氧化氮降低肝硬化门静脉高压症血管收缩反应性的实验研究 [J]. 中华消化外科杂志, 2013, 12(3): 222-227.
[8] KEMP P A, GARDINER S M, MARCH J E, et al. Assessment of the effects of endothelin-1 and magnesium sulphate on regional blood fows in conscious rats, by the coloured microsphere reference technique [J]. Br J Pharmacol, 1999, 126(3): 621-626.
[9] FERNANDEZ M, VIZZUTTI F, GARCIA-PAGAN J C, et al. Anti-VEGF receptor-2 monoclonal antibody prevents portalsystemic collateral vessel formation in portal hypertensive mice [J]. Gastroenterology, 2004, 126(3): 886-894.
[10] BURGOYNE J R, OKA S, ALE-AGHA N, et al. Hydrogen peroxide sensing and signaling by protein kinases in the cardiovascular system [J]. Antioxid Redox Signal, 2013, 18(9): 1042-1052.
[11] SEN C K, KHANNA S, BABIOR B M, et al. Oxidant-induced vascular endothelial growth factor expression in human keratinocytes and cutaneous wound healing [J]. J Biol Chem,2002, 277(36): 33284-33290.
[12] SANYAL A J, BOSCH J, BLEI A, et al. Portal hypertension and its complications [J]. Gastroenterology, 2008, 134(6): 1715-1728.
[13] 段明, 何越, 陈炜, 等. 过氧化氢在门静脉高压症大鼠侧支循环建立中的作用 [J]. 肝胆胰外科杂志, 2015, 27(1): 22-25.
(本文编辑:张和,鲁翠涛)
[中图分类号]R575.2
[文献标识码]A
Doi:10.11952/j.issn.1007-1954.2016.04.005
[收稿日期]2016-01-30
[基金项目]国家自然科学基金项目(81370548)。
[第一作者简介]何越(1990-),男,浙江宁波人,在读硕士。
[通讯作者简介]罗蒙,主任医师,博士生导师,博士,E-mail:luotysy@sina.com。Protein expressions of VEGF, VEGFR-2 and CD31 were well blocked by PEG-CAT. Conclusion PEG-CAT can reduce protein expressions of angiogenesis markers in portal hypertensive rats via blockage of H2O2. Moreover,although blockage of H2O2will not be able to reduce portal pressure, portal venous flow is reduced significantly which indicates potential possibility of considering blockage of H2O2as future treatment target in portal hypertension.
PEG-CAT ameliorates hyperdynamic splanchnic circulation in hepatic cirrhosis and portal hypertension rats
HE Yue1, SHI Dan-li2, QIN Jun1, LUO Meng3. 1Department ofGeneral Surgery, RenjiHospital Affiliated to School of Medcine, Shanghai Jiaotong University, Shanghai 200127, China; 2Department of General Surgery, Shanghai Third People’s Hospital Affiliated to School of Medicine, Shanghai Jiaotong University, Shanghai 200127, China;3Department of General Surgery, the 9thPeople’s Hospital Affiliated to School of Medcine, Shanghai Jiaotong University, Shanghai 200011, China
Abstractobjective To investigate the influence of PEG-CAT in the regulation of hyperdynamic splanchnic circulation in portal hypertensive rats, and to verify the effects of super oxide on portal hypertension. Methods Portal pressure was measured in normal rats (n=6), carbon tetrachloride treated rats (n=7), as well as rats treated with PEG-CAT (n=6). The hemodynamic studies were performed by colored microsphere technique. The H2O2level was measured with the Hydrogen Peroxide Assay Kit. Protein expressions of angiogenesis markers were determined with Western blotting. Results (1) The portal pressures had a significant difference between normal rats and portal hypertensive rats, but there was no difference between portal hypertension group and catalase-treated group. (2) Compared with the control group, the blood flows of intestine, stomach, mesentery and spleen were elevated significantly and treatment of PEG-CAT could reduce blood flow of these organs. (3) Portal hypertensive rats had a higher expression of H2O2in mesentery and intestine which would be blocked by PEG-CAT. (4)
Key wordsliver cirrhosis; portal hypertension; hydrogen peroxide; rats
