c—KIT在不同毛色山羊皮肤中的表达
2016-07-23魏彦辉周荣艳张军杰
魏彦辉++周荣艳++张军杰
摘要:为了研究c-KIT在不同毛色山羊皮肤组织中的表达与定位并探索c-KIT在毛色形成中的作用机制,以黑山羊、白山羊为研究对象,利用实时定量PCR技术分析其相对表达量,并采用免疫组织化学技术进行c-KIT表达定位分析。结果表明,在山羊皮肤组织中,c-KIT主要分布在皮肤上皮部、汗腺、皮脂腺、毛囊漏斗部以及内外根鞘。c-KIT在黑山羊、白山羊毛色皮肤组织中表达部位、表达水平无显著差异,表明c-KIT的表达量、表达部位不是造成黑山羊、白山羊色差异的主要因素。
关键词:c-KIT;山羊;免疫组织化学;皮肤;毛色
中图分类号:S827.2文献标志码: A文章编号:1002-1302(2016)05-0038-03
绒、毛及裘皮是山羊重要的经济性状,毛色表型特征的选育尤其受到各国育种人员的关注[1]。探索山羊毛色形成的机制可以为培育天然的彩色山羊提供理论基础。哺乳动物的毛色表型特征主要是由毛发中黑色素的类型、数量决定的。c-KIT 编码的蛋白表达于黑素细胞前体物,肥大/干细胞生长因子的受体(mast/stem cell growth factor receptor,c-KIT)属于跨膜酪氨酸激酶受体,参与黑素细胞形成、成熟、增殖、分化及迁移等过程[2-4]。经过伊马替尼处理的人表皮黑素细胞中,由于c-KIT不能被磷酸化,从而可以抑制黑素细胞的迁移[5]。张巧灵等通过免疫组化分析得到Kit蛋白,在白色羊驼皮肤毛囊内根鞘、外根鞘及其结缔组织中有一定量的表达,但其在黄色羊驼表皮下层的结缔组织中只有很少量的表达[6]。Kit在白色羊驼中显著表达,其相对表达量是棕色羊驼的4.602 9倍[7]。但是关于c-KIT在山羊皮肤组织内的表达及其是否与山羊毛色的形成有关未见报道。本试验以黑色山羊、白色山羊为研究对象,首次对c-KIT在不同毛色山羊皮肤组织中的表达定位进行了研究,在转录水平对其在不同毛色山羊皮肤组织中的表达情况进行了检测,探索该基因与山羊毛色形成的关系,旨在为研究c-KIT调控山羊毛色形成的分子机制提供依据。
1材料与方法
1.1材料
在河北省定州市随机挑选成年白色山羊、黑色山羊各3只,选取体侧部位皮肤,用刮毛器刮净羊毛,用手术法取 1 cm2 左右皮肤组织6块。将用于总RNA提取的3块皮肤快速投入液氮中保存,将用于免疫组织化学分析研究的3块皮肤投入10%甲醛溶液中固定,石蜡包埋后制成组织切片。
1.2主要试剂和仪器
兔抗人c-KIT抗体(购自Santa Cruz Biotechnology INC公司);封闭用山羊血清工作液、生物素标记的羊抗兔IgG、Streptavidin-HRP工作液、DAB显色试剂盒(均购自康为世纪公司);苏木素(Solarbio公司);RNA提取试剂盒(北京全式金生物技术有限公司);荧光定量试剂盒(日本东洋纺公司);其他常规试剂均使用国产分析纯试剂。PCR仪(德国Biometra公司);iQ5实时荧光定量PCR仪(Bio-Rad公司);核酸蛋白测定仪ND2000 (Thermo公司);高速冷冻离心机(Sigma公司)。
1.3总RNA的提取以及反转录合成
取冻存的山羊皮肤组织,按照RNA提取试剂盒说明书进行总RNA提取,利用核酸蛋白测定仪进行浓度与纯度测定,用1%琼脂糖凝胶电泳检测RNA质量。使用M-MLV反转录酶进行cDNA第一链合成,配制模板RNA 10 μL、oligo(dT)18 5 μL、RNase free ddH2O 15 μL的混合液;70 ℃保温 10 min,冰上急冷2 min。短暂离心后分别加入10 μL 5×M-MLV Buffer、2.5 μL 10 mmol/L dNTP Mixture、1.25 μL Recombinant Ribonuclease Inhibitor、1.25 μL Reverse Transcriptase M-MLV和5 μL RNase free ddH2O。42 ℃保温1 h,70 ℃保温15 min后冰上冷却。逆转录产物保存于-20 ℃备用。
1.4山羊皮肤组织中c-KIT的qRT-PCR
1.4.1反转录合成c-KIT的cDNA根据山羊c-KIT的基因序列以及GADPH的基因序列,利用Primer 5.0软件设计特异性引物,由华大六合基因公司合成。引物序列如下:c-KIT基因正引物:5′-GGCCCACCCTGGTCATTACAGAATAT-3′,反引物:5′-TGTCTGCCGCCTTGGTTGGTAC-3′,预期扩增片段大小为225 bp;GADPH基因正引物:5′-CACCCTCAAGATTGTCAGC-3′,反引物:5′-CAGTGGTCATAAGTCCCTCC-3′,预期扩增片段大小为107 bp。PCR反应体系总体积为50 μL,包含cDNA 2 μL,上下游引物各2 μL,2x Taq MasterMix 25 μL,ddH2O 19 μL。PCR反应条件为:94 ℃ 预变性 10 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,36个循环;最后 72 ℃ 延伸 10 min。扩增结束后用 1%琼脂糖凝胶对产物进行电泳检测和回收纯化,连接pEASY-T3载体并转化trans1-t1感受态细胞,选取阳性重组子后送北京中科希林生物科技有限责任公司测序,确定为阳性的克隆提取质粒。
1.4.2测定c-KIT基因表达量取反转录合成的cDNA,每个cDNA分别使用的引物对c-KIT与内参GAPDH进行实时定量PCR扩增。优化后的反应体系:THUNDERBIRD SYBR qPCR Mix 10 μL,上下游引物各1 μL,cDNA 1 μL,ddH2O 7 μL,总计20 μL。扩增程序:95 ℃ 45 s;95 ℃ 15 s,62 ℃ 15 s,72 ℃ 45 s,共40个循环。每个样本设3次重复。反应结束后以溶解曲线来判定反应的特异性。
1.4.3数据分析利用Microsoft Excel软件进行数据分析,结果均用平均值±标准误表示,其中基因的表达量结果经内参基因GAPDH表达量校正。分别扩增SCF、GAPDH基因,通过2-ΔΔCT法计算SCF基因在不同毛色山羊皮肤组织中的相对表达水平,ΔCT目的基因=CT目的基因-CT内参基因,ΔΔCT=ΔCT黑色山羊-ΔCT白色山羊,SCF基因mRNA表达差别倍数以2-ΔΔCT表示。
1.5山羊皮肤组织中c-KIT的免疫组化分析
将固定在10%甲醛溶液的皮肤组织取出,经过脱水、二甲苯透明、浸蜡、包埋、修块、切片,获得厚度为5 μm的石蜡切片。石蜡切片脱蜡至水,用3%过氧化氢甲醇溶液处理 20 min,灭活内源性过氧化物酶;用PBS清洗3次,每次 5 min。0.1%胰蛋白酶抗原修复;室温下用山羊血清封闭 20 min,去掉封闭液,滴加一抗(1 ∶80稀释),4 ℃孵育16 h,37 ℃复温20 min,PBS代替一抗作为阴性对照;PBS清洗后滴加二抗(生物素标记的羊抗兔IgG),室温孵育30 min;PBS清洗后加入Streptavidin-HRP工作液,室温孵育20 min;PBS清洗后滴加DAB显色液显色,显微镜下观察显色程度,自来水冲洗终止反应,苏木素复染。梯度乙醇脱水,二甲苯透明,中性树胶封固,显微镜下观察拍摄。
2结果与分析
2.1山羊皮肤组织中总RNA的提取
将所提取的皮肤组织总RNA用1%琼脂糖凝胶电泳进行检测,电泳条带清晰,28 S、18 S清晰可见(图1)。用核酸测定仪进行RNA样品测定,D260 nm与D280 nm比值为1.8~2.0。
2.2山羊皮肤组织中c-KIT的qRT-PCR
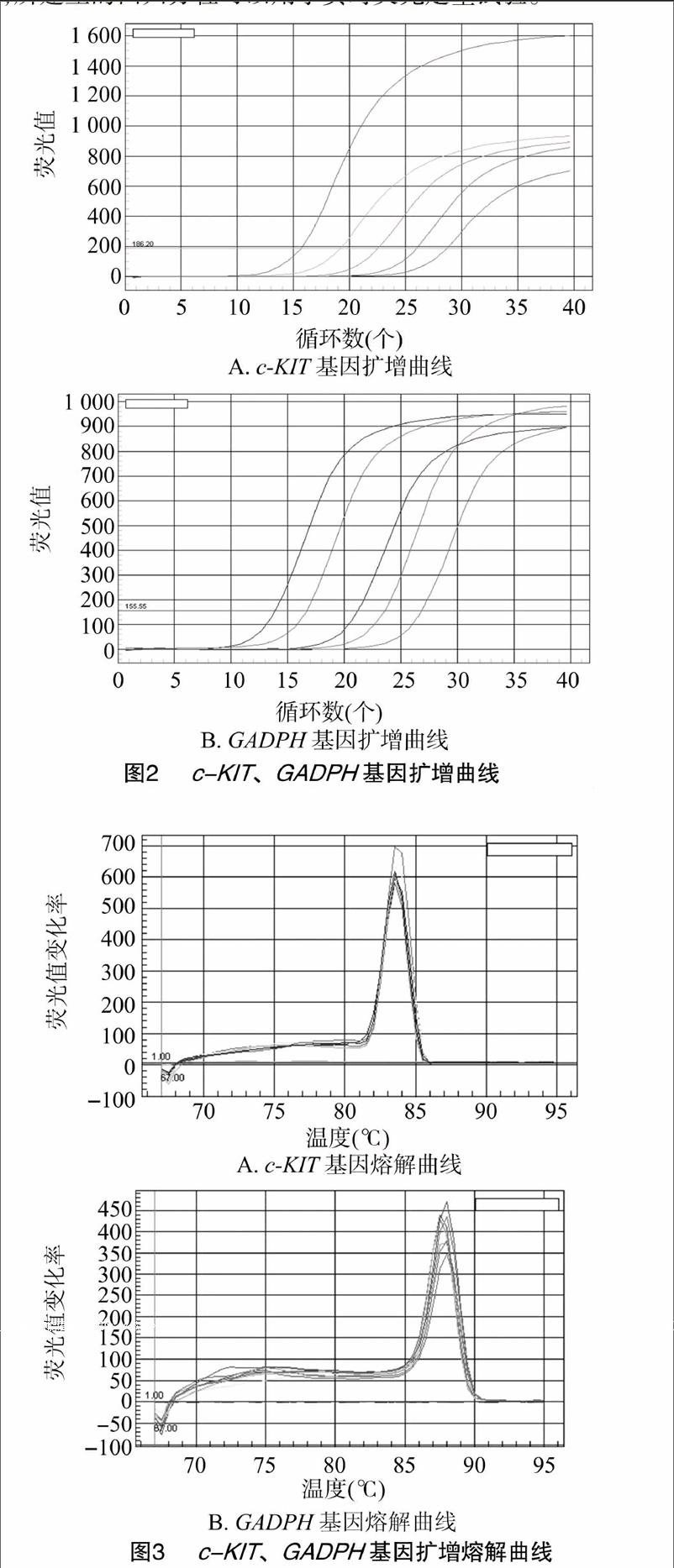
2.2.1实时荧光定量试验经过PCR条件优化,成功扩增了与预期大小一致的片段,电泳检测显示条带清晰整齐,扩增结果良好。对鉴定为阳性的重组质粒按10倍倍比稀释,进行实时荧光定量PCR扩增,由图2、图3可以看出c-KIT、GADPH基因的扩增产物CT值均一,熔解曲线只有1个明显的峰,表明在实时荧光定量PCR过程中,荧光信号均来自于特异性扩增产物,且没有产生非特异性扩增及引物二聚体。根据荧光值的变化规律,系统自动生成起始模板浓度与CT值间的回归曲线,该标准曲线检测灵敏度为109~105个模板。c-KIT基因的回归方程为y=40.108-3.275x,r2=0.992;GADPH基因的回归方程为y=45.351-3.276x,r2 =0.998。由此可见,所建立的回归方程可以用于实时荧光定量试验。
2.2.2实时荧光定量结果根据2-ΔΔCT相对定量方法的结果,表明c-KIT基因在黑色山羊皮肤中的mRNA表达水平是白色山羊的1.28倍,且差异不显著。
2.3山羊皮肤组织中c-KIT的免疫组化结果
山羊皮肤组织中c-KIT的免疫组织化学结果见图4,结果显示,在白色山羊、黑色山羊皮肤组织中,c-KIT主要定位在细胞膜上,在皮肤上皮、毛囊漏斗部、外根鞘、内根鞘、皮脂腺以及汗腺有阳性着色,对照组无着色。对不同毛色山羊皮肤组织中的阳性细胞平均光密度进行测定比较,结果表明,c-KIT 在白色山羊、黑色山羊皮肤组织中阳性细胞(毛囊漏斗部、外根鞘、内根鞘)的表达量不存在显著差异。
3结论与讨论
本研究结果表明,c-KIT在不同毛色山羊皮肤组织中主要分布于表皮、毛囊内外根鞘、毛囊漏斗部、皮脂腺、汗腺中,并且黑色山羊、白色山羊皮肤组织中c-KIT的表达部位、表达量无显著差异。c-KIT表达于黑素细胞前体物,作为肥大/干细胞生长因子受体(mast/stem cell growth factor receptor,c-KIT),属于跨膜酪氨酸激酶受体,参与黑素细胞的形成、成熟、增殖、分化及迁移等过程[2-4],在物种毛色形成中起重要作用。在正常人皮肤中,c-KIT表达于表皮、毛囊漏斗部、外根鞘。在羊驼皮肤中,c-KIT主要在毛囊永久部检测到信号[8]。c-KIT在山羊皮肤中主要表达于上皮、汗腺、皮脂腺、毛囊漏斗部、内外根鞘,这与在其他物种中的报道相符,这提示c-KIT在山羊毛色形成过程中可能与在其他物种中所起的功能相似或相同。c-KIT在黑色山羊、白色山羊皮肤组织中的表达部位相同,而且其mRNA表达量无显著差异,说明c-KIT在皮肤组织中的表达并不是导致试验所选不同山羊毛色差异的主要因素。人角蛋白细胞和黑素细胞研究发现,经过紫外线诱导后,皮肤中c-KIT及其膜结合型的SCF配体的表达量显著升高[9],表明在SCF/c-KIT系统中,表皮黑色素着色过程起到调节作用,c-KIT在黑山羊、白山羊表皮中均有明显表达,但观察到的黑色素数量却差异显著,所以推测不同黑山羊、白山羊皮肤中还存在其他关键因素影响山羊表皮中黑色素的生成。在山羊皮肤组织中,c-KIT主要分布于表皮、汗腺、皮脂腺、毛囊漏斗部、内外根鞘的上皮细胞、毛球部的黑素细胞以及肥大细胞中。皮肤上皮细胞具有较强的分裂潜力,能够分化为具有间充质特性的细胞来修复组织损伤[10-11]。因此有学者认为,与KIT有关系的肥大细胞,部分种类的造血干细胞、生殖细胞、黑素细胞以及胃肠道的卡哈尔氏间质细胞在特定条件下都具有较强的分裂能力[12-13]。因此c-KIT主要表达于具有较强分裂增殖潜力的细胞中,c-KIT还可能与皮肤细胞的更新有关。
参考文献:
[1]常洪. 山羊的毛色遗传[J]. 国外畜牧科技,1995,22(5):23-26.
[2]Botchkareva N V,Khlgatian M,Longley B J,et al. SCF/c-kit signaling is required for cyclic regeneration of the hair pigmentation[J]. FASEB Journal,2001,15(3):645-658.
[3]Parichy D M,Rawls J F,Pratt S J,et al. Zebrafish sparse corresponds to an orthologue of c-kit and is required for the morphogenesis of a subpopulation of melanocytes,but is not essential for hematopoiesis or primordial germ cell development[J]. Development,1999,126(15):3425-3436.
[4]Nishikawa S,Kusakabe M,Yoshinaga K,et al. In utero manipulation of coat color formation by a monoclonal anti-c-kit antibody:two distinct waves of c-kit-dependency during melanocyte development[J]. EMBO Journal,1991,10(8):2111-2118.
[5]Xia J X,Li F Q,Urabe K,et al. Imatinib inhibits migration of normal human epidermal melanocytes and suppress the phosphorylation of C-kit[J]. Bangladesh Journal of Pharmacology,2012,7(2):100-103.
[6]张巧灵,姜俊兵,张维军,等. 显性白毛调控基因在不同毛色羊驼皮肤中表达差异的研究[J]. 激光生物学报,2008,17(4):491-495.
[7]张丹丽,田雪,宋云飞,等. miR-193b及其靶基因Kit在不同毛色羊驼皮肤中的表达[J]. 中国畜牧兽医,2013,40(5):44-49.
[8]姜俊兵,于秀菊,田雪,等. 干细胞因子及其受体c-KIT对羊驼毛囊黑色素细胞增殖与分化的影响及其机制[J]. 解剖学报,2011,42(1):99-103.
[9]Hachiya A,Kobayashi A,Ohuchi A,et al. The paracrine role of stem cell factor/c-kit signaling in the activation of human melanocytes in ultraviolet-B-induced pigmentation[J]. Journal of Investigative Dermatology,2001,116(4):578-586.
[10]Snippert H J,Haegebarth A,Kasper M,et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin[J]. Science,2010,327:1385-1389.
[11]Thiery J P,Acloque H,Huang R Y,et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell,2009,139(5):871-890.
[12]Zhu Y I,Fitzpatrick J E. Expression of c-kit (CD117) in Spitz nevus and malignant melanoma [J]. J Cutan Pathol,2006,33:33-37.
[13]Tryqqvason G,Hilmarsdottir B,Gunnarsson G H,et al. Tyrosine kinase mutations in gastrointestinal stromal tumors in a nation-wide study in Iceland[J]. APMIS,2010,118(9):648-656.漫晓丹,孟春花,王慧利,等. 猪SLA-DRB1基因外显子3单核苷酸多态性及其与PRRSV易感性的关联[J]. 江苏农业科学,2016,44(5):41-44.
