IL-18基因转染对大鼠胶质瘤体内生长及肿瘤细胞凋亡的影响
2016-07-21宋杨英张建军程天军
宋杨英,张建军,程天军
(1.河北省玉田县医院检验科,河北 玉田 064100;2.河北省玉田县医院肿瘤外科,河北 玉田 064100)
IL-18基因转染对大鼠胶质瘤体内生长及肿瘤细胞凋亡的影响
宋杨英1,张建军1,程天军2
(1.河北省玉田县医院检验科,河北 玉田 064100;2.河北省玉田县医院肿瘤外科,河北 玉田 064100)
摘要:目的分析转染外源性IL-18基因后9L胶质瘤细胞体内成瘤及对肿瘤细胞凋亡的影响。方法用立体定向技术将体外用逆转录病毒转染IL-18基因的9L胶质瘤细胞(9L/IL-18)、转染空载体的9L胶质瘤细胞(9L/LXSN)及未转染的9L细胞接种到F344大鼠颅内建立实验动物模型,观察各组细胞对大鼠的致瘤性,计算成瘤率;原位末端标记法(TUNEL法)检测肿瘤组织中肿瘤细胞凋亡情况,计算各组肿瘤细胞的凋亡率;RT-PCR和Westen Blot法检测肿瘤组织中Bax和Bcl-2的表达。结果三组大鼠成瘤率均为100%;TUNEL法检测结果显示,接种9L/IL-18细胞组肿瘤组织内出现大量凋亡细胞,凋亡率为(22.2±1.02)%,明显高于接种9L/LXSN[(5.7±0.32)%]及9L[(6.4±0.51)%]细胞组(P<0.05);接种9L/IL-18细胞组肿瘤组织中Bax的表达较其他两组升高,Bcl-2的表达较其他两组降低。结论9L胶质瘤细胞转染外源性IL-18基因后,可通过上调Bax的表达,下调Bcl-2的表达促进肿瘤细胞凋亡,发挥抗肿瘤作用。
关键词:IL-18;基因转染;胶质瘤;细胞凋亡;TUNEL;Bax;Bcl-2
胶质瘤是中枢神经系统最常见的脑部肿瘤[1],可发生于任何年龄[2],由于胶质瘤细胞多呈浸润性生长,手术不易全部切除,治疗效果差。而血脑屏障的存在又使很多药物在颅内不能达到有效浓度,放疗虽能杀死肿瘤细胞,但对机体正常细胞也会造成损害。目前,经过常规治疗后胶质母细胞瘤患者的平均生存期仅为10~14个月[3],常规治疗肿瘤的方法治疗胶质瘤临床疗效都不理想。胶质瘤发生、发展的根本原因是无限增殖和凋亡抑制,免疫疗法作为治疗胶质瘤的新型疗法越来越受到临床医生的青睐。
IL-18是一种多效性细胞因子,在机体的天然免疫和获得性免疫中都发挥重要作用,既能促进Th1细胞成熟,又能诱导Th2细胞分化。研究表明,IL-18在中枢神经系统疾病过程中,如中枢神经系统炎症、自身免疫性疾病、大脑缺血缺氧性疾病、外伤性大脑损伤及脑部肿瘤等都发挥着重要作用[4-5]。本研究拟通过将转染了IL-18基因的胶质瘤细胞直接注入同基因大鼠颅内,观察大鼠成瘤及瘤体组织中肿瘤细胞的凋亡情况,进一步探讨IL-18在脑胶质瘤治疗中的应用价值。
1材料与方法
1.1材料
1.1.1细胞株转染IL-18基因的9L胶质瘤细胞(9L/IL-18)、转染空载体的9L胶质瘤细胞(9L/LXSN)及未转染的9L细胞均由河北医科大学第四医院科研中心构建并保存。
1.1.2动物雄性F344大鼠购自北京维通利华实验动物技术有限公司(合格证号:0191929)。
1.1.3试剂鼠抗Bax多克隆抗体、兔抗Bcl-2多克隆抗体均购自Santa Cruz Biotechnology;抗β-Actin鼠单克隆抗体购自北京康为试剂生物科技有限公司;TUNEL检测试剂盒购自上海罗氏制药有限公司。
1.2方法
1.2.1立体定向技术建立实验动物模型
1.2.1.1收集对数生长期的9L/IL-18、9L/LXSN及9L细胞,PBS稀释,浓度为1×108/mL。各取10 μL经台盼蓝染液染色后计数活细胞比例,3种细胞活细胞比例均>95%。
1.2.1.2建立实验动物模型[6],将2%戊巴比妥麻醉后大鼠固定于立体定向仪上。常规消毒后沿头正中线纵向切开头皮,暴露前囱,在前囱中点前1.0 mm,矢状缝右3.0 mm处用牙科钻钻一骨孔,微量进样器吸取细胞悬液10 μL,经骨孔垂直进针6.0 mm后回退1.0 mm,将细胞悬液缓缓注入大鼠颅内,待细胞沉淀后拔出针头,缝合头皮切口(Fig.1)。接种后大鼠继续按SPF动物饲养,14 d后分别取各组大鼠肿瘤组织。

Fig.1 The animal models bearing glioma were established by the stereotactic technique.A:A hole was drilled in the tight caudate nucleus of the rat;B:Rat was intracerebrally implanted with different cells suspension.
1.2.2肿瘤组织的处理
分别取接种9L/IL-18、9L/LXSN及9L细胞14 d后的大鼠肿瘤组织,去除坏死部分后将各组肿瘤组织分为两部分,一部分用10%福尔马林溶液固定,常规石蜡包埋后制成蜡块,原位末端标记法(TUNEL)检测原位细胞凋亡;另一部分置于-80 ℃保存,用于提取RNA及蛋白质。
1.2.3TUNEL测定肿瘤细胞凋亡情况
将石蜡包埋组织切片常规脱蜡脱水后,按试剂盒说明书进行实验。光学显微镜下观察,细胞内出现棕黄色颗粒为凋亡细胞。每张切片随机选取5个视野(100×),观察并计数500个细胞,以TUNEL阳性细胞数作为TUNEL检测结果,凋亡指数(PI)表示各组细胞凋亡程度。PI(%)=(凋亡细胞数/肿瘤细胞总数)×100%。
1.2.4RT-PCR检测肿瘤组织中Bax及Bcl-2 mRNA的表达
1.2.4.1提取组织总RNA,鉴定RNA纯度及浓度后进行扩增。引物序列如下:
Bax上游:5′TTGTTACAGGGTTTCATCC 3′
Bax下游:5′CTCCATATTATTGTCCAGTTC 3′
Bcl-2上游:5′GGGCTACGAGTGGGATAC 3′
Bcl-2下游:5′AGGCTGGAAGGAGAAGATG 3′
β-actin上游:5′AGCCATGTACGTAGCCATCC 3′
β-actin下游:5′TCTCAGCTGTGGTGGTGAAG 3′
PCR反应条件
Bax:94 ℃预变性5 min,循环参数:94 ℃ 45 s,54 ℃ 30 s,72 ℃30 s。共循环32次,72 ℃ 延伸5 min,4 ℃∞。
Bcl-2:94 ℃预变性5 min,循环参数:94 ℃ 45 s,56 ℃ 30 s,72 ℃ 30 s。共循环32次,72 ℃延伸5 min,4 ℃∞。
β-actin:94 ℃预变性5 min,循环参数:94 ℃ 45 s,55 ℃ 30 s,72 ℃ 30 s。共循环32次,72 ℃延伸5 min,4 ℃∞。
1.2.4.2目的基因的测定
取目的基因PCR产物6 μL于1.5%琼脂糖凝胶中电泳,恒压80 V,以β-actin基因扩增产物作内参,凝胶成像系统观察及图像采集,gel-proanalysis 3.1软件扫描观察结果,在相应位置上可见特异DNA条带。
1.2.5Western Blot法检测肿瘤组织中Bax及Bcl-2蛋白表达
提取组织蛋白后,用Lowry法测定蛋白浓度,经Western Blot各步骤后,用Odyssey双色红外荧光扫描系统对个蛋白条带进行检测,分析Bax、Bcl-2蛋白表达水平。
1.3统计学方法
采用SPSS 13.0软件处理数据,结果以均数±标准差表示,多组间均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2结果
2.1接种9L/IL-18、9L/LXSN及9L细胞的三组大鼠均成瘤,成瘤率均为100%。但接种9L/IL-18细胞组肿瘤体积小于其他两组(Fig.2,Fig.3)。
2.2接种9L/IL-18细胞组肿瘤组织内可见大量凋亡细胞,接种9L/LXSN和9L细胞组肿瘤组织内仅见少量凋亡细胞。三组肿瘤组织PI分别为:(22.2±1.02)%、(5.7±0.32)%和(6.4±0.51)%,接种9L/IL-18细胞组凋亡率明显高于其他两组,差异有统计学意义(P<0.05)(Fig.4)。
2.3接种9L/IL-18细胞组肿瘤组织中Bax的表达高于接种9L/LXSN和9L细胞组,Bcl-2的表达则低于该两组(Fig.5,Fig6)。
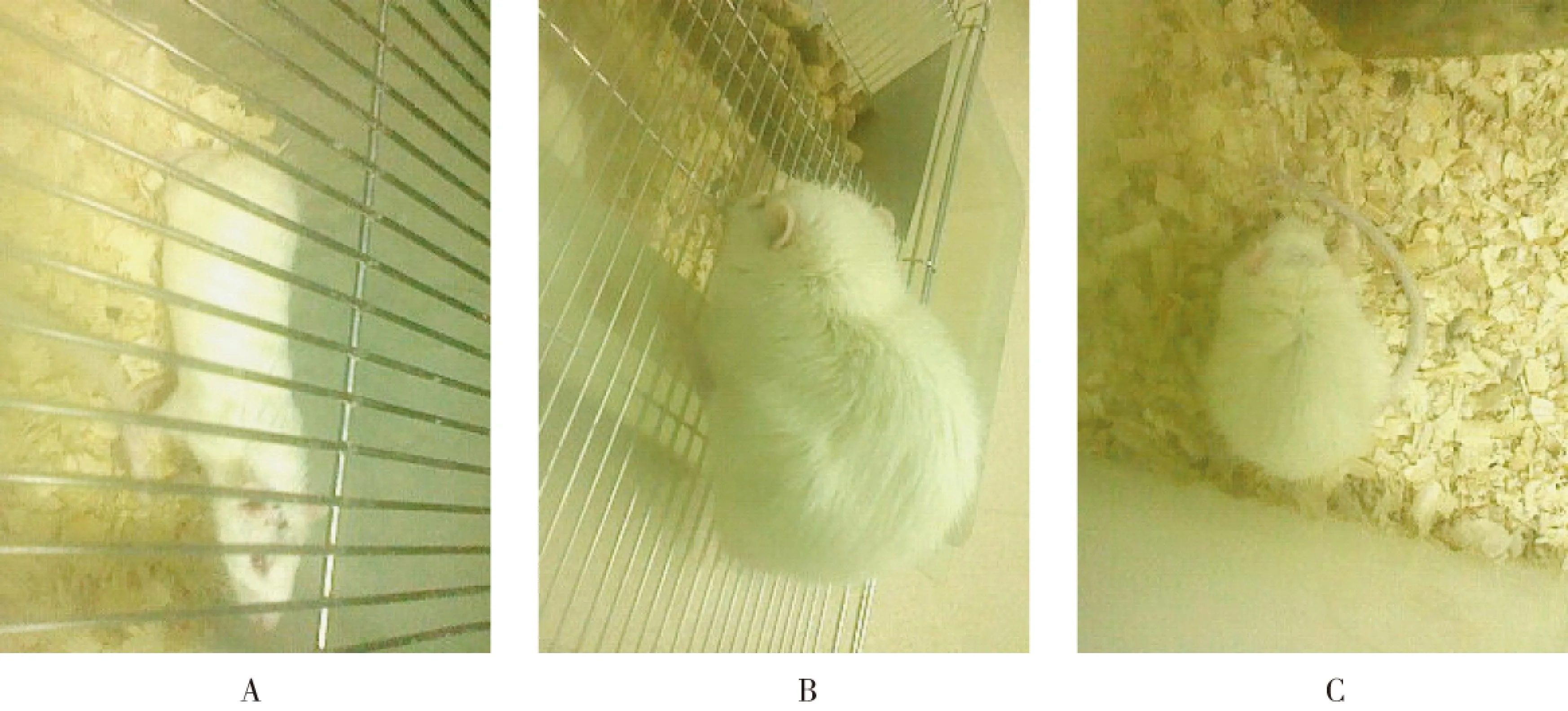
Fig.2 The general status of rats implanted with different cells for 10 days.A:9L/IL-18;B:9L/LXSN;C:9L.

Fig.3 The tumor size of rats implanted with different cells.

Fig.4 Cell apoptosis of tumor tissues from F344 rats implanted with different cells detected by TUNEL.A:9L/IL-18;B:9L/LXSN;C:9L.


Fig.5Expressions of Bax and Bcl-2 mRNA in tumor tissues from F344 rats implanted with different cells detected by RT-PCR.
M:DNA marker;1:9L/IL-18;2:9L/LXSN;3:9L.

Fig.6Expressions of Bax and Bcl-2 in tumor tissues from F344 rats implanted with different cells detected by Western Blot.
1:9L/IL-18;2:9L/LXSN;3:9L.
3讨论
细胞凋亡是在生理或病理状态下,经过一系列基因调控而发生的细胞程序性死亡,与多种疾病的发生有关,并在疾病的早期诊断、治疗监测和预后中有着重要的作用。有研究表明,细胞凋亡异常在肿瘤发生、发展过程中起重要作用,并影响肿瘤转移及预后,许多化疗药物及放射治疗即通过使靶细胞发生凋亡而发挥作用。Bcl-2是典型的凋亡抑制因子,Bax是典型的促凋亡因子,本研究表明,转染外源性IL-18基因以后,大鼠肿瘤组织中Bcl-2表达下降,Bax表达上升,且TUNEL法也证明在肿瘤组织中凋亡细胞显著增多,表明在体内IL-18能够促进大鼠胶质瘤细胞凋亡。然而,在体外实验中,IL-18并不影响9L胶质瘤细胞的凋亡,IL-18促进胶质瘤细胞凋亡的作用可能与肿瘤组织微环境或机体的整体反应有关。
研究表明,胶质细胞瘤本身即可表达Bcl-2蛋白[7-9],且Bcl-2的表达与患者生存时间呈负相关[7],与胶质瘤病理分期正相关[9]。本研究中,接种9L/IL-18细胞的大鼠肿瘤体积明显减小,Bcl-2
的表达下降,与华咏等[9]的研究结果一致,说明转染IL-18后降低了大鼠胶质瘤的恶性程度。另有研究表明,降低Bcl-2的表达可提高胶质瘤对化疗药物及对TK/GCV自杀基因治疗的敏感性[10],也提示我们IL-18与其他药物共同作用可能会提高对胶质瘤的抑瘤作用。
参考文献:
[1]Timothy J,Betty T,Joseph L,et al.FasL gene knock-down therapy enhances the antiglioma immune response[J].Neuro-Oncology,2010,12(5):482-489.
[2]Stupp R,Pavlidis N,Jelic S,et al.ESMO Guidelines Task Force.ESMO minimum clinical recommendations for diagnosis,treatment and follow-up of malignant glioma[J].Ann Oncol,2005,16(suppl 1):i64-i65.
[3]Van Meir E G,Hadjipanayis C G,Norden A D,et al.Exciting new advances in neuro-oncology:The avenue to a cure for malignant glioma[J].CA Cancer J Clin,2010,60(3):166-193.
[4]Ursula Felderhoff-Mueser,Oliver I S,Andreas O,et al.IL-18:A key player in neuroinflammation and neurodegeneration[J].TRENDS Neurosci,2005,28(9):487-493.
[5]Silvia A,Davide C,Shuei S,et al.Interleukin 18 in the CNS[J].J Neuroinflam,2010,7:9.
[6]林健,王伟民,冼江,等.9L/F344大鼠脑胶质瘤模型的建立[J].中国微侵袭神经外科杂志,2003,8(8):359-362.
[7]McDonald F E,Ironside J W,Gregor A,et al.The prognostic influence of Bcl-2 in malignant glioma[J].Br J Cancer,2002,17;86(12):1899-1904.
[8]方琦,赵革灵,银正民,等.Bcl-2蛋白在脑胶质瘤中的意义[J].中国肿瘤临床,2003,30(7):480-482.
[9]华咏,徐荣,韩俊毅,等.细胞周期和Bcl-2,Bax表达与脑胶质瘤病理分级的相关性研究[J].肿瘤,2009,29(6)578-581.
[10]Fels C,Schafer C,Huppe B,et al. Bcl-2 expression in higher grade human glioma:A clinical and experimental study[J].Neurooncol,2000,48(3):207-216.
[责任编辑:李蓟龙英文编辑:刘彦哲]
Effects of IL-18 Gene Transfection on Growth of Rats Glioma in Vivo and Apoptosis of Tumor Cells
SONG Yang-ying1,ZANG Jian-jun1,CHENG Tian-jun2
(1.Clinical Laboratory,Hospital of Yutian County,Yutian 064100,Hebei China;2.Oncosurgery Department,Hospital of Yutian County,Yutian 064100,Hebei China)
Abstract:ObjectiveTo analyze the effects of IL-18 transfection on the 9L glioma growth in vitro and the apoptosis of tumor cells.Methods9L/IL-18,9L/LXSN and 9L cells were inoculated into the brain of F344 rat to establish the animal models by the stereotactic technique.The tumorigenicity of different cells was observed,and then the tumorigenic rates were calculated.The cell apoptosis was detected by TUNEL.The apoptosis rate of tumor cells in each group was calculated.The expression of Bax and Bcl-2 in tumor tissues was detected by RT-PCR and Westen Blot.ResultsThe rate of tumor formation in each groups was 100%;TUNEL assay showed that a large number of apoptotic cells were detected in the tumor tissues of the 9L/IL-18 cell group,in which the apoptotic rate was(22.2±1.02)%,significantly higher than that in 9L/LXSN(5.7±0.32)% and 9L(6.4±0.51)% groups(P<0.05);the expression of Bax in the tumor tissues of inoculated 9L/IL-18 cell group was higher than those of the other groups,and the expression of Bcl-2 was lower than those of the other groups.ConclusionBy up regulating the expression of Bax,down regulating the expression of Bcl-2,transfected exogenously IL-18 gene can promote the apoptosis of tumor cells and play an anti-tumor role.
Key words:IL-18;gene transfection;glioma;cell apoptosis;TUNEL;Bax;Bcl-2
作者简介:宋杨英(1982-),女,河北玉田人,主管检验技师,硕士研究生,主要研究方向:免疫学。
中图分类号:R 739.4
文献标识码:A
DOI:10.3969/j.issn.1673-1492.2016.02.002
来稿日期:2015-10-22
