早期创伤性股骨头缺血性坏死兔模型早期治疗分子机制探讨
2016-06-03马朋朋
李 伟,马朋朋,周 超
(1.河北北方学院附属第一医院骨科,河北 张家口 075000;2.河北北方学院,河北 张家口 075000)
早期创伤性股骨头缺血性坏死兔模型早期治疗分子机制探讨
李伟1,马朋朋1,周超2
(1.河北北方学院附属第一医院骨科,河北 张家口 075000;2.河北北方学院,河北 张家口 075000)
摘要:目的探讨早期创伤性股骨头缺血性坏死的分子机制。方法建立早期创伤性股骨头缺血性坏死兔模型,应用免疫组化方法观察股骨头缺血性坏死发生发展过程。结果股骨头缺血性坏死早期血管生成抑制,股骨头内重要组织损伤伴细胞凋亡,同时可见Ⅰ型胶原和Ⅲ型胶原介导的纤维化修复和血管性血友病因子诱生的新生血管。结论早期创伤性股骨头缺血性坏死存在短期的自我恢复,这可能为早期创伤性股骨头缺血性坏死提供一个最佳治疗时机。
关键词:股骨头缺血性坏死;早期创伤;兔模型;骨组织修复;血管再生;细胞凋亡;分子机制
股骨头缺血性坏死(avascular necrosis of the femoral head,ANFH)是由于各种原因导致股骨头血运循环障碍造成的股骨头发生缺血性骨坏死的病理性变化过程。ANFH多见于20~50岁青壮年,并多数累及双侧股骨头,致残率极高。ANFH的发生与创伤、酗酒、激素等多种因素有关,发病机制尚未完全阐明[1-3]。研究发现Ⅰ型胶原蛋白是现有存在于骨和皮肤细胞外基质中最丰富的蛋白质,可通过粗大的纤维维持组织稳定性及参与组织修复;Ⅲ型胶原亦参与组织修复过程[4],其出现时间甚至早于Ⅰ型胶原;血管性血友病因子(von Willebrand factor,vWF)是内皮细胞的标志,可反映血管系统的状况[5];同时,血运循环障碍导致了细胞凋亡这一不可避免的结果,其调控涉及到信号分子与转录因子,如p-JNK、p53等的相互作用。这些分子在ANFH中的相互关系和作用尚不清楚,深入研究这些分子的作用机制助于理解受损骨组织发生的改变,为早期创伤性ANFH持续有效的治疗提供积极参考。
1材料和方法
1.1动物
45只健康成年雄性新西兰兔,平均体质量3 kg,SPF级环境饲养。随机分为5组,对照组5只,对照组不做任何处理,其余40只单方面接受手术,在指定时间处死,术后行影像学、病理学检查(表1)。所有动物均按照美国国立卫生研究院出版的《实验动物护理和使用指南》的规定进行护理。
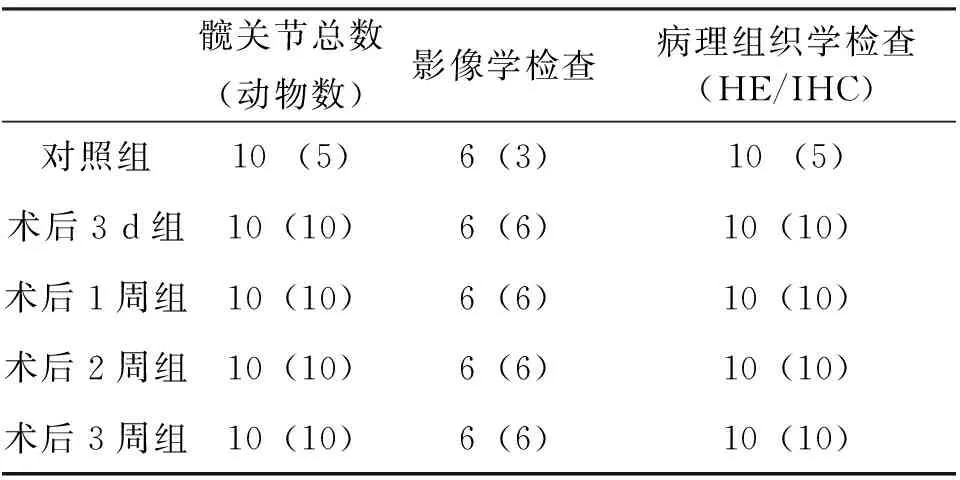
表1 动物分组(n)
1.2手术方法
所有接受手术的动物按30 mg·kg-1体质量静脉注射体积分数为30%的戊巴比妥钠进行麻醉。无菌条件下后外侧切口到达左髋关节,在关节囊处切3 cm切口暴露股骨头。从切口分离包括环状韧带在内的所有软组织附件,从股骨颈基底部截断,缝合髋关节囊边缘以确保分离的股骨头不脱离关节窝。手术伤口用青霉素充分冲洗,然后逐层缝合。所有动物均肌内注射200 000 U青霉素以防感染。术后,所有动物可在笼中自由活动。
1.3影像学检查
动物麻醉后,进行CT和MRI扫描,监测国际骨循环研究会(the association research circulation osseuse,ARCO)制定的ANFH临床分期,ARCO I~II期为早期ANFH,MRI表现缺血区的骨髓水肿,股骨头“双线征”[6]。
1.4病理组织学观察
动物以空气注射法处死,剖取双侧股骨头连同干骺端及股骨,肉眼观察后,取材,置于4%多聚甲醛溶液固定3 d;10% EDTA-PBS缓冲液脱钙,每3天更换脱钙液一次,观察骨标本表面颜色并用物理法测定其脱钙程度,直到满意为止。取材逐级脱水,二甲苯透明,石蜡包埋,切片,然后行苏木素-伊红(hematoxylineosin,HE)染色,光镜观察骨膜、软骨组织、骨小梁、造血组织的变化。随机选定10张HE染色切片,在100倍视野下计数空骨陷窝和骨髓造血细胞。采用链霉亲和生物素试剂盒进行免疫组化检测,Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、p53、vWF和p-JNK的一抗37 ℃孵育1 h,山羊抗鼠IgG二抗孵育30 min,DAB显色。每张切片随机选取10个视野,在200倍视野下测量阳性着色区的积分光密度(IOD)。Image-Pro Plus 6.0软件对图像进行半定量分析,染色阳性率表示为单位面积骨髓或骨小梁中的IOD。
1.5统计学方法
2结果
2.1HE染色
正常股骨头骨膜光滑,软骨细胞排列整齐;骨小梁中的骨细胞丰富、清晰可见,柱状成骨细胞沿骨小梁成群分布;骨髓造血细胞丰富。手术后,骨膜逐渐不完整,软骨部分脱落;骨小梁稀疏、变细,结构紊乱;空骨陷窝增加,骨细胞核固缩;仍然可见梭形成骨细胞排列,但数量渐减;造血功能随时间推移逐渐减弱;血管内皮细胞聚集,血管栓塞出现;部分脂肪细胞失去原有圆形,与邻近脂肪细胞融合;在本次研究结束时,大多数组织细胞死亡并失去正常形态。从手术后d 3开始,股骨头外部有大量间叶细胞浸润,在第2周达到高峰,之后大量细胞死亡;骨小梁间隙中的骨髓成分减少,空骨陷窝显著增加(P<0.05)(图1)。
2.2细胞凋亡调控
p53和p-JNK相互作用、功能上相互补充,协同调节细胞凋亡。正常组织中p53只在某些造血细胞中高表达,成骨细胞和骨细胞不表达。手术后,成骨细胞和大部分造血细胞表达中等水平p53;血管内皮细胞和破骨细胞高表达p53,并且延续到实验结束。p-JNK在正常造血组织中以不同水平广泛表达,但成骨细胞不表达。手术后表达p-JNK的细胞数量增加,包括破骨细胞、部分成骨细胞和骨细胞,且在前3周血管内皮细胞的表达水平便逐渐升高(图2)。
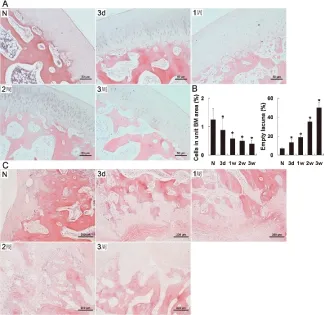
图1 兔创伤性ANFH病理组织学图像和半定量分析
AHE染色,刻度标尺=50 μm;B左边:条形图表示骨髓细胞与骨髓面积的比例;右边:条形图表示空骨陷窝与骨小梁面积的比例;CHE染色显示受损股骨头周围MSCs细胞浸润,刻度标尺=100 μm。N:正常组;3 d:建模后3 d;1周:建模后1周;2周:建模后2周;3周:建模后3周。每张切片至少观察10个视野,与正常组比较﹡P<0.05
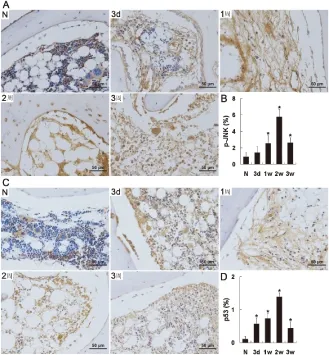
图2 p-JNK和p53免疫组化染色及半定量分析,刻度标尺=50 μm
Ap-JNK免疫组化染色;B条形图表示单位面积骨髓中p-JNK的表达密度;Cp53免疫组化染色;D条形图表示单位面积骨髓中p53的表达密度,N:正常组;3 d:建模后3 d;1周:建模后1周;2周:建模后2周;3周:建模后3周。每张切片至少观察10个视野,与正常组比较﹡P<0.05
2.3骨组织损伤和血管供应
骨小梁和骨髓均表达Ⅰ型胶原蛋白,骨髓腔周围骨小梁的表达比中央略强,提示活化的成骨细胞位置。手术后骨小梁Ⅰ型胶原蛋白的表达水平持续升高,且最终显著高于对照组(P<0.05)。从创伤后第2周起表达Ⅰ型胶原蛋白的骨细胞数量明显增加,但是在第3周表达水平显著降低。相比之下,Ⅰ型胶原蛋白、Ⅲ型胶原蛋白和vWF在骨髓中的表达均在创伤后d 3开始增加,然后持续下降。值得注意的是,骨髓中Ⅰ型胶原蛋白和vWF的表达水平仅在d 3显著高于正常组(P<0.05),此时这两种蛋白细胞分布最广泛。到第3周结束时,vWF明显低于正常组(P<0.05),说明血管阻塞。尽管从d 3开始受损组织Ⅲ型胶原蛋白的表达水平下降,但其表达量自始至终都显著高于正常组织(P<0.05),这在破骨细胞和血管内皮细胞尤为显著(图3)。
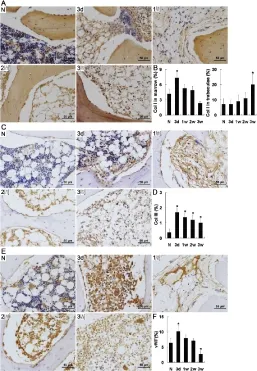
图3 I型胶原、III型胶原和vWF免疫组化染色及半定量分析,刻度标尺=50 μm
AI型胶原免疫组化染色;B左边:条形图表示单位面积骨髓中I型胶原的表达密度;右边:条形图表示单位面积骨小梁中I型胶原的表达密度;CIII型胶原免疫组化染色;D条形图表示单位面积骨髓中III型胶原的表达密度;EvWF免疫组化染色;F条形图表示单位面积骨髓中vWF的表达密度。N:正常组;3 d:建模后3 d;1周:建模后1周;2周:建模后2周;3周:建模后3周。每张切片至少观察10个视野。与正常组比较﹡P<0.05
3讨论
ANFH是一不可逆过程,早期诊断和早期治疗非常关键,建立与临床病程相似的早期ANFH动物模型,对探究ANFH进展的分子机制,进而寻求新的有效的治疗方法具有十分重要的意义。
根据HE染色病理分析结果,组织细胞走向凋亡,与p-JNK、p53表达增加一致。JNK的活化依赖于细胞生存压力,在许多情况下,包括凋亡发生的过程中均参与p53的活化[7]。作为肿瘤抑制基因,p53介导一系列细胞反应,包括抑制受损细胞生长和细胞内压力引起的细胞凋亡。结果显示,造血和骨组织中大量细胞死亡,导致本研究检测的大部分分子最终减少。
本研究发现d 3骨髓中Ⅰ型胶原蛋白出现峰值水平,这与之前所报道的全髋关节置换术后第3周患者血清中的趋势相一致,表明在清除创伤产生的组织碎片的过程中破骨细胞活性升高,并且与1年后患者的骨密度降低密切相关(r=-0.42,P=0.003)[8]。在两项研究中峰值水平出现的具体时间的差异可能是由于检测位置的不同。此外,受损软骨中Ⅰ型胶原蛋白的表达提示软骨退化时组织纤维化修复。在这项研究中,我们没有发现软骨中有Ⅰ型胶原表达,表明疾病处于早期,软骨尚未退化。在组织修复的早期阶段,Ⅲ型胶原常高度表达,比Ⅰ型胶原更快地形成聚合物以填充受损组织,促进组织修复。在本研究中,受损组织Ⅲ型胶原的表达水平自始至终都显著高于正常组织,表明细胞和组织构成的状况发生改变。vWF是在人血管内皮细胞、巨核细胞、血小板中发现的血浆糖蛋白,主要存在于内皮细胞的Weibel-Palade小体中,是内皮细胞的特有标志[9]。创伤后d 3这3个分子均出现高峰,提示出现一个快速的组织修复,与爬行替代一致,涉及环绕死骨进行血管重建和骨组织修复。但是,vWF表达水平的急剧降低表明血管阻塞,加上细胞活力降低,损伤状况不能逆转,疾病终将会发展到软骨塌陷的程度。
在本研究中,我们建立了早期创伤性ANFH兔模型。HE染色和p53、p-JNK表达显示ANFH从创伤后d 3开始发生,同时Ⅰ型胶原、Ⅲ型胶原和vWF的高度表达提示创伤后早期股骨头存在自我修复,合理利用这一关键时机将提高早期治疗ANFH的疗效。
参考文献:
[1]Mont M,Jones L,Hungerford D.Nontraumatic osteonecrosis of the femoral head:Ten years later[J].J Bone Joint Surg Am,2006,88(5):1117-1132.
[2]Ito H,Matsuno T,Omizu N,et al.Mid-term prognosis of non-traumatic osteonecrosis of the femoral head[J].J Bone Joint Surg Br,2003,85(6):796-801.
[3]Jones L C,Hungerford D S.The pathogenesis of osteonecrosis[J].Instr Course Lect,2007,56(1):179-196.
[4]Broughton G 2nd,Janis J,Attinger C.The basic science of wound healing[J].Plast Reconstr Surg,2006,117(7Suppl):12S-34S.
[5]Zanetta L,Marcus S,Vasile J,et al.Expression of von Willebrand factor,an endothelial cell marker,is up-regulated by angiogenesis factors:A potential method for objective assessment of tumor angiogenesis[J].Int J Cancer,2000,85(2):281-288.
[6]Gardeniers J.Report of the committee of staging and nomenclature[J].ARCO News Letter,1993,5(2):79-82.
[7]Gong X,Wang M,Tashiro S,et al.Involvement of JNK-initiated p53 accumulation and phosphorylation of p53 in pseudolaric acid B-induced cell death[J].Exp Mol Med,2006,38(4):428-434.
[8]Arabmotlagh M,Sabljic R,Rittmeister M.Changes of the biochemical markers of bone turnover and periprosthetic bone remodeling after cemented hip arthroplasty[J].J Arthroplasty,2006,21(1):129-134.
[9]Barkalow F,Goodman M,Mayadas T.Cultured murine cerebral microvascular endothelial cells contain von Willebrand factor-positive Weibel-Palade bodies and support rapid cytokine-induced neutrophil adhesion[J].Microcirculation,1996,3(1):19-28.
[责任编辑:李蓟龙英文编辑:刘彦哲]
Molecular Mechanism in Early Treatment of Early Stage Traumatic Avascular Necrosis of Femoral Head in a Rabbit Model
LI Wei1,MA Peng-peng1,ZHOU Chao2
(1.Department of Orthopedics,The First Affiliated Hospital,Hebei North University,Zhangjiakou,Hebei 075000,China;2.Hebei North University,Zhangjiakou,Hebei 075000,China)
Abstract:ObjectiveTo study the molecular mechanism of the early stage traumatic avascular necrosis of femoral head.MethodsWe established a rabbit early stage traumatic avascular necrosis of femoral head model.The process of avascular necrosis of femoral head was observed by immunohistochemical staining.ResultsIn early stage traumatic avascular necrosis of femoral head,the suppression of angiogenesis,significant tissue damage within the femoral head and accompanied cell apoptosis were observed in osteonecrosis of femoral head.We also observed the repairative fibrosis mediated by type I collagen and type III collagen and neovascularization induced by von Willebrand factor.ConclusionSuch a short-term restoration may provide an optimal timing for therapy of early stage traumatic osteonecrosis of femoral head in clinic application.
Key words:avascular necrosis of femoral head;early stage traumatic model;rabbit model;bone tissue repair;angiogenesis;apoptosis;molecular mechanism
DOI:10.3969/j.issn.1673-1492.2016.04.004
中图分类号:R 641
文献标识码:A
作者简介:李伟(1977-),男,北京昌平人,硕士,主治医师,主要研究方向:创伤骨科。
来稿日期:20160314
