遗传印记基因PEG10在结肠癌中的表达及意义
2016-06-01谢军培张玉琴林园园朱小三沈许德傅育卡桑巧芳戴益琛
谢军培, 张玉琴, 林园园, 朱小三, 沈许德, 傅育卡, 桑巧芳, 戴益琛
中国人民解放军第一七四医院消化内科,福建 厦门 361003
遗传印记基因PEG10在结肠癌中的表达及意义
谢军培, 张玉琴, 林园园, 朱小三, 沈许德, 傅育卡, 桑巧芳, 戴益琛
中国人民解放军第一七四医院消化内科,福建 厦门 361003
目的 研究遗传印记基因PEG10在结肠癌、癌旁组织、正常结肠组织中的表达及意义。方法 收集中国人民解放军第一七四医院2015年1月-2015年9月40例结肠癌、癌旁组织,20例正常结肠组织标本,通过免疫组织化学及蛋白印迹法检测PEG10的细胞定位及其表达差异。结果 PEG10细胞主要分布于细胞质,在结肠癌中呈过表达,其表达明显高于癌旁组织、正常结肠组织,差异有统计学意义(P<0.01)。结论 PEG10可能参与结肠癌发生、发展,但其具体作用机制仍需进一步探讨。
印记基因;PEG10;结肠癌
大肠癌是世界第三大常见肿瘤,每年可致600 000人死亡[1]。尽管近几年结肠癌死亡率有下降趋势,但仍占癌症相关死亡的10%[2]。结肠癌早期症状并不明显,发现时一般处于晚期,当结肠癌发生远处转移时,其5年存活率只有近10%[3]。虽然目前结肠癌早期已有较多有效治疗措施及化疗方案,但对于处于癌症进展期患者,化疗的疗效并不是特别理想。因此新的早期诊断措施及更有效的治疗方案仍需要我们进一步研究及探讨。PEG10定位于人染色体7q21,是一个父系表达的遗传印记基因。该基因编码的蛋白与逆转录病毒gag-pol蛋白具有高度同源性,包括两个重复的开放阅读框,并通过逆转录病毒介导的核糖体译移码机制翻译出两种蛋白,它们参与哺乳动物肿瘤的发生,印记基因PEG10在肝癌中过表达,其敏感率甚至高于甲胎蛋白(AFP)[4],然而PEG10在结肠癌中的研究甚少,本实验主要探讨PEG10在结肠癌中的表达及意义。
1 材料与方法
1.1 实验材料 结肠癌组织随机抽取2015年1月-2015年9月于解放军第174医院外科手术切除标本40例,正常结肠黏膜标本取自结肠镜下活检标本20例,上述标本均经病理明确诊断,癌组织取自肿瘤中心处,癌旁组织取自同一患者距肿瘤边缘5 cm的组织。术前均无其他部位原发肿瘤,术前未行放、化疗和其他药物治疗。标本均经甲醛固定、石蜡包埋后用于免疫组化染色。其中1例结肠癌与癌旁、正常黏膜标本离体后立即分别取0.5 cm组织置于液氮保存,用于提取蛋白。
1.2 主要试剂及仪器 鼠抗人PEG10多克隆抗体(1∶150)和鼠抗人GAPDH多克隆抗体(1∶100)均购自美国Proteintech公司;兔二抗购自Proteintech公司;第二代通用型两步法(非生物素)检测试剂盒(PV-9000)及DAB显色试剂盒均购自北京中杉金桥公司。应用德国病理图像分析仪(Pathological Image Analysis System,DMR+550)进行观察和显微照相。
1.3 免疫组织化学(immunohistochemistry,IHC)染色 结肠癌、正常结肠黏膜石蜡标本4 μm厚连续切片,常规脱蜡水化;3%H2O2去离子水孵育10 min,溶液阻断内源性过氧化物酶;pH 6.0柠檬酸缓冲液进行微波炉抗原修复10 min,正常山羊血清工作液免封闭;滴加相应稀释的一抗工作液,孵育4 ℃过夜,PBS液冲洗2 min×3次;37 ℃孵育20 min,PBS液冲洗2 min×3次;37 ℃孵育20~30 min,PBS液冲洗2 min×3次;DAB染色,复染、脱水、透明、封固。采用半定量分析,显微镜下随机抽取5个视野,根据着色范围、着色强度判定染色结果。阳性细胞数<25%记1分,25%~50%记2分,51%~75%记3分,>75%记4分;阳性强度分为1(弱)、2(中)、3(强)分。两项评分相乘即为阳性分,取5个视野的平均阳性积分,≥2分为阳性。
1.4 蛋白印迹法(Western blotting) RIPA裂解液提取组织蛋白,采用二喹啉甲酸法(BCA)蛋白浓度测定,加入上样缓冲液煮沸变性,待冷却后上样,采用恒压电泳(在样品于浓缩胶时调电压至80 V,进入分离胶之后将电压调至120 V)。以350 mA恒流低温电转1 h左右,将凝胶中的蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。将电转后的PVDF膜浸泡于5%脱脂奶粉中,室温封闭1 h。一抗4 ℃孵育过夜(PEG10、GAPDH稀释浓度均为1∶1 000)。TBST洗膜后二抗常温孵育1 h。TBST再次洗膜,电化学(Electro-Chemi-Luminescence,ECL)发光,显影。
1.5 统计学分析 采用SPSS 13.0软件进行统计学分析,定性资料的比较采用卡方检验,非参数检验采用Wilcoxon秩和检验。
2 结果
2.1 IHC分析结果 PEG10蛋白广泛存在于细胞质,在细胞核中分布较少见(见图1B)。而PEG10蛋白表达水平实验组明显高于对照组(见图1A、1B);本实验收集的40例结肠癌组织(实验组)标本中有30例阳性(75%),而对照组的阳性率只有15%(见表1);PEG10的表达水平可用阳性染色评分来评估。实验组PEG10的阳性染色率明显高于对照组,差异具有统计学意义(见图2,P<0.01)。

图1 正常结肠黏膜及结肠癌中的PEG10蛋白表达(DAB) A:正常结肠黏膜;B:结肠癌
Fig 1 The expression of PEG10 protein in normal colon tissue and colon cancer (DAB) A: normal colon tissue; B: colon cancer
表1 结肠癌与正常结肠黏膜PEG10蛋白表达的阳性率比较
Tab 1 Expression of positive rate of PEG10 in colon cancer and normal colon tissue
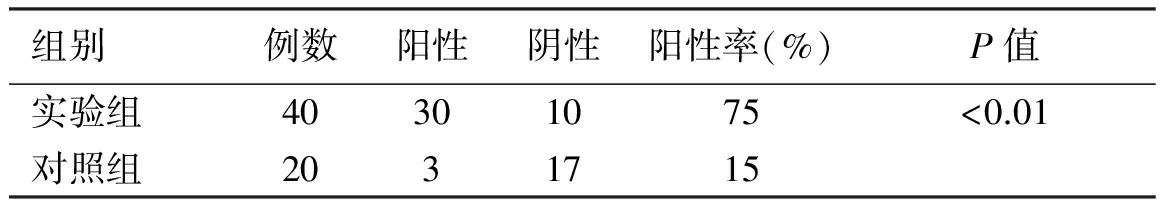
组别例数阳性阴性阳性率(%)P值实验组40301075<0.01对照组2031715

注:*P<0.01。
图2 结肠癌与正常结肠黏膜PEG10蛋白表达的阳性染色积分比较
Fig 2 Expression of positive staining integral of PEG10 in colon cancer and normal colon tissue
2.2 Western blotting实验分析 通过提取同一例标本结肠癌组织、癌旁组织、正常结肠组织的总蛋白,验证遗传印记基因PEG10的表达,结果证实了在结肠癌中PEG10蛋白的表达明显高于癌旁组织,而正常结肠组织表达量很少,甚至无(见图3)。

图3 结肠癌、癌旁及正常结肠组织PEG10蛋白的表达
Fig 3 Expression of PEG10 protein in colon cancer, adjacent mucosa, normal colon tissue
3 讨论
父系表达基因PEG10是2001年Ono等[5]发现的,只在父方表达,其母方表达缺失。PEG10位于人类染色体7q21,其来源于Ty3/Gypsy反转录转座子家族,编码的蛋白与逆转录病毒gag-pol蛋白相似,国外研究[6]表明:PEG10基因是原癌基因C-myc的靶基因,定位于细胞质,但具有跨膜作用,该作用与肿瘤发生关系密切。本实验证实其蛋白大部分定位于细胞质。目前研究发现PEG10在人类多种肿瘤中均过表达,如白血病、乳腺癌、前列腺癌、胰腺癌、胆囊癌、肝癌等[7-9]。研究发现PEG10在肿瘤中的作用机制主要有以下几种:(1)其可以通过促进原癌基因c-MYC的表达促进肿瘤细胞的增殖[7];(2)可通过阻断TGF-β信号转导抑制肿瘤细胞的凋亡[10];(3)通过阻断细胞凋亡因子SIAH1对肿瘤细胞起到抗凋亡作用[11]。
结肠肿瘤是结肠黏膜在遗传基因及外源性因素作用下逐步演变而成的。目前多项研究显示不同肿瘤中可见不同印记基因改变。印记基因胰岛素样生长因子2(IGF-2)与PEG10同为父系表达基因,有研究证实在大部分结肠肿瘤中可检测到IGF-2印记基因缺失,其可通过甲基化使IGF-2呈过度表达状态,通过促进肿瘤细胞增殖、分化,促进结肠肿瘤发生、发展[12-13]。本研究也证实印记基因PEG10在结肠肿瘤中呈高表达状态,其基因在肿瘤组织中表达高于癌旁组织,在正常组织表达甚少。因此PEG10可能参与结肠肿瘤的发生、发展,但其机制尚未明确,而在肿瘤发生、发展过程中PEG10与IGF-2是否有协同或互相调控作用仍需我们进一步探讨研究。
综上所述,本研究表明印记基因PEG10在结肠肿瘤中过度表达,其主要定位于细胞质,PEG10印记缺失可能参与结肠肿瘤发生、发展,具有作为更有效的结肠肿瘤诊断标记物及基因治疗新靶点的潜力。然而其具体作用机制尚未明确,有待进一步研究证实。
[1]Bonnet M, Buc E, Sauvanet P, et al. Colonization of the human gut by E.coli and colorectal cancer risk [J]. Clin Cancer Res, 2014, 20(4): 859-867.
[2]Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013 [J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[3]O’Connell JB, Maggard MA, Liu JH, et al. Are survival rates different for young and older patients with rectal cancer? [J]. Dis Colon Rectum, 2004, 47(12): 2064-2069.
[4]常莹, 陶璐薇, 陈孝平, 等. 肝癌组织中遗传印记基因PEG10表达的特异性及其意义[J]. 世界华人消化杂志, 2005, 13(12): 1408-1411. Chang Y, Tao LW, Chen XP, et al. Specificity and significance of expression of imprinted gene PEG10 in hepatocellular carcinoma [J].World Chin J Digestol, 2005, 13(12): 1408-1411.
[5]Ono R, Kobayashi S, Wagatsuma H, et al. A retrotransposon-derived gene, PEG10, is a novel imprinted gene located on human chromosome 7q21 [J]. Genomics, 2001, 73(2): 232-237.
[6]Volff J, Körting C, Schartl M. Ty3/Gypsy retrotransposon fossils in mammalian genomes: did they evolve into new cellular functions? [J]. Mol Biol Evol, 2001, 18(2): 266-270.
[7]Li CM, Margolin AA, Salas M, et al. PEG10 is a c-MYC target gene in cancer cells [J]. Cancer Res, 2006, 66(2): 665-672.
[8]Liu DC, Yang ZL, Jiang S. Identification of PEG10 and TSG101 as carcinogenesis, progression, and poor-prognosis related biomarkers for gallbladder adenocarcinoma [J]. Pathol Oncol Res, 2011, 17(4): 859-866.
[9]Tsou AP, Chuang YC, Su JY, et al. Overexpression of a novel imprinted gene, PEG10, in human hepatocellular carcinoma and in regenerating mouse livers [J]. J Biomed Sci, 2003, 10(6 Pt 1): 625-635.
[10]Lux A, Beil C, Majety M, et al. Human retroviral gag-and gag-pol-like proteins interact with the transforming growth factor-beta receptor activin receptor-like kinase 1 [J]. J Biol Chem, 2005, 280(9): 8482-8493.
[11]Okabe H, Satoh S, Furukawa Y, et al. Involvement of PEG10 in human hepatocellular carcinogenesis through interaction with SIAH1 [J]. Cancer Res, 2003, 63(12): 3043-3048.
[12]Cui H, Cruz-Correa M, Giardiello FM, et al. Loss of IGF2 imprinting: a potential marker of colorectal cancer risk [J]. Science, 2003, 299(5613): 1753-1755.
[13]Kaaks R, Stattin P, Villar S, et al. Insulin-like growth factor-II methylation status in lymphocyte DNA and colon cancer risk in the Northern Sweden Health and Disease cohort [J]. Cancer Res, 2009, 69(13): 5400-5405.
(责任编辑:马 军)
Significance and expression of genetic imprinted gene PEG10 in colon cancer
XIE Junpei, ZHANG Yuqin, LIN Yuanyuan, ZHU Xiaosan, SHEN Xude, FU Yuka, SANG Qiaofang, DAI Yichen
Department of Gastroenterology, the 174th Hospital of PLA, Xiamen 361003, China
Objective To investigate the expression and significance of genetic imprinted gene PEG10 in colon cancer, adjacent mucosa, normal colon tissue. Methods Forty cases of surgically specimens and 20 cases of normal tissue specimens were collected. PEG10 expression in colon cancer, normal colon tissue was determined by immunohistochemistry (IHC). Differential expression of PEG10 protein in colon cancer, adjacent cancer, normal colon tissue was observed by Western blotting. Results PEG10 cells were located in the cytoplasm of colon cancer cell. PEG10 was overexpression in colon cancer, and was absent in normal colon tissue. The significant difference was observed in PEG10 positivity rate among adjacent mucosa, normal colon tissue (P<0.01). Conclusion PEG10 may be involved in the development of colon cancer. However, the mechanisms of PEG10 in colon cancer need further studied.
Imprinted gene; PEG10; Colon cancer
10.3969/j.issn.1006-5709.2016.10.023
厦门市科技计划项目[遗传印记基因PEG10在大肠癌及癌前病变中的印记缺失研究(2014S0479)]
谢军培,本科,主治医师,研究方向:消化道早癌ESD术。E-mail:xiejp97214@163.com
戴益琛,博士,主任医师,研究方向:消化系统肿瘤诊治。E-mail:dyichen@sina.com
R735.3+5
A
1006-5709(2016)10-1168-03
2016-01-23
