一株产ε-聚赖氨酸的白色链霉菌遗传转化体系
2016-04-26孙朱贞冯小海许召贤曹长虹
孙朱贞,冯小海,许召贤,曹长虹,徐 铮,徐 虹
(1. 南京工业大学材料化学工程国家重点实验室,江苏南京210009;
2. 南京工业大学食品与轻工学院,江苏南京211800)
一株产ε-聚赖氨酸的白色链霉菌遗传转化体系
孙朱贞1,2,冯小海1,2,许召贤1,2,曹长虹1,2,徐铮1,2,徐虹1,2
(1. 南京工业大学材料化学工程国家重点实验室,江苏南京210009;
2. 南京工业大学食品与轻工学院,江苏南京211800)
摘要:为了更好地研究ε-聚赖氨酸(ε-PL)生物合成的分子机制以及构建ε-PL高产基因工程菌株,拟建立一株ε-PL产生菌株Streptomyces albulus PD-1的遗传转化体系。通过对培养基类型、孢子预萌发处理、培养基中Mg(2+)浓度等条件进行考察,以Escherichia coli ET12567(pUZ8002)为供体菌,成功地将pIB139质粒导入S. albulus PD-1中。结果表明:质粒转化效率达到(3±0.4)× 10(-6)个接合转化子/受体。接合子传代实验和PCR结果发现,pIB139质粒能够稳定整合在S. albulus PD-1染色体的attB位点上。本研究建立了一株ε-PL生产菌株的遗传转化体系,为从分子水平上研究ε-PL的合成及ε-PL高产菌株的构建奠定了基础。
关键词:ε-聚赖氨酸;白色链霉菌;遗传转化体系;pIB139
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是由L-赖氨酸的α-氨基和ε-羧基通过酰胺键连接而成的同型聚氨基酸。由于其良好的抑菌性和生物安全性,ε-PL已经作为一种天然的食品及化妆品防腐剂被多个国家批准使用[1-2]。2014年我国批准ε-PL及其盐酸盐作为新型食品添加剂可以在食品行业中使用[3],极大地推动了国内ε-PL的生产和研究工作。
在工业上,ε-PL主要是通过放线菌发酵获得。自1977年第1株ε-PL产生菌株被筛选出来,研究者们通过新型菌株筛选、高效菌株诱变、发酵体系优化等措施大大提高了微生物合成ε-PL的效率[4-6],但是关于ε-PL合成机制的研究却较少。究其原因是缺少ε-PL相关产生菌株的遗传转化体系。遗传转化体系是对菌株进行基因鉴定分析、代谢途径改造和其他遗传操作的前提。2000~2006年期间,Pandey等[5,7-11]利用基于S.albulusIFO14147内源质粒复制子构建的复制型质粒建立了适用于S.albulusIFO14147的接合转移体系,并借助此遗传转化体系进行了ε-PL的合成机制探索。但由于此工作是基于S.albulusIFO14147内源质粒复制子展开的,并不能为其他ε-PL产生菌株所借用。尽管近年来多个ε-PL研究小组指出ε-PL产生菌株遗传转化体系构建的重要性[12-14],但是由于放线菌丝状菌体形态、较厚的细胞壁以及较长的生长周期等特点,未见有其他关于ε-PL生产菌株遗传转化体系及其分子改造的报道[15-18]。
目前链霉菌常用的遗传转化体系有3种:原生质体转化、电转化和接合转移。在此3种方法中,接合转移由于其操作简便、转化效率高、稳定性好而被应用于许多链霉菌中。根据相关报道表明,不同链霉菌进行接合转移的培养基是不同的,例如,方志锴等[19]研究金色链霉菌遗传转化体系时发现MS培养基为其最理想的接合转移培养基; Park等[20]发现ISP-4是S.mobaraensisATCC29032最适接合转移培养基,而以AS-2和ISP-2作为接合转移培养基时无S.mobaraensisATCC29032接合子长出;朱云霞等[21]发现ISP-4是抗生素Bagremycin生产菌Streptomycessp. Tü4128最适的接合转移培养基。因此,本文中,笔者尝试采用接合转移的方法应用于遗传转化体系的建立,并尝试上述几种培养基,最终选择转化效率最高的培养基,作为本实验的最适培养基。在此基础上对实验过程中各条件进行优化,以达到最高的转化效率。
1材料与方法
1.1实验材料
1.1.1菌株与质粒
ε-PL高产菌株S.alublusPD-1,由徐虹老师课题组筛选、诱变获得,保藏于中国典型培养物保藏中心,保藏号为CCTCC M2011043。pIB139质粒是由pSET152质粒发展而来的大肠杆菌-链霉菌穿梭型质粒,其中包含红霉素抗性基因强启动子、pUC18复制子、阿泊拉霉素抗性基因以φ31的整合酶基因和整合位点。E.coliET12567(pUZ8002)为接合转移供体菌。pIB139质粒和E.coliET12567(pUZ8002)菌株均由武汉大学瞿旭东老师馈赠。
1.1.2培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,固体培养基加20 g/L琼脂。
胰蛋白胨大豆肉汤(TSB)培养基(g/L):TSB 30,购于Oxoid公司。
接合转移用培养基有MS培养基(g/L):甘露醇20,大豆粉20,琼脂20。AS-1培养基(g/L):酵母粉10,L-丙氨酸0.2,L-精氨酸0.5,可溶性淀粉5,NaCl 2.5,Na2SO410,琼脂20;pH 7.5。ISP-2培养基(g/L):酵母粉4,麦芽提取物10,葡萄糖4,琼脂20。ISP-4培养基(g/L):可溶性淀粉10,(NH4)2SO42, MgSO4·7H2O 2,CaCO32,NaCl 1,K2HPO41,ZnSO41,FeSO4·7H2O 1,MnCl21,琼脂20;pH 7.2。所有接合转移用固体培养基均添加10 mmol/L的MgCl2。
1.2实验方法
1.2.1S.albulusPD-1菌株对抗生素的敏感性测试
为了确定用于S.albulusPD-1菌株进行遗传操作的选择标记,笔者考察S.albulusPD-1对阿泊拉霉素、卡那霉素、氨苄青霉素、氯霉素、硫链丝菌素、萘啶酮酸等6种常用抗生素的抗性水平。试验中分别配制了含0、5、10、25、50 和100 μg/mL上述抗生素的MS平板。之后将200 μL含有约108个S.albulusPD-1的孢子悬浮液均匀涂布于平板上,30 ℃培养7 d后对平板上菌落长出情况进行统计,确定S.albulusPD-1对各种抗生素的敏感性。
1.2.2接合转移
接合转移方法参照链霉菌操作手册,且进行了适当的优化。首先将pIB139质粒通过热激转化法转入E.coliET12567(pUZ8002)中,得到供体菌株E.coliETl2567(pUZ8002,pIB139)。挑取E.coliET12567(pUZ8002,pIB139)单菌落接种在50 mL LB培养基(含有50 μg/mL的阿泊拉霉素、卡那霉素和氯霉素)中,37 ℃培养至OD600达到0.5左右,离心收集菌体。使用同等体积的新鲜LB培养基洗涤菌体2次,以除去菌体上附着的抗生素,将洗涤好的供体菌悬浮于0.5 mL新鲜LB培养基中待用。同时,将事先冻藏的S.albulusPD-1的孢子(约108个)悬浮于TSB培养基中,然后经过热激处理诱导孢子萌发后悬浮于0.5 mL新鲜LB培养基中。最后,将处理好的E.coliET12567(pUZ8002,pIB139)和S.albulusPD-1孢子混合均匀分别涂布于MS、AS-1、ISP-2、ISP-4固体培养基中,30 ℃培养15~18 h后,将1 mL含有阿泊拉霉素和萘啶酮酸(质量浓度分别为50和25 μg/mL)的无菌水覆盖,以杀灭平板上的大肠杆菌和未发生质粒转化的S.albulusPD-1。30 ℃培养7 d后统计平板上接合子菌落长出情况。
2结果与讨论
2.1S.albulusPD-1菌株对抗生素的敏感性测试
表1为S.albulusPD-1菌株对抗生素的敏感性试验结果。由表1可知:S.albulusPD-1对硫链丝菌素和阿泊拉霉素非常敏感,分别在质量浓度为5和10 μg/mL时即可完全抑制S.albulusPD-1在MS平板上的生长;对卡那霉素、氨苄青霉素、氯霉素表现出较强的抗性,在100 μg/mL的平板上仍有少量S.albulusPD-1菌落长出。鉴于此,硫链丝菌素和阿泊拉霉素的抗性基因可以作为S.albulusPD-1进行遗传操作的选择标记,以建立其遗传转化体系。本研究中选择的质粒是含有阿泊拉霉素抗性基因和φ31整合酶基因的大肠杆菌-链霉菌穿梭质粒pIB139。萘啶酮酸是链霉菌属间接合转移过程中常用的一种可完全抑制供体菌(大肠杆菌)生长的化学药品,因此在选择用于S.albulusPD-1菌株进行遗传操作选择标记的同时也考察了S.albulusPD-1对萘啶酮酸的敏感性,最终发现50 μg/mL的萘啶酮酸可抑制部分S.albulusPD-1的生长,而在25 μg/mL萘啶酮酸时S.albulusPD-1即可较好的生长,因此在接合转移过程完成后,选定萘啶酮酸的工作浓度为25 μg/mL,可以高效地抑制供体大肠杆菌的生长而对S.albulusPD-1的生长没有影响。
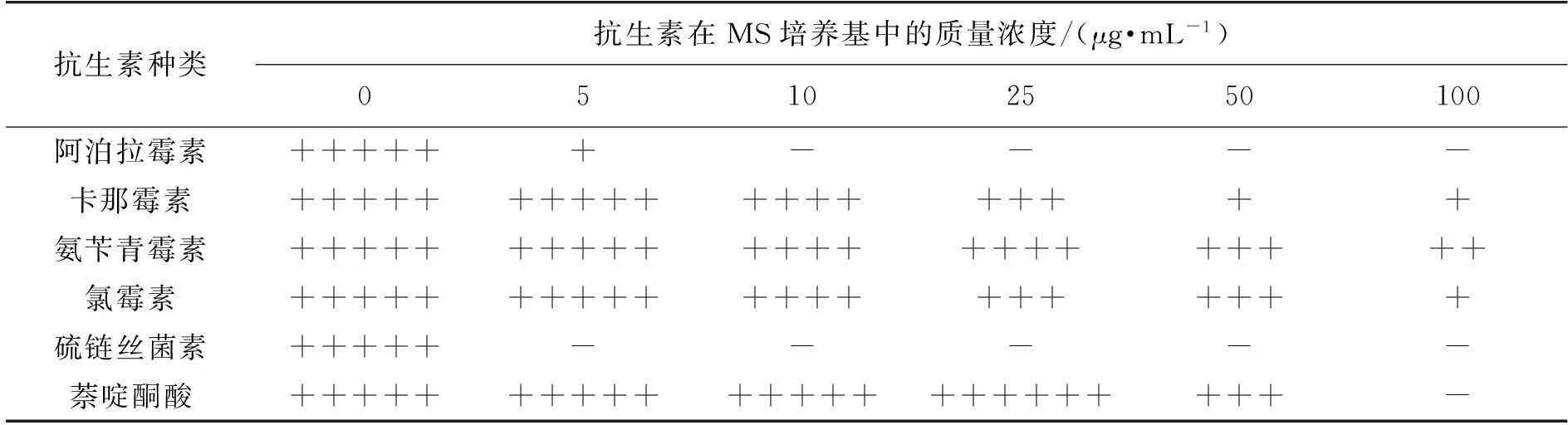
表1 S. albulus PD-1菌株对不同抗生素的抗性
2.2培养基类型对S.albulusPD-1接合转移效率的影响
表2为不同培养基对S.albulusPD-1的接合转移效率的影响结果。
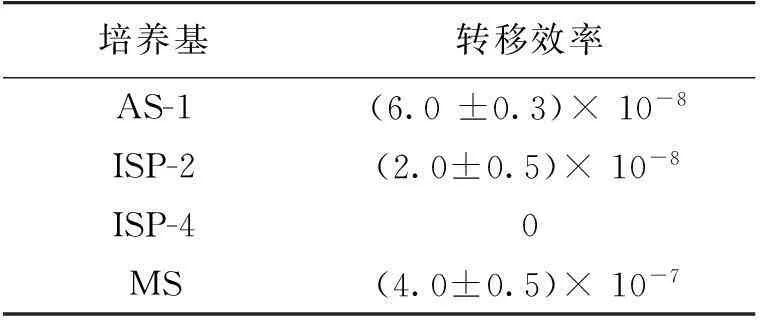
表2 培养基类型对接合转移效率的影响
由表2可知,固体培养基种类对S.albulusPD-1的接合转移效率具有很大影响。使用MS培养基接合转移时的效率最高,为(4.0±0.5)×10-7,而ISP-4作为接合转移培养基并没有转化子长出。因此,选定MS培养基为S.albulusPD-1接合转移时使用的培养基。
2.3孢子热激处理对S.albulusPD-1接合转移效率的影响
除了培养基的选择,对受体菌孢子进行热激处理能够在一定程度上提高接合转移的效率[19,21-22]。因为链霉菌孢子成熟后细胞壁较厚,不易与大肠杆菌发生接合转移;但经过热激处理后能够促使孢子快速萌发,进而能够提高接合转移的效率。根据链霉菌孢子常用热激温度,选取30~60 ℃下对孢子处理不同的时间来研究热激处理对接合转移效率的影响,结果见图1。由图1可知,在孢子进行50 ℃热激处理10 min时接合转移效率最佳。太高和太低的热激温度均不利于S.albulusPD-1接合转移的进行,可能是由于太高的热激温度会对孢子造成损伤而太低的热激温度下孢子萌发不完全。
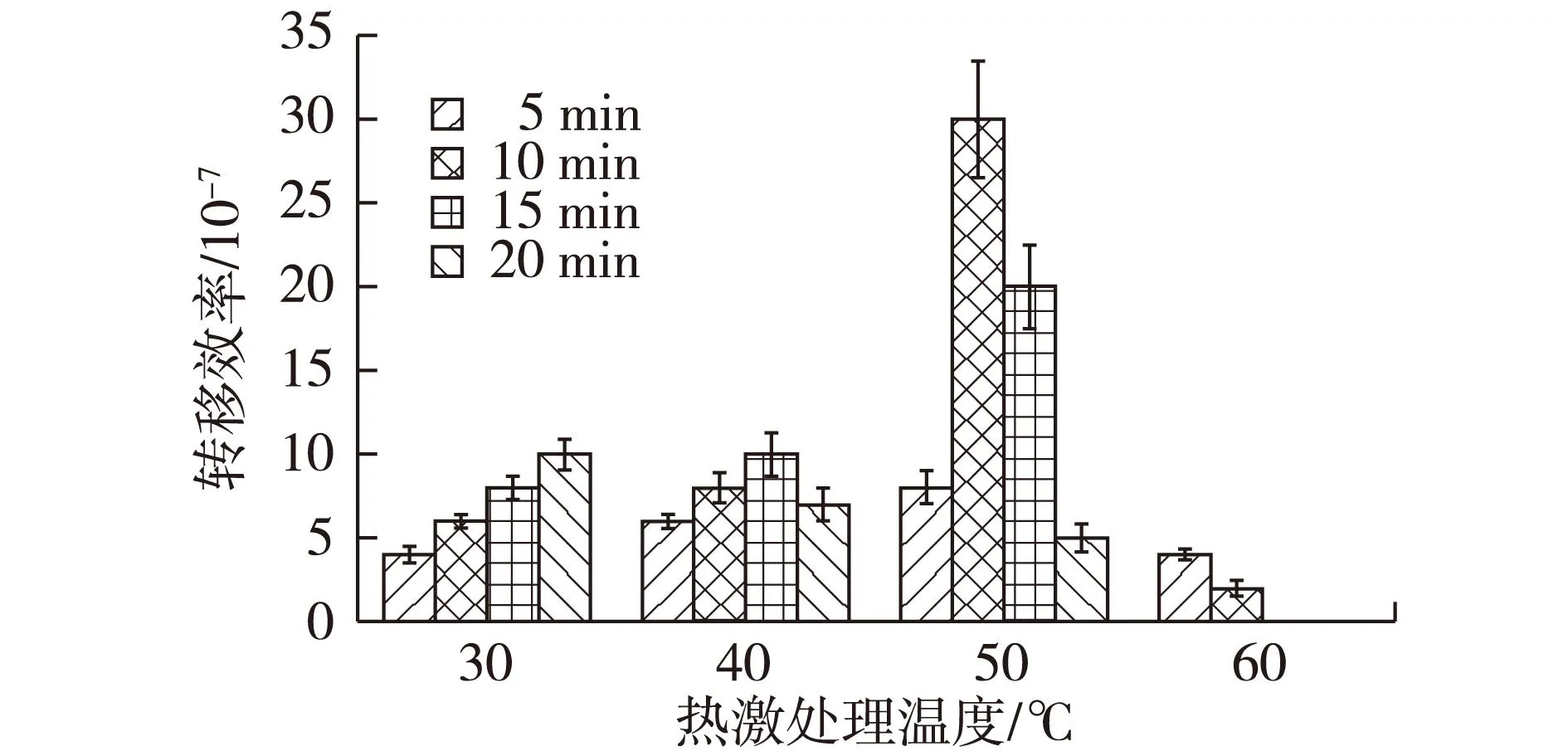
图1 孢子热激处理温度对S. abulus PD-1 接合转移效率的影响Fig.1 Heat shock treatment of spores on the trans- conjugation efficiency of S. albulus PD-1
2.4其他处理条件对接合转移效率的影响
除培养基种类和热激处理条件以外,培养基中MgCl2的浓度和供体菌/受体菌的比例同样对接合转移效率有着重要的影响。因此,后续对接合转移培养基中不同MgCl2的浓度(5、10、20、40、60和80 mmol/L)进行试验,发现初始条件的培养基中含10 mmol/L MgCl2时接合转移效率最高。同样,改变供体菌和受体菌的比例也未进一步提高接合转移的效率。最终以S.albulusPD-1孢子作为受体菌,50 ℃热激处理10 min,使用含有10 mmol/L MgCl2的MS培养基进行接合转移,其转化效率最高,为(3.0±0.4)×10-6(图2)。此外,抗生素覆盖时间也对接合转移效率同样影响显著:就本实验而言,16~18 h覆盖效果最佳;时间少于16 h,接合转移不完全;时间长于18 h,由于菌丝体大量生长,工作浓度的抗生素则无法完全抑制未发生接合转移的S.albulusPD-1生长。
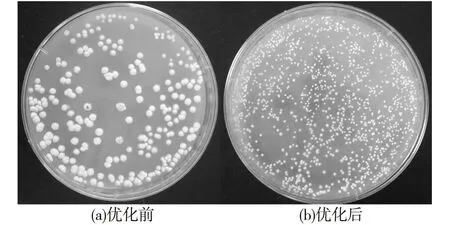
图2 优化前和优化后S. albulus PD-1 接合子在平板上的生长情况Fig.2 Transformation efficiency of conjugational transfer before optimization and after optimization
2.5pIB139质粒在S.albulusPD-1菌株中的稳定性测试
为了检测pIB139质粒在S.albulusPD-1菌株中的稳定性,将转化子接种到不含抗生素的MS培养基中培养5 d,再转接到新的不含抗生素的MS培养基中。转接10代后,随机挑选100个单菌落分别转接到含有阿泊拉霉素的MS平板上,结果这些单菌落全部可以在含有阿泊拉霉素的MS平板上生长。该实验表明pIB139质粒在S.albulusPD-1中稳定存在,并未发生质粒丢失的情况。Hamano等[11]在此前的研究中截取S.albulusIFO14147内源质粒pNO33的复制子,并基于此复制子构建了一系列在适用于S.albulusCR1(内源质粒pNO33被消除的S.albulusIFO14147菌株)的复制型质粒。但是由于游离质粒的不稳定性,在使用该质粒的过程中需要添加25 μg/mL新霉素来维持质粒的存在,若投入工业化生产中, 10 t的发酵罐则需要添加175 g的新霉素(按装液量70%计算),而按照目前的市场价格,生产成本将增加714元;且若后期分离不当,则会造成ε-PL产品的抗生素污染,将无法作为食品防腐剂应用到食品生产中。pIB139质粒能稳定整合在S.albulusPD-1染色体上,因此使用pIB139质粒对S.albulusPD-1基因组进行修饰则可避免相应抗生素的使用,节约生产成本,更适用于工业菌株规模化生产。
2.6pIB139在S.albulusPD-1中整合位点的确定
pIB139属于链霉菌基因整合型质粒,不能单独存在于细胞质中,而是通过整合酶和attP位点整合到链霉菌基因组的attB位点上。目前已发现多个链霉菌的attB位点,并且该位点多存在于染色体缩合蛋白或者匹林类似蛋白(SCO3798)中[23]。通过对S.albulusPD-1基因组序列的分析,发现了1个SCO3798相似蛋白(图3(a))。为了进一步验证此位点即为S.albulusPD-1中attB插入位点,以此位点两翼的核苷酸序列设计引物,进行PCR,获得了pIB139质粒的全部碱基以及部分attB序列(结果未列出)。这个实验结果表明pIB139质粒成功地插入到了S.albulusPD-1染色体的attB位点上(图3(b))。后续的实验同时证明pIB139质粒的引入并未引起S.albulusPD-1菌株表型以及ε-PL生产能力的变化,因此pIB139质粒适用于S.albulusPD-1菌株改造。
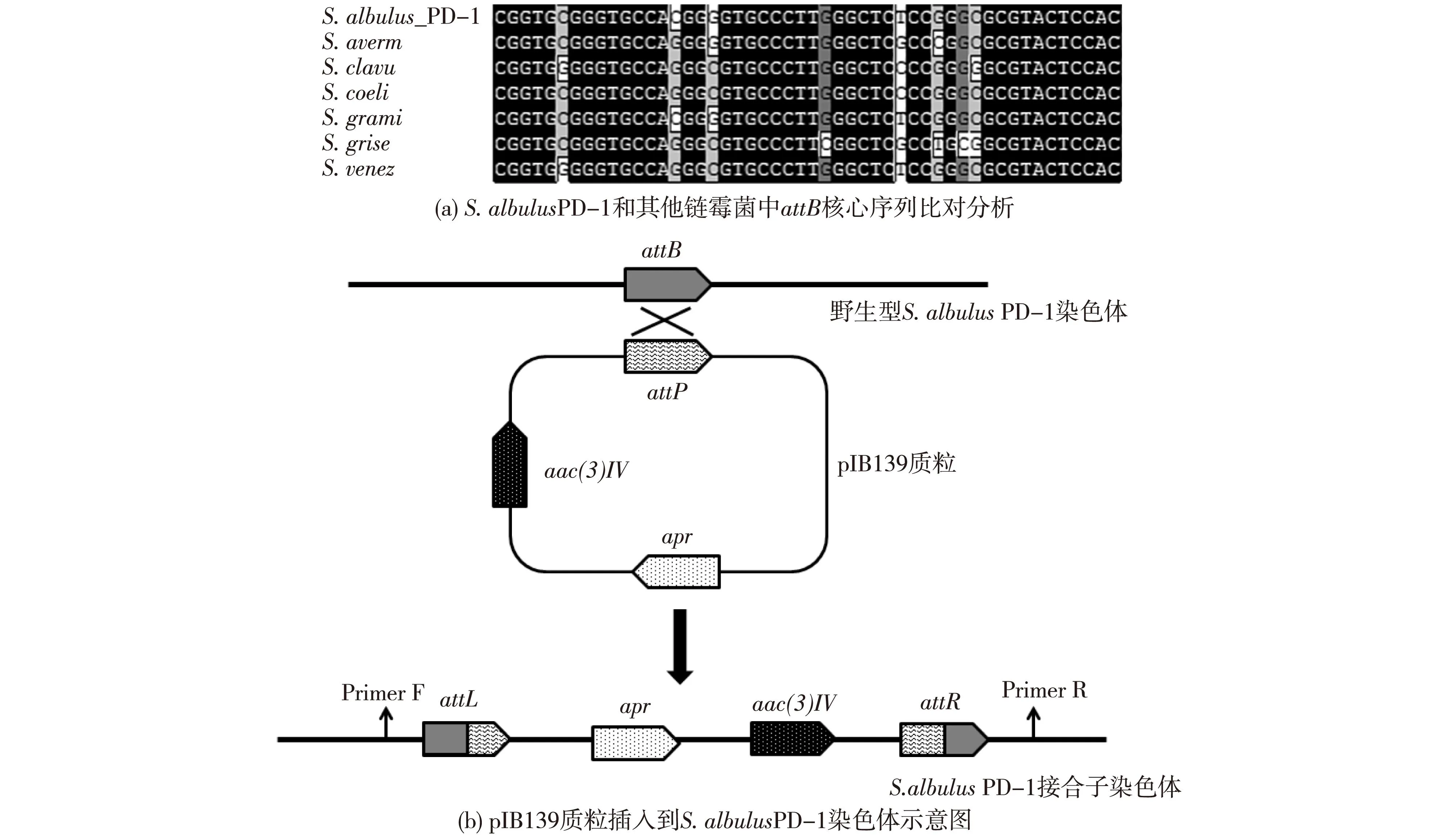
图3 pIB139插入S. albulus PD-1位点分析 Fig.3 Analysis of pIB139-based transconjugants of S. albulus PD-1
3结论
通过对上述几种条件的探索,最终确定:以S.albulusPD-1孢子作为受体菌,50 ℃热激处理10 min,使用含有10 mmol/L MgCl2的MS培养基进行接合转移,且16 h后进行抗生素覆盖,其转化效率最高,达到(3.0±0.4)×10-6;经过传代实验和PCR验证表明pIB139质粒能够稳定存在于S.albulusPD-1染色体的attB位点上。在此研究中除了pIB139质粒,也曾尝试将复制型质粒pIJ702和温敏型质粒pKC1139导入到S.albulusPD-1中,但并未得到相对应的转化子,猜测这些质粒的复制子不能在S.albulusPD-1中行使其功能,只能作为自杀型质粒存在,但这些质粒携带同源片段可以进行S.albulusPD-1特定基因的敲除工作。因此,笔者建立了相对高效的ε-PL生产菌株S.albulusPD-1的遗传转化体系,为将来ε-PL生产菌株在分子水平上的研究奠定了基础。
参考文献:
[1]高合意,陈正珍,梁宗言.生物防腐技术在化妆品中的应用[J].化工管理,2015(3):72-72.
[2]余春槐.ε-聚赖氨酸盐酸盐在食品工业中应用前景广阔[N].中国食品报,2014-01-06(006).
[3]中华人民共和国国家卫生和计划生育委员会.关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告(2014年第5号)[J].中国食品添加剂,2014(3):213-221.
[4]XU Z,FENG X,SUN Z,et al.Economic process to co-produce poly(ε-l-lysine)and poly(l-diaminopropionic acid)by a pH and dissolved oxygen control strategy[J].Bioresour Technol,2015,187:70-76.
[5]PANDEY A,KUMAR A.Improved microbial biosynthesis strategies and multifarious applications of the natural biopolymerε-poly-l-lysine[J].Process Biochem,2014,49(3):496-505.
[6]JIA S,WANG G,SUN Y,et al.Improvement of epsilon-poly-L-lysine production byStreptomycesalbulusTUST2 employing a feeding strategy[C]//Bioinformatics and Biomedical Engineering,3rd International Conference on IEEE,2009:1-4.
[7]YAMANAKA K,KITO N,KITA A,et al.Development of a recombinantε-poly-L-lysine synthetase expression system to perform mutational analysis[J].J Biosci Bioeng,2011,111(6):646-649.
[8]HAMANO Y,NICCHU I,SHIMIZU T,et al.ε-Poly-l-lysine producer,Streptomycesalbulus,has feedback-inhibition resistant aspartokinase[J].Appl Microbiol Biotechnol,2007,76(4):873-882.
[9]HAMANO Y,MARUYAMA C,KIMOTO H.Construction of a knockout mutant of the streptothricin-resistance gene inStreptomycesalbulusby electroporation[J].Actinomycetologica,2006,20(2):35-41.
[10]TAKAGI H,HOSHINO Y,NAKAMORI S,et al.Isolation and sequence analysis of plasmid pNO33 in theε-poly-L-lysine-producing actinomyceteStreptomycesalbulusIFO14147[J].J Biosci Bioeng,2000,89(1):94-96.
[11]HAMANO Y,NICCHU I,HOSHINO Y,et al.Development of gene delivery systems for theε-poly-l-lysine producer,Streptomycesalbulus[J].J Biosci Bioeng,2005,99(6):636-641.
[12]耿伟涛,宋存江,解慧,等.微生物合成ε-聚赖氨酸的研究进展[J].食品与发酵工业,2012,38(4):131-136.
[13]吴清平,刘盛荣,张菊梅.ε-聚赖氨酸生物合成及其产生菌遗传转化研究进展[J].微生物学报,2011,51(6):718-724.
[14]张扬,冯小海,徐虹.ε-聚赖氨酸生物合成研究进展[J].微生物学报,2011,51(10):1291-1296.
[15]孙湘婷,陈娇婷.ε-聚赖氨酸高产菌的新型筛选模型[J].食品工业科技,2013,34(2):202-203.
[16]耿伟涛,谷燕燕,谢晨庚,等.StreptomycesalbulusNK49合成ε-聚赖氨酸及其产物特征[J].南开大学学报(自然科学版),2013(3):28-34.
[17]REN X,CHEN X,ZENG X,et al.Acidic pH shock induced overproduction ofε-poly-L-lysine in fed-batch fermentation byStreptomycessp.M-Z18 from agro-industrial by-products[J].Bioproc Biosyst Eng,2015,38(6):1113-1125.
[18]WANG L,CHEN X,WU G,et al.Improvedε-poly-l-lysine production ofStreptomycessp.FEEL-1 by atmospheric and room temperature plasma mutagenesis and streptomycin resistance screening[J].Ann Microbiol,2015:1-9.
[19]方志锴,洪文荣,严凌斌,等.金色链霉菌接合转移体系的构建[J].福建农林大学学报(自然科学版),2011,40(5):521-524.
[20]PARK J,CHOI S.Construction of intergeneric conjugal transfer for molecular genetic studies ofStreptomycesmobaraensisproducing transglutaminase[J].Afr J Biotechnol,2014,13(13):1462-1466.
[21]朱云霞,廖思懿,叶江,等.抗生素Bagremycin 生产菌Streptomycessp.Tü4128 接合转移系统的建立[J].华东理工大学学报(自然科学版),2012,38(2):160-164.
[22]PHORNPHISUTTHIMAS S,SUDTACHAT N,BUNYOO C,et al.Development of an intergeneric conjugal transfer system for rimocidin-producingStreptomycesrimosus[J].Lett Appl Microbiol,2010,50(5):530-536.
[23]JIANG L,WEI J,LI L,et al.Combined gene cluster engineering and precursor feeding to improve gougerotin production inStreptomycesgraminearus[J].Appl Microbiol Biotechnol,2013,97(24):10469-10477.
(责任编辑荀志金)
Genetic transformation system of aε-poly-l-lysine-producingStreptomycesalbulusstrain
SUN Zhuzhen1,2,FENG Xiaohai1,2,XU Zhaoxian1,2,CAO Changhong1,2,XU Zheng1,2,XU Hong1,2
(1. State Key Laboratory of Materials-Oriented Chemical Engineering,Nanjing Tech University,Nanjing 210009,China;
2. College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211800,China)
Abstract:To study the biosynthetic mechanism of ε-Poly-l-lysine(ε-PL)in the producing strain,we developed a genetic transformation system for Streptomyces albulus PD-1,a well-known ε-PL-producing strain. Plasmid pIB139 was introduced into S. albulus PD-1 when Escherichia coli ET12567(pUZ8002)was used as a donor. After optimizing for conjugal transfer conditions,a maximal conjugation frequency of(3.0±0.4)× 10(-6) per recipient was obtained. Further test indicated that plasmid pIB139 was integrated into the attB site of S. albulus PD-1 chromosome,and the integration of plasmid pIB139 was stable after passing several generations. This inter-generic conjugal transformation system for S. albulus PD-1 will provide powerful tools to study ε-PL biosynthesis mechanism and to construct high ε-PL over-producers.
Keywords:ε-poly-l-lysine;Streptomyces albulus;genetic transformation system;pIB139
中图分类号:Q933;S476
文献标志码:A
文章编号:1672-3678(2016)02-0027-06
作者简介:孙朱贞(1990—),女,安徽马鞍山人,研究方向:微生物学、发酵工程;徐虹(联系人),教授,E-mail:xuh@njtech.edu.cn
基金项目:国家自然科学基金(21476112);江苏省自然科学基金(BK20140933);材料化学工程国家重点实验室自主课题(ZK201403)
收稿日期:2015-11-09
doi:10.3969/j.issn.1672-3678.2016.02.006
