抗生素生物合成基因簇克隆策略的研究进展
2016-04-26王婷婷邓子新陈文青
王婷婷,邓子新,2,陈文青
(1. 武汉大学药学院组合生物合成与新药发现教育部重点实验室,湖北武汉430072;
2. 上海交通大学 生命科学技术学院,上海200240)
抗生素生物合成基因簇克隆策略的研究进展
王婷婷1,邓子新1,2,陈文青1
(1. 武汉大学药学院组合生物合成与新药发现教育部重点实验室,湖北武汉430072;
2. 上海交通大学 生命科学技术学院,上海200240)
摘要:抗生素是一类具有多种生物活性的微生物次级代谢产物,自然界中60%以上的抗生素由放线菌所产生。克隆抗生素生物合成基因簇可为阐明其生物合成机制,结构改造,产量提高提供重要信息。在后基因组时代,新的抗生素基因簇克隆策略不断涌现,大大提高了微生物重要次级代谢产物生物合成基因簇的克隆效率,并缩短了抗生素的发现周期。本文综述了抗生素生物合成基因簇克隆策略的研究进展,包括近年来发展的后基因组的克隆策略。
关键词:抗生素;次级代谢产物;生物合成基因簇;克隆策略;后基因组时代
抗生素是重要的微生物次级代谢产物,而微生物次级代谢产物指“微生物在一定的时期以初级代谢产物为底物,所合成的对生物体无明确功能的物质”。放线菌、芽胞杆菌、蓝细菌、黏细菌及真菌等是产生重要次级代谢产物的微生物种类,其中放线菌以产生60%以上的重要抗生素而著称[1]。
由于自然界递减规律的制约,新型抗生素发现的可能性大为降低,与此同时,抗生素耐药性菌不断涌现,甚至出现了超级耐药菌,这一切要求我们必须对现有的抗生素进行结构改造以期提高其生物活性,同时也要求我们加大对具有更高生物活性抗生素的筛选力度。原核生物来源的抗生素生物合成基因簇一般位于染色体上一段连续的区域,大小一般在20~200 kb,含有与抗生素合成相关的结构基因、调控基因、抗性基因和转运蛋白基因,只有克隆其生物合成基因簇,阐明其生物合成机制,才能为应用组合生物合成策略创造出更高生物活性“非天然的天然化合物”[2]和以代谢工程手段定向提高抗生素产量奠定理论基础[3]。令人振奋的是,随着“后基因组时代”的到来,基因组扫描(genome scanning)[4]及基因组挖掘(genome mining)[5]等策略的应用使微生物重要次级代谢产物生物合成基因簇的克隆效率大为提高,这同时也提高了新药发现的预期,并缩短其发现周期。
1抗生素生物合成基因簇的传统克隆策略
早在1990年,Chater等[6]总结了抗生素生物合成基因簇的克隆策略,近年来由于技术的进步,抗生素生物合成基因簇的克隆策略在此基础上有了更大发展,故本节将二者一并归结为传统策略。
1.1互补克隆策略
首先获得抗生素产生菌的阻断突变株,然后随机克隆一些野生型DNA大片段到该阻断突变株,筛选目标抗生素产生能力恢复的克隆子,从而克隆出与目标抗生素生物合成的相关基因。早期,天蓝色链霉菌中放线紫红素[7]及十一烷基灵菌红素[8]的合成基因,灰色链霉菌产生的链霉素生物合成基因簇[9]均使用此策略所克隆。可以说抗生素的生物合成基因簇都可以用这种方法获得。
1.2突变克隆策略
此策略率先由英国John Innes Center的Chater教授所建立,将野生型DNA片段随机克隆到来源于一个放线菌噬菌体的特定载体上,含有紫霉素抗性基因,但不含有噬菌体的整合位点,因此在紫霉素的抗性筛选下,只有发生同源重组的克隆才能存活,然后从存活的克隆子中筛选目标抗生素阻断突变株,再以出发载体为探针,克隆出目标抗生素的生物合成基因簇。天蓝色链霉菌中次甲基霉素[10]生物合成基因的克隆即采用此策略。
1.3异源表达克隆策略
抗生素产生菌来自不同的种属,不同种属的基因组源自于不同的进化过程,即为基因的异源性。将整个或部分抗生素生物合成基因转入与其生产菌不同源(即异源)的宿主菌中,使其功能得到表达并产生该抗生素或其部分结构的过程,称为异源表达。该策略的使用前提是必须拥有高效的模式表达宿主,如S.lividans;此外还必须具有高效灵敏的检测手段,通过对基因产物的检测,从而确定抗生素的基因簇位置。Jones等[11]早期利用此方法在变铅青链霉菌中随机克隆到与放线菌素生物合成有关的基因。
1.4利用抗性基因为探针的克隆策略
一些抗生素产生菌产生的抗生素对产生菌本身也有抑制作用,所以抗生素产生菌必须具备完善的自我保护基因——抗性基因。抗性基因一般与生物合成基因连锁,所以克隆到抗性基因即意味着克隆到抗生素的生物合成基因簇。在红霉素生物合成基因簇的克隆上,先克隆红霉素抗性基因(eryE),而红霉素抗性基因是红霉素生物合成所必需的,从此基因出发通过染色体走外走的方法实现红霉素生物合成基因簇[12-13]的克隆。
1.5利用同源片段进行杂交的克隆策略
早期克隆到放线紫红素的生物合成基因后,利用含其生物合成基因的DNA大片段为探针克隆到角多霉素[14]等的基因簇。对于聚酮类抗生素而言,由于他们的生物合成模式相似,因此,此克隆策略被广泛运用于聚酮类化合物生物合成基因簇的克隆。如利用含有编码红霉素PKS的DNA片断为探针,成功地从南昌链霉菌中克隆出梅岭霉素[15]和南昌霉素[16]的生物合成基因簇。尼可霉素(Nikkomycin)与多氧霉素(Polyoxin)的核苷骨架相似,其中基因nikO(GenBank登录号:AJ251438)是负责Nikkomycin核苷骨架生物合成的关键基因,2009年,Chen等[17]以nikO的片断作为探针从S.cacaoi菌中克隆到多氧霉素的基因簇。
1.6利用PCR方法的克隆策略
在实际的克隆实践中,由于核苷酸同源性较低,应用同源片段进行杂交往往信号太弱以致无法鉴定,故利用此策略存在诸多限制;而PCR方法可摆脱此约束,该方法利用同源基因中某些结构域氨基酸的高度保守性,从这些氨基酸出发,反向设计简并引物或特异性引物,然后以野生型抗生素产生菌的基因组DNA为模板,进行PCR扩增,以期扩增到目标同源基因作为探针。目前此方法被广泛应用于抗生素生物合成基因簇的克隆,烯二炔类抗生素C-1027[18]生物合成基因簇利用此策略克隆,先克隆到sgcAB基因,结果显示它们是C-1027生物合成必须的基因,通过PCR方法从sgcAB所在的位置测序了87 kb大小的DNA,通过敲除实验确定边界,最终获得C-1027生物合成基因簇。
2“后基因组时代”抗生素生物合成基因簇的克隆策略
2.1基因组扫描(genome scanning)
有些结构新颖的抗生素,其生物合成基因簇无法采用传统的克隆策略进行克隆,而抗生素生物合成基因簇大小在20~200 kb范围内,其产生菌的基因组大小为8.0 Mb左右。基因组扫描策略是指运用鸟枪法随机克隆并测序一定数量特定大小的野生型基因组序列标签(genome sequence tags,GSTs),然后进一步分析以期鉴定出参与目标抗生素的基因组序列标签。由于克隆的随机性,因此在一定数目的基因组序列标签中应该包含目标抗生素的部分生物合成基因[19]。利用该策略目前已克隆的抗生素生物合成基因簇有Maduropeptin[20]及Epothilone[21]等。
2.2基因组挖掘(genome mining)
通常抗生素生物合成基因簇的克隆是从产物出发,然后克隆目标抗生素的生物合成基因簇,而基因组挖掘则是通过基因组信息出发,鉴定出未知抗生素。基因组挖掘最开始由David Hopwood和他的合作者发现,这个概念已经发展成熟为一门学科。2002年,第一个抗生素产生菌天蓝色链霉菌全基因组测序工作完成。通过对天蓝色链霉菌基因组进行挖掘并结合生物信息学分析,Lautru等[5]从天蓝色链霉菌基因组中鉴定了非核糖体肽(non-ribosomal peptide)化合物,结合体内遗传学分析和体外化学手段,从天蓝色链霉菌代谢产物中分离到新的铁载体(siderophore)化合物Coelichelin。
2.3Red/ET重组克隆策略
天然产物生物合成途径,尤其是I型聚酮合成酶/非核糖体多肽合成酶(PKS/NRPS)基因簇比较大,是很难利用传统的基因工程技术的;在大肠杆菌中,基于体内同源重组,Red/ET重组[22]使之成为可能,Red/ET重组不受限制位点和DNA片段大小的影响。它是将生物合成基因簇重组到通用的载体中,在适合的宿主中异源表达,从而研究未知的生物合成基因簇或者产生一定药理活性的衍生物。这种重组技术依赖线性和线性的DNA分子同源重组(linear-plus-linear homologous recombination,LLHR)(图1),主要在大肠杆菌中通过短的同源臂重组,由两个同等的噬菌体蛋白对催化,一个是λ噬菌体的Redα/Redβ蛋白,一个是位于E.coliK12染色体上的Rac前噬菌体的RecE/RecT蛋白。Syringolins是一类新的蛋白酶体抑制剂,是从植物致病菌Pseudomonassyringaepv.syringaeB301D-R中分离的,主要成分是Syringolin A,还有少量成分Syringolin B~F,他们的生物合成是由包含NRPS-PKS组合的大合成酶催化的,其中基因sylC编码含有单个的C、A、T模块的NRPS,基因sylD编码包含典型的NRPS和PKS模块的杂合蛋白,基因sylE负责Syringolin的泵出。直接从酶切的基因组DNA中克隆到19 kb大小的sylCDE基因,在大肠杆菌中进行LLHR,而后在E.coliGB05-MtaA中表达,最终检测到Syringolin G和Syringolin H[23]。Luminmycin A和Luminmide A/B[24]的生物合成基因簇同样是利用此策略获得。这种方法比传统的构建基因组文库然后筛选目标基因簇更简单,直接克隆也会减少很多突变,并且能够获得更大的DNA片段(10~52 kb)。Red/ET重组不仅极大地促进了大且复杂的生物合成途径的基因工程的改造,也用于从复杂的DNA源到质粒的基因簇克隆。这种有效克隆大生物合成基因簇方法的建立也推动了基因挖掘和组合生物的发展。
2.4利用TAR方法的克隆策略
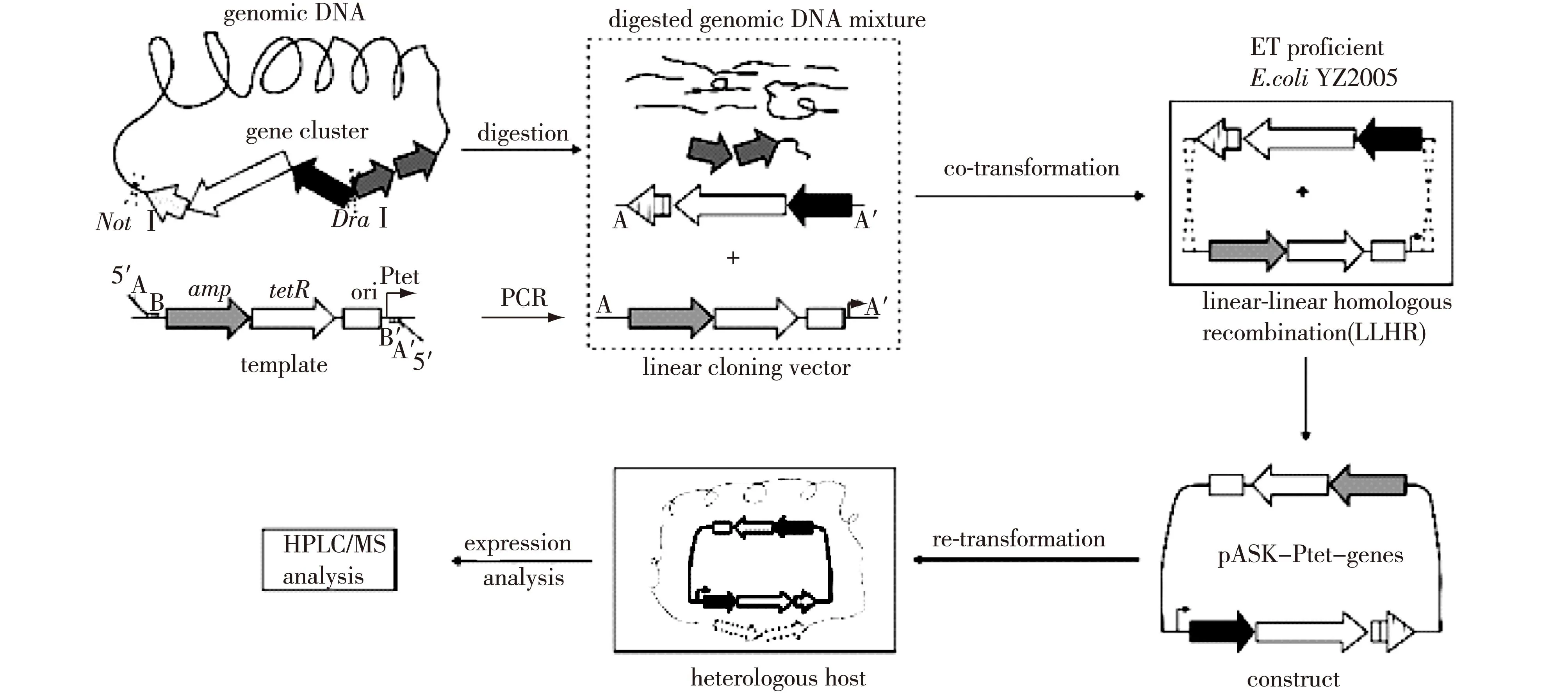
图1 Red/ET重组克隆和异源表达示意图Fig.1 Red/ET recombineering and heterologous expression
微生物的基因组能够合成大量的特殊化合物,然而由于缺乏将基因和分子关联起来的有效方法,到目前仅有一小部分次级代谢产物被开发出来。TAR(transformation-associated recombination)克隆是利用天然的体内同源重组优势,精确捕捉感兴趣的基因簇位置。TAR策略需先构建一个由三部分组成的载体,酵母部分可以直接克隆和进行遗传操作、大肠杆菌部分可以用于基因的保留和遗传操作,放线菌部分能够用于整合和异源表达(图2)。利用TAR的基因平台,直接克隆、重构、异源表达沉默的生物合成通路,从而获得新的抗生素。2013年, Yamanaka等[25]利用此策略从海洋放线菌Saccharomonosporasp. CNQ-490中直接捕获、激活并表达了1个67 kb大小的非核糖体肽合成酶(NRPS)的生物合成基因簇,发现了脂肽抗生素Taromycin A。这种即插即用的方法有效获取罕见的合成途径,为新的天然产物的发现和药物的发展开辟了方向。
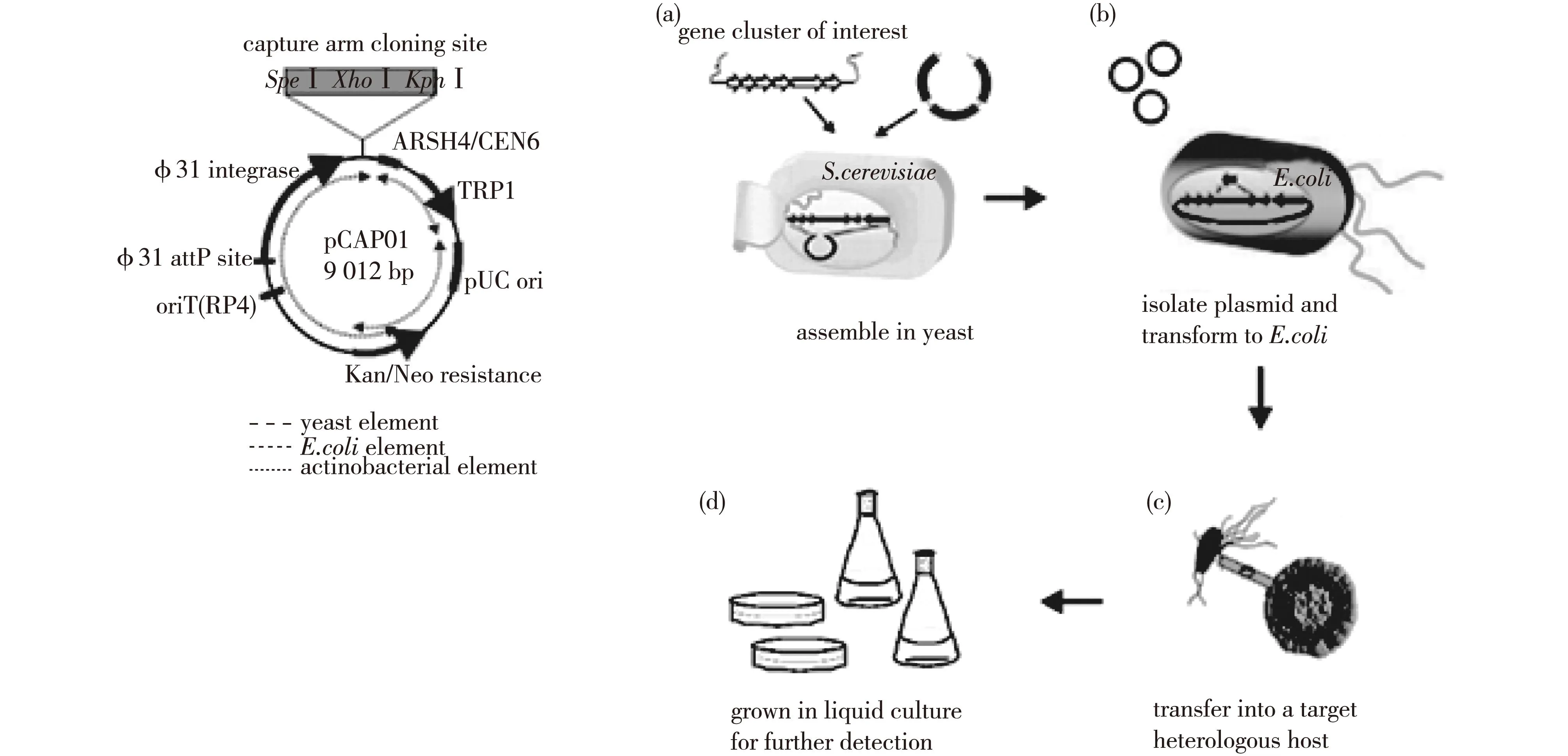
图2 TAR克隆策略和表达的示意图Fig.2 Design and strategy of TAR-cloning and expression
3展望
由于传统抗生素筛选方法的制约,微生物新药发现呈递减趋势,而且抗生素耐药菌的不断涌现,如耐甲氧西林的金黄色葡萄球菌和万古霉素抗性的乳酸肠球菌,这一切对微生物新药的发现提出了更迫切的要求。从已发现的抗生素出发,结合基因组测序技术的发展,更高效快捷地找到抗生素的生物合成基因簇;当然,从已克隆的抗生素生物合成基因出发,以特定保守的关键酶基因作为诱饵可以鉴定出新的隐性抗生素及其生物合成基因簇。从基因信息出发来鉴定抗生素的研究策略改变了传统的微生物新药发现与抗生素生物合成基因簇克隆的模式与途径,这无疑极大地推动了抗生素生物合成基因簇的克隆和微生物来源的新药发现。未来后基因组时代必将经过一个辉煌的发展历程,基因组挖掘,基因组扫描、定向克隆,重组克隆等技术结合,真核生物基因与原核生物基因的重组可衍生一些新的方法,将大大推动后基因组克隆技术的发展,从而获得更多的抗生素生物合成基因簇。
参考文献:
[1]CHATER K F.David Hopwood and the emergence ofStreptomycesgenetics[J].Int Microbiol,1999,2(2):61-68.
[2]HOPWOOD D A.Genetic contributions to understanding polyketide synthases[J].Chem Rev,1997,97(7):2465-2498.
[3]CHALLIS G L.Mining microbial genomes for new natural products and biosynthetic pathways[J].Microbiology,2008,154(6):1555-1569.
[4]ZAZOPOULOS E,HUANG K,STAFFA A,et al.A genomics-guided approach for discovering and expressing cryptic metabolic pathways[J].Nat Biotechnol,2003,21(2):187-190.
[5]LAUTRU S,DEETH R J,BAILEY L M,et al.Discovery of a new peptide natural product byStreptomycescoelicolorgenome mining[J].Nat Chem Biol,2005,1(5):265-269.
[6]CHATER K F.The improving prospects for yield increase by genetic engineering in antibiotic-producingStreptomycetes[J].Biotechnology(N Y),1990,8(2):115-121.
[7]MALPARTIDA F,HOPWOOD D A.Molecular cloning of the whole biosynthetic pathway of aStreptomycesantibiotic and its expression in a heterologous host[J].Nature,1984,309:462-464.
[8]FEITELSON J S,MALPARTIDA F,HOPWOOD D A.Genetic and biochemical characterization of the red gene cluster of StreptomycescoelicolorA3(2)[J].J Gen Microbiol,1985,131(9):2431-2441.
[9]OHNUKI T,IMANAKA T,AIBA S.Self-cloning inStreptomycesgriseusof anstrgene cluster for streptomycin biosynthesis and streptomycin resistance[J].J Bacteriol,1985,164(1):85-94.
[10]CHATER K F,BRUTON C J.Mutational cloning inStreptomycesand the isolation of antibiotic production genes[J].Gene,1983,26(1):67-78.
[11]JONES G H,HOPWOOD D A.Molecular cloning and expression of the phenoxazinone synthase gene fromStreptomycesantibioticus[J].J Biol Chem,1984,259(22):14151-14157.
[12]CORTES J,HAYDOCK S F,ROBERTS G A,et al.An unusually large multifunctional polypeptide in the erythromycin-producing polyketide synthase ofSaccharopolysporaerythraea[J].Nature,1990,348:176-178.
[13]DONADIO S,STAVER M J,MCALPINE J B,et al.Modular organization of genes required for complex polyketide biosynthesis[J].Science,1991,252:675-679.
[14]HAN L,YANG K,RAMALINGAM E,et al.Cloning and characterization of polyketide synthase genes for jadomycin B biosynthesis inStreptomycesvenezuelaeISP5230[J].Microbiology,1994,140(Pt 12):3379-3389.
[15]SUN Y H,ZHOU X F,TU G Q,et al.Identification of a gene cluster encoding meilingmycin biosynthesis among multiple polyketide synthase contigs isolated fromStreptomycesnanchangensisNS3226[J].Arch Microbiol,2003,180(2):101-107.
[16]SUN Y H,ZHOU X F,DONG H,et al.A complete gene cluster fromStreptomycesnanchangensisNS3226 encoding biosynthesis of the polyether ionophore nanchangmycin[J].Chem Biol,2003,10(5):431-441.
[17]CHEN W Q,HUANG T T,HE X Y,et al.Characterization of the polyoxin biosynthetic gene cluster fromStreptomycescacaoiand engineered production of polyoxin H[J].J Biol Chem,2009,284(16):10627-10638.
[18]LIU W,CHRISTENSON S D,STANDAGE S,et al.Biosynthesis of the enediyne antitumor antibiotic C-1027[J].Science,2002,297(5584):1170-1173.
[19]LIU W,AHLERT J,GAO Q,et al.Rapid PCR amplification of minimal enediyne polyketide synthase cassettes leads to a predictive familial classification model[J].Proc Natl Acad Sci U S A,2003,100(21):11959-11963.
[20]VAN LANEN S G,SHEN B.Microbial genomics for the improvement of natural product discovery[J].Curr Opin Microbiol,2006,9(3):252-260.
[21]SANTI D V,SIANI M A,JULIEN B,et al.An approach for obtaining perfect hybridization probes for unknown polyketide synthase genes:a search for the epothilone gene cluster[J].Gene,2000,247(1-2):97-102.
[22]ZHANG Y,BUCHHOLZ F,MUYRERS J P,et al.A new logic for DNA engineering using recombination inEscherichiacoli[J].Nat Genet,1998,20(2):123-128.
[23]BIAN X Y,HUANG F,STEWART F A,et al.Direct cloning,genetic engineering,and heterologous expression of the syringolin biosynthetic gene cluster inE.colithrough Red/ET recombineering[J].ChemBioChem,2012,13(13):1946-1952.
[24]FU J,BIAN X Y,HU S B,et al.Full-length RecE enhances linear-linear homologous recombination and facilitates direct cloning for bioprospecting[J].Nat Biotechnol,2012,30(5):440-446.
[25]YAMANAKA K,REYNOLDS K A,Kersten R D,et al.Direct cloning and refactoring of a silent lipopeptide biosynthetic gene cluster yields the antibiotic taromycin A[J].Proc Natl Acad Sci U S A,2014,111(5):1957-1962.
(责任编辑荀志金)
Progress in strategies for cloning of antibiotics biosynthetic gene clusters
WANG Tingting1,DENG Zixin1,2,CHEN Wenqing1
(1.Key Laboratory of Combinatorial Biosynthesis and Drug Discovery of the Ministry of Education,School of Pharmaceutical Sciences,Wuhan University,Wuhan 430072,China; 2. School of Life Sciences and Biotechnology,Shanghai Jiaotong University,Shanghai 200240,China)
Abstract:Antibiotics are microbial secondary metabolites with diverse bioactivities,and more than 60% of important antibiotics are produced by Actinomycetes. Cloning of antibiotics biosynthetic gene clusters offers pivotal information for elucidating their biosynthetic mechanism,structural modification and yield improvement. In post-genomic era,the efficiency for the cloning of important secondary metabolites gene clusters is significantly enhanced,and reduced the time for new antibiotics. We reviewed recent-progress in cloning strategies of antibiotics biosynthetic gene clusters,in particular, recently-developed cloning technology of the post-genomic era.
Keywords:antibiotics;secondary metabolites;biosynthetic gene cluster;cloning strategy;post genomic era
中图分类号:Q781
文献标志码:A
文章编号:1672-3678(2016)02-0070-05
作者简介:王婷婷(1989—),女,湖北随州人,研究方向:抗生素基因簇克隆;陈文青(联系人),副教授,E-mail:wqchen@whu.edu.cn
基金项目:国家自然科学基金(31270100)
收稿日期:2015-04-09
doi:10.3969/j.issn.1672-3678.2016.02.013
