同步糖化发酵菊芋生产酒精
2016-04-26李奇建
张 超,王 静,唐 波,李奇建
(1. 山东建筑大学 市政与环境工程学院,山东济南250101;2. 济南太和生物工程有限公司,
山东济南250013; 3. 江苏联海生物科技有限公司,江苏海门226133)
同步糖化发酵菊芋生产酒精
张超1,王静2,唐波3,李奇建2
(1. 山东建筑大学 市政与环境工程学院,山东济南250101;2. 济南太和生物工程有限公司,
山东济南250013; 3. 江苏联海生物科技有限公司,江苏海门226133)
摘要:以黑曲霉A-15 形成的菌丝球作为载体对酿酒酵母C-15进行固定化,研究各种因素对黑曲霉A-15菌丝球吸附率的影响。结果表明:在40 ℃、80 r/min、菌种个数混合比例为1∶ 10时,菌丝球对酵母的吸附可达到66.9%;以菊粉为底物,利用混合菌丝球进行同步糖化与发酵,30 ℃发酵48 h,发酵醪酒精体积分数达到12.8%,并且混合菌丝球可以耐受19%的酒精。
关键词:菌丝球;载体发酵;乙醇;同步糖化发酵
燃料乙醇最早采用玉米为原料发酵制成,但这一过程使用玉米量较大,对国家粮食安全构成了威胁[1-2]。菊芋(俗称洋姜、姜不辣、鬼子姜)主要成分是菊粉,是最简单的一类果聚糖,含糖量为其干质量的 60%~70%。 菊芋水解比淀粉质原料容易,不需要高温液化,直接用菊粉酶水解即可获得可发酵性糖,工艺流程简单,能耗低,与目前人们普遍关注的以农作物秸秆为代表的木质纤维素类生物质相比,更易于实现产业化。菊芋耐贫瘠、耐寒、耐旱、种植简易、产量高,可在沙漠、盐碱地或滩涂地种植[3-5],是一种极具潜力的非粮乙醇发酵原料[6-8]。
以菊芋为原料制备乙醇的生物发酵所用菌种一般为酵母菌,因为菊芋不能直接利用,需要先糖化,所以发酵方法有同步糖化发酵和先糖化后发酵。同步糖化发酵可以使发酵醪中水解下来的可发酵性糖被及时发酵为乙醇,在过程中不积累,防止糖积累而抑制菊粉酶分泌,避免底物抑制现象出现,可以有效防止杂菌污染,提高乙醇收率,但是目前国内以菊芋为原料酒精发酵技术水平低,菊糖利用率不高,损失较大[9-10]。另外,菌种游离存在菌种难以回收的问题,造成生产成本过高、环境污染,而固定化细胞技术能很好地解决这一问题。在乙醇制备中,将酵母固定化会大大提高酶促反应效率,因此具有很好的应用前景。但是目前公开的酵母固定化技术成本高、固定技术单一[11-12]。此外,提高酵母菌的酒精耐受力、解除高浓度酒精的抑制作用也是人们的研究热点[13-14]。
针对现有技术中存在的不足,笔者提出了一种载体发酵技术。在采用产菊粉酶的黑曲霉和酿酒酵母作为菌种同步糖化发酵制备乙醇的基础上,根据菊芋需要先糖化再发酵的特性,将黑曲霉和酿酒酵母进行混合培养,形成了黑曲霉吸附酿酒酵母的菌种混合体,该菌种混合体将酿酒酵母吸附在黑曲霉中,使酿酒酵母固定,并进行同步糖化发酵制备乙醇,以期简化工艺,提高酵母细胞对于乙醇的耐受性和乙醇产率。
1材料与方法
1.1材料
1.1.1供试菌株及材料
黑曲霉A-15(CMCC98003)保存于笔者所在实验室;酿酒酵母C-15,安琪酵母股份有限公司。
酵母膏,上海生化技术公司;蛋白胨、NaCl,中国医药(集团)上海试剂公司;pHS-3型酸度计,上海精密科学仪器有限公司;721型可见光分光光度计,北京光学仪器厂。
1.1.2培养基
种子培养基(g/L):酵母膏10,蛋白胨20,葡萄糖20;自然pH。
产酶培养基(g/L):菊芋粉25,(NH4)2SO45,蛋白胨10 ,KH2PO46,NaCl 5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.001;pH 5,0.1 MPa灭菌15 min。
发酵培养基(g/L):菊粉200,蛋白胨5,酵母膏5,(NH4)2SO42,KH2PO42,玉米浆5;pH 5.0,0.1 MPa灭菌15 min。
YPD固体培养基(g/L):酵母膏10、蛋白胨20、葡萄糖20、琼脂20;自然pH。
1.2方法
1.2.1菌体培养
将酿酒酵母菌种按照5%(体积分数)的接种量接种到装有100 mL种子培养基的250 mL三角瓶中,在30 ℃、100 r/min的摇床中培养30 h,发酵液在5 000 r/min离心5 min,收集酵母细胞。
将黑曲霉用无菌水配成孢子悬浮液,按照4%的接种量接种到装有100 mL产酶培养基的250 mL三角瓶中,在30 ℃、40 r/min的摇床中培养30 h,至形成菌丝球,过滤收集菌丝球。
1.2.2吸附试验
用100 mL蒸馏水悬浮酵母细胞,装入250 mL三角瓶中,每瓶加入5 g(湿质量)的菌丝球,在摇床上不同温度、转速和不同菌种的混合比例下吸附2 h,然后过滤,用分光光度计测定滤液中剩余的菌浓度并计算吸附率,见式(1)。
吸附率(R)=(吸附前菌液OD600值-吸附后
(1)
1.2.3发酵试验
1)普通同步糖化按照菌体培养方法收集酵母细胞和黑曲霉孢子悬浮液,将两者按一定比例混合,混合菌过滤后按照10%的接种量倒入含有200 mL发酵培养基的500 mL三角瓶中, 在30 ℃、40 r/min的摇床中进行同步糖化发酵48 h生产乙醇。
2)吸附同步糖化将酵母细胞和黑曲霉按照不同的菌种个数比混合后,在摇床上恒定温度、恒定转速下吸附2 h,制得混合菌丝球,过滤后按照10%的接种量倒入含有200 mL发酵培养基的500 mL三角瓶中,在30 ℃、40 r/min的摇床中进行同步糖化发酵48 h生产乙醇。
1.2.4混合菌丝球回用技术的稳定性
当一次发酵结束时,将发酵液在1 000 r/min无菌离心 15 min 后倾出上清液,菌体用无菌生理盐水洗涤后离心,全部转接入新鲜的发酵培养基中,在30 ℃、40 r/min的摇床中进行同步糖化发酵生产乙醇,实验结果取3次实验的平均值。
1.2.5混合菌丝球酒精耐受能力检测
向已经灭菌的YPD固体培养基中加入不同体积的无水酒精,调整体积分数分别为12%、14%、16%、18%、19%和20%,将初筛的菌株分别接种至不同酒精体积分数的平板上,标记静置10 min后,于28 ℃下恒温培养48 h。
1.2.6分析方法
酵母菌计数:使用血球计数板。
霉菌计数:参照细菌总数菌落计数方法。
酒精浓度的测定[15-16]:离心发酵醪,除去细胞,取 100 mL 上清液,加入100 mL蒸馏水后蒸馏出100 mL冷凝液,测量馏出液酒精浓度。
还原糖的检测:采用DNS法,用果糖作标样绘制DNS显色的标准曲线。
总糖含量测定:取1 mL待测溶液,加入50 mL体积分数 2.8%的H2SO4溶液,80 ℃水浴酸解1 h。冷却至室温,用 2 mol/L NaOH 调节pH至中性,并定容至 100 mL。采用DNS 法测定其中还原糖浓度,将测定出的数值放大100 倍即为总糖浓度。
菊粉酶酶活的测定:参照文献[17]的方法测定。其中,酶活力的定义为在pH5.4、温度55 ℃的条件下,每分钟水解底物生成1 μmol还原糖所需的最少酶量为一个酶活力单位,U/mL。
酶活的计算,见式(2)。
(2)
式中:180—葡萄糖的相对分子质量;10—反应时间(min);1 000—单位换算系数。
乙醇得率的计算,见式(3)。
(3)
化学需氧量(COD)的测定采用重铬酸钾法。
2结果与讨论
2.1温度对吸附率的影响
选择温度作为变化参数,将5 g(湿质量)的菌丝球加到100 mL酵母菌菌悬液中,分别在不同的温度下(25、30、35、40、45和50 ℃)振荡(100 r/min)吸附2 h,结果如图1所示。由图1可见,在40 ℃时,菌丝球对酵母菌的吸附可达到62.3%以上,故选择40 ℃作为菌丝球的吸附温度。
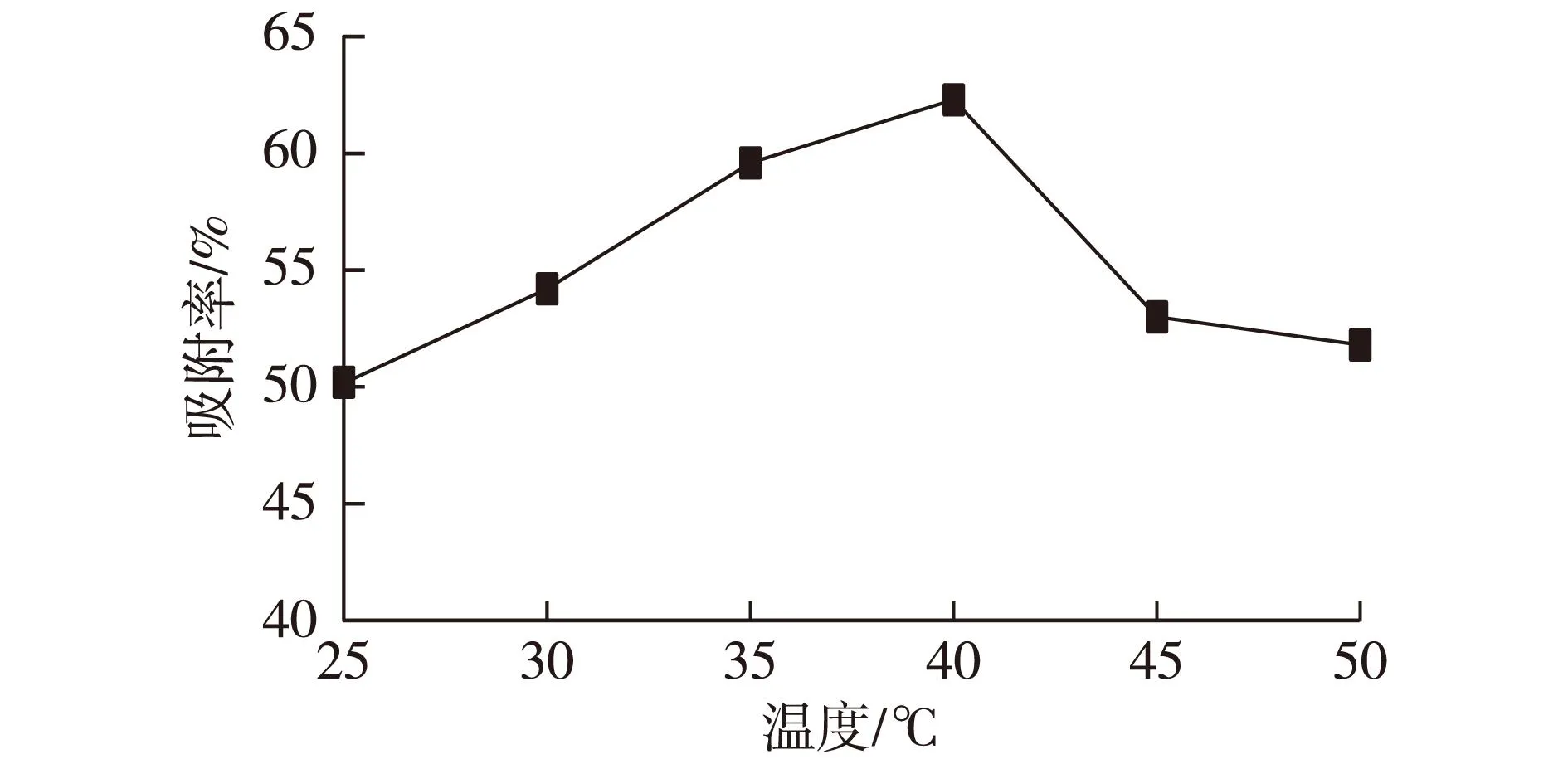
图1 温度对菌丝球吸附酵母菌的影响Fig.1 Effect of temperature on the adsorption ratio of yeast
2.2转速对吸附率的影响
选择转速作为变化参数,将5 g(湿质量)的菌丝球加到100 mL的酵母菌菌悬液中,分别在不同的转速下(40、60、80、100和120 r/min)振荡吸附2 h,结果如图2所示。由图2可见,在转速为80 r/min时,菌丝球对酵母的吸附可达到65.1%,故在实验中选择80 r/min作为菌丝球的吸附转速。
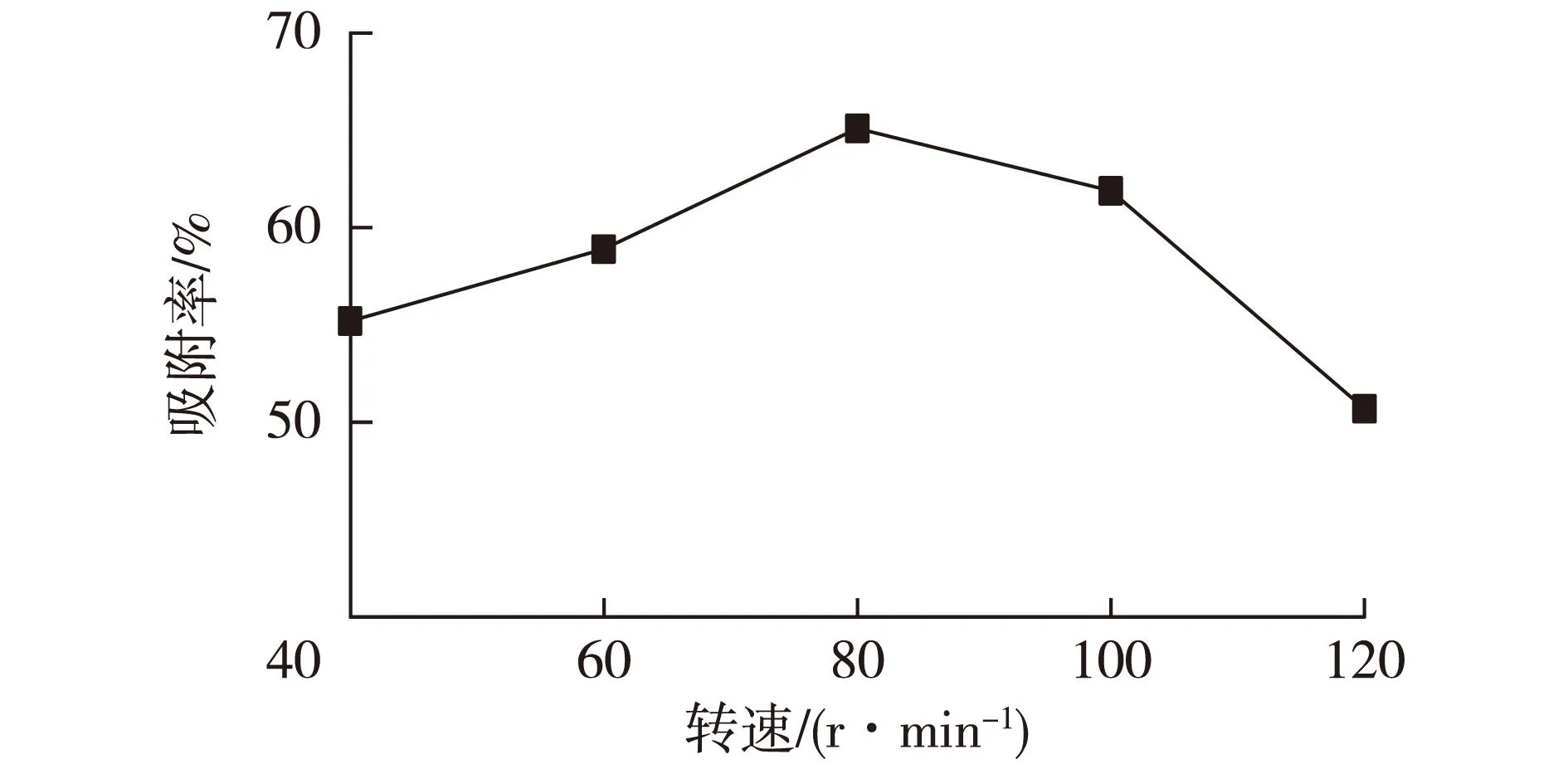
图2 转速对菌丝球吸附酵母菌的影响Fig.2 Effect of rotation speed on the adsorption ratio of yeast
2.3不同的菌种混合比例对发酵效果的影响
按照黑曲霉和酿酒酵母的菌种个数比分别为1∶ 1、1∶ 3、1∶ 6、1∶ 10、1∶ 12进行混合,最终吸附率如图3所示。
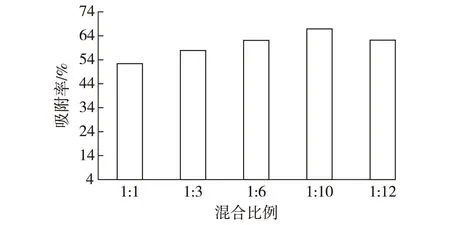
图3 混合比例对菌丝球吸附酵母菌的影响Fig.3 Effects of mixed proportion on the adsorption ratio of yeast
由图3可知,混合菌丝球的形成对两种菌个数的比例有要求,混合比例过低或过高均会影响到混合菌丝球的吸附效果。由图3可见,菌种之间最佳混合比例为1∶ 10,菌丝球对酵母的吸附可达到66.9%。
2.4不同发酵方式对发酵效果的影响
不同发酵方式对发酵效果的影响如表1所示。由表1可知:吸附后形成混合菌丝球的发酵方式比传统的同步糖化发酵方式具有更高的乙醇浓度和更低的残糖浓度;并且,废水COD的测定表明发酵液酒精精馏后产生废糟液的COD从现有酒精发酵工艺的54 612 mg/L降低到了27 641 mg/L,有利于实现污染物源头减废。

表1 不同发酵方式的比较
2.5混合菌丝球回用技术的稳定性
考察混合菌丝球回用技术的稳定性,结果如图4所示。由图4可看出,当混合菌丝球回用至第10次时,酒精产量仍然稳定在较高的水平,说明该技术使用寿命长且能反复使用,操作方便粗放,成本低廉,具有很好的工业化生产前景。
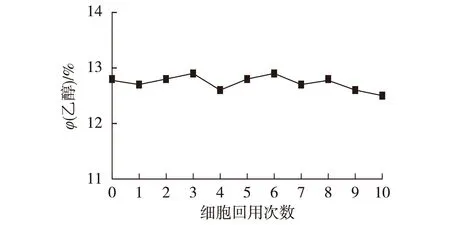
图4 回用细胞次数对发酵结果的影响Fig.4 Effect of recycle times on the fermentation results
2.6混合菌丝球酒精耐受能力检测
Hayashida等[16]研究发现:酵母菌对酒精的耐受能力不仅仅是由于酵母细胞自身对不同水平的酒精耐受的内在能力,而且与酵母原生质膜的脂类组成及功能、发酵营养状况、环境参数、碳水化合物底物补充方式等因素有密切关系。临界酒精浓度导致质膜磷脂裂解,如果菌株质膜本身或发酵时具备相当营养及环境条件适宜等,酵母就对酒精毒性有所适应和抵抗,特别是温度尤为明显。随着温度的不断提高,酵母质膜的磷脂量很快降低,以维持质膜的流动性和维持细胞活性。由于黑曲霉菌丝体中富含有脂蛋白,这种物质已经被证明可以改善酵母原生质膜的结构,从而显著提高酵母的发酵活力和耐酒精能力。笔者采用黑曲霉结合酿酒酵母的发酵方式,可以显著提高酿酒酵母的酒精耐受能力,结果如表2所示。
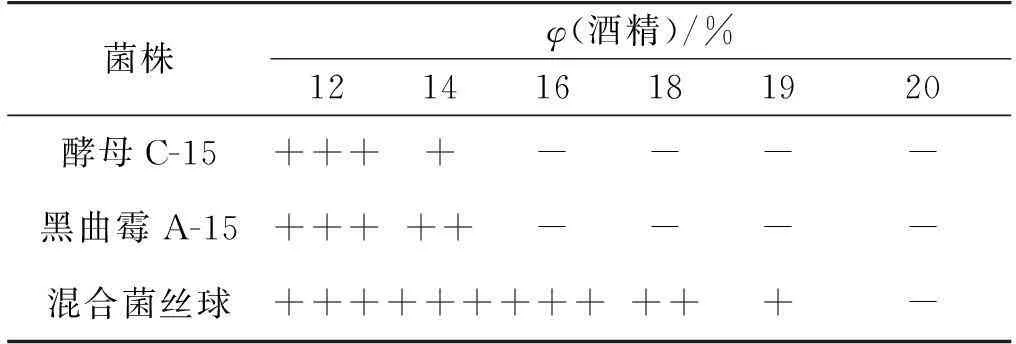
表2 混合菌丝球的酒精耐受性
注:“+++”表示菌株生长良好;“++”表示菌株能生长;“+”表示菌株生长较困难;“-”表示菌株不能生长。
由表2可知,随着酒精体积分数的增大,酵母菌和黑曲霉的生长逐渐受到抑制,但如果利用载体发酵技术,其制备的混合菌丝球对酒精的耐受能力加强,可耐受19%的酒精。
3结论
笔者将同步糖化发酵工艺和微生物固定化技术进行了结合,以黑曲霉A-15 形成的菌丝球作为载体对酿酒酵母C-15进行固定化,研究各种因素对黑曲霉A-15菌丝球吸附率的影响。结果表明:在40 ℃、80 r/min、菌种个数混合比例为1∶ 10时,菌丝球对酵母的吸附可达到66.9%;以菊粉为底物,利用混合菌丝球进行同步糖化与发酵,30 ℃发酵48 h,发酵醪酒精体积分数达到12.8%,并且混合菌丝球可以耐受19%的酒精。这一工艺思路具有以下优点:
1)载体发酵技术边产酶边糖化,使发酵醪中水解下来的可发酵性糖被及时发酵为乙醇,在过程中不积累,防止糖积累而抑制菊粉酶分泌,避免底物抑制现象出现,可以有效防止杂菌污染,提高乙醇收率。2)本技术采用菌丝球作为固定化手段,降低了固定化成本。3)本研究利用黑曲霉对酿酒酵母实现了固定化,不用额外的载体,节约了细胞固定化成本,酿酒酵母从发酵系统中容易回收,使用寿命长且能反复使用,操作方便粗放,成本低廉,容易实现工业化生产。4)由于将酿酒酵母包裹在黑曲霉中形成菌丝球,黑曲霉菌丝体富含能提高酵母活力和耐酒精能力的脂蛋白,使固定化后酿酒酵母细胞所处的微环境改变,酿酒酵母细胞对于乙醇的耐受性增强。5)利用菊芋作为乙醇发酵底物,具有更强的经济性。菊芋与目前国内外普遍关注的以农作物秸秆为代表的木质纤维素类生物质原料和常规的淀粉质原料相比,既不需要技术难度大、糖分损耗高的预处理技术,也不需要成本昂贵的酶制剂。由于菊粉的聚合度低,菊芋原料的水解比淀粉质原料还容易,不需要高温液化,同步菊粉酶水解就可以获得可发酵性糖,工艺流程简单,能耗低。由此可见,菊芋不论是农学形状,还是加工转化特征,都是替代粮食类淀粉质原料的理想选择。
参考文献:
[1]白璐,南方.燃料乙醇的现在和未来太阳能[J].太阳能,2008(10):32-34.
[2]LIN Y.Ethanol fermentation from biomass resources:current state and prospects[J].Appl Microbiol Biotechnol,2006,69:627-642.
[3]张敏华.我国非粮燃料乙醇生产技术进展[J].酿酒科技,2008(9):91-95.
[4]周爱萍.国内外燃料乙醇的生产与研究进展[J].安徽农业科学,2008,36:8786-8700.
[5]GHOSH P,GHOSE T K.Bioethanol in India:recent past and emerging future[J].Adv Biochem Eng Biotechnol,2003,85:l-27.
[6]SHAHBAZI A,LI Y,MIMS M R.Application of sequential aqueous steam treatments to the fractionation of softwood[J].App Biochem Biotechnol,2005,15:973-987.
[7]SEHELL D J,FARMER J,NEWMAN M,et al.Dilutesulfuric acid pre-treatment of corn stover in pilot-scale reactor[J].App Biochem Biotechnol,2003,105(1/2/3):69-85.
[8]RODRI’ GUEZC A.Hydrolysis of sugar cane bagasse using nitric acid:a kinetic assessment[J].J Food Eng,2004,61(2):143-152.
[9]KANG S.Production of cellulases and hemicellulases byAsperillusnigerKK2 from lignocellulosic biomass[J].Bioresour Technol,2004,91:153-156.
[10]ADEN A,RUTH M,IBSEN K,et al.Lignocellulosic biomass to ethanol process design and economics utilizing cocurrent dilute acid prehydrolysis and enzymatic hydrolysis for corn stover[EB/OL].[2015-09-20].http:∥www.nrel.gov/docs/fy990sti/26157.pdf
[11]STEEL B,RAJ S,NGHIEM J,et al.Enzyme recovery and recycling following hydrolysis of ammonia fiber explosion treated corn stover[J].Appl Biochem Biotechnol,2005,124(l):901-910.
[12]袁文杰.克鲁维酵母同步糖化发酵菊芋生产乙醇的研究[D].大连:大连理工大学,2009.
[13]OHTA K,HAMADA S,NAKAMURA T.Production of high concentration of ethanol from inulin by simultaneous saccharification and fermentation usingAspergillusnigerandSaccharomycescerevisiae[J].Appl Environ Microbiol,1993,59:729-733.
[14]葛向阳.菊芋发酵生产燃料酒精的研究[D].无锡:江南大学,2009.
[15]天津轻工业学院、大连轻工业学院、无锡轻工业学院,等.工业发酵分析[M].北京:中国轻工业出版社,1994:6-15.
[16]HAYASHIDA S,OHTA K.Formation of high concentration of alcohol by various yeast[J].J Inst Brew,1981,87(1):42-44.
[17]杨利博.以菊芋为原料同步糖化发酵生产燃料乙醇研究[D].石家庄:河北科技大学,2010.
(责任编辑管珺)
Production of ethanol from Jerusalem artichoke flour by simultaneoussaccharification and fermentation
ZHANG Chao1, WANG Jing2,TANG Bo3,LI Qijian2
(1. School of Municipal and Environmental Engineering,Shandong Jianzhu University,Jinan 250101,China;2. Jinan Taihe Bioengineering Co. Ltd.,Jinan 250013,China;3. Jiangsu Lianhai Biological Technology Co. Ltd.,Haimen 226133,China)
Abstract:Mycelial pellets formed by Aspergillus niger A-15 were used to immobilize the alcohol producing yeast Saccharomyces cerevisiae C-15. The operated factors, such as agitation speed, temperature and mixed proportion of strains were studied. The optimal adsorption 66.9% was obtained when speed was 80 r/min, temperature was 40 ℃ and mixed proportion was 1∶ 10. With Jerusalem artichoke flour as substrate,12.8% (V/V) of ethanol was produced within 48 h of fermentation by simultaneous saccharification and fermentation using mycelial pellets at 30 ℃. And mycelial pellets could tolerate 19%(volume fraction) alcohol.
Keywords:mycelial pellet;carrier fermentation;alcohol;simultaneous saccharification and fermentation
中图分类号:X172
文献标志码:A
文章编号:1672-3678(2016)02-0012-05
作者简介:张超(1978—),男,山东济南人,讲师,研究方向:发酵工学,E-mail:zhangmeili8292@sina.com
基金项目:山东大学微生物技术国家重点实验室开放基金项目(M2012-14);济南市引进海内外高层次人才创业项目(2011044);山东省住房城乡建设科学技术项目计划(KY007)
收稿日期:2015-09-25
doi:10.3969/j.issn.1672-3678.2016.02.003
