Checkerboard法对ε-聚赖氨酸和壳聚糖抑菌作用的研究
2021-12-21魏奇白伟娟钟鑫荣王晓贇张承康张维瑞陈美霞刘盛荣
魏奇,白伟娟,钟鑫荣,王晓贇,张承康,张维瑞,3,陈美霞*,刘盛荣,3*
(1.宁德师范学院 生命科学学院,福建 宁德 352100;2.福建农林大学 食品科学学院,福建 福州 350000;3.闽东特色生物资源福建省高校工程研究中心,福建 宁德 352100;4.厦门市燕之屋丝浓食品有限公司,福建 厦门 361100)
近年来,随着消费习惯的变化,消费者对食品的需求也随之发生变化。防腐剂在食物当中所起到的关键作用是抑制食品中微生物的生长,防止食品出现因微生物产生的腐败变质现象,从而延长食品的贮藏期[1]。天然食品防腐剂,具有较好的抑菌和保鲜的作用,能够避免化学防腐剂残留物对人体产生较大的毒副作用。因此,天然防腐剂也越来越受到消费者的青睐[2-4]。
ε-聚赖氨酸是一种从微生物中筛选出的天然防腐抑菌剂,具有良好防腐性能和热稳定性等特点,存在巨大的商业潜力[5]。ε-聚赖氨酸是由链霉菌好氧发酵产生,研究表明其在人体中能够直接降解成赖氨酸,对人体无毒无害,是一种天然的生物防腐剂[6-7]。ε-聚赖氨酸已被证实不会对生物体的生长、生育繁殖、神经和免疫方面产生毒副作用,因此可作为一种天然、安全的食品防腐剂[8]。ε-聚赖氨酸主要的抑菌机制是通过破坏微生物的细胞形态,损伤细胞膜,引起细胞内物质的泄漏,导致细胞内的酶及蛋白质的代谢紊乱,从而引起机体的氧化应激反应,最终破坏细胞的功能,导致细胞死亡[9]。壳聚糖是一种天然的氨基酸多糖,具有广谱抑菌作用,能够有效抑制金黄色葡萄球菌、沙门氏菌和大肠杆菌等食源性致病菌,并且有自发成膜的物理特性,能够在食品的表面形成透明无色的薄膜。因其无毒无害且无副作用,所以广泛应用于食品的生产和加工[10-11]。壳聚糖的抑菌作用主要是通过抑制微生物的生长,降低三羧酸循环中的关键酶活性,破坏细胞膜结构,最终导致菌体死亡[12]。目前,壳聚糖可以广泛应用于果蔬保鲜,达到延缓果实衰老、抑菌防腐、保证果蔬品质、延长果蔬贮藏期的效果。因此,壳聚糖可以延长食品的贮藏期。
壳聚糖和ε-聚赖氨酸是一种天然食品防腐抑菌剂,具有较好的抑菌和保鲜作用。壳聚糖和ε-聚赖氨酸复配使用时,壳聚糖形成薄膜吸附在细胞膜上,影响了营养物质进入,从而达到抑菌的作用[13-15]。有研究报道,壳聚糖和ε-聚赖氨酸复合涂膜能够延长中国对虾的保质期,减少中国对虾的汁液流失,减少微生物数量[16]。壳聚糖和ε-聚赖氨酸具有协同作用,能够改善贮藏期间樱桃的硬度和色泽,可以提高樱桃的贮藏品质[17]。因此,开发壳聚糖和ε-聚赖氨酸复合保鲜剂对提高食品品质和延长食品贮藏期具有十分重要的意义。
天然食品防腐剂的复配应用,有助于提高防腐剂的保鲜效果,增加抑菌谱,减少用量而降低成本。本文对壳聚糖与ε-聚赖氨酸复配的抑菌效果进行研究,以大肠杆菌和金黄色葡萄球菌为指示菌,采用微量稀释法来测定壳聚糖、ε-聚赖氨酸及其复配溶液的最低抑菌浓度,采用Checkerboard法探究壳聚糖和ε-聚赖氨酸抑菌活性,并分析两者复配溶液对细菌的影响,该研究可为ε-聚赖氨酸和壳聚糖在食品中的科学复配应用提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):宁德师范学院微生物室提供。
1.1.2 试剂
ε-聚赖氨酸(食品级):浙江新银象生物工程有限公司;壳聚糖(食品级):北京索莱宝科技有限公司;营养琼脂、营养肉汤:广州环凯微生物科技有限公司。
1.2 仪器与设备
DHP-9272A电热恒温培养箱、DHG-9070A鼓风干燥箱:上海飞越实验仪器有限公司;SW-CJ-2D净化工作台、YXQ-SG46-280S全自动高压灭菌锅:上海博迅实业有限公司;THZ-100恒温培养摇床:上海一恒科学仪器有限公司;YP802N电子天平:上海精密科学仪器有限公司;YC-300L数控低温保存箱:中科美菱低温科技股份有限公司。
1.3 试验方法
1.3.1 溶剂配制
ε-聚赖氨酸溶液制备:用去离子水配制ε-聚赖氨酸溶液(2%)。壳聚糖溶液制备:用0.5%冰醋酸制备壳聚糖溶液(0.1%)。
1.3.2 培养基配制
营养琼脂培养基的配制:称取营养琼脂干粉(33 g)加入1 L蒸馏水,高温高压灭菌(121℃,15 min)。营养肉汤培养基的配制:称取营养肉汤干粉(18 g)加入1 L蒸馏水,高温高压灭菌(121℃,15 min)。
1.3.3 菌种活化
在超净工作台中,将两种供试菌接种至营养肉汤培养基,置于37℃恒温培养箱中培养24 h。
1.3.4 菌液制备
在超净工作台中,分别取上述少量活化后的金黄色葡萄球菌和大肠杆菌,接种至30 mL营养肉汤培养基中于恒温摇床中培养24 h(150 r/min,35℃)。
1.3.5 最小抑菌浓度测定
96孔板中加入100 μL ε-聚赖氨酸溶液(或壳聚糖溶液)和100 μL菌液浓度为106CFU/mL的大肠杆菌(或金黄色葡萄球菌)。分别在24、48 h和72 h后观察,测定最小抑菌浓度。表1为ε-聚赖氨酸和壳聚糖溶液的浓度。

表1 壳聚糖和ε-聚赖氨酸的浓度Table 1 The concentration of ε-polylysine and chitosan
1.3.6 Checkerboard法测试
壳聚糖和ε-聚赖氨酸复配溶液的浓度如表2所示。按照Checkboard法测定壳聚糖和ε-聚赖氨酸复配溶液的联合抑菌作用。
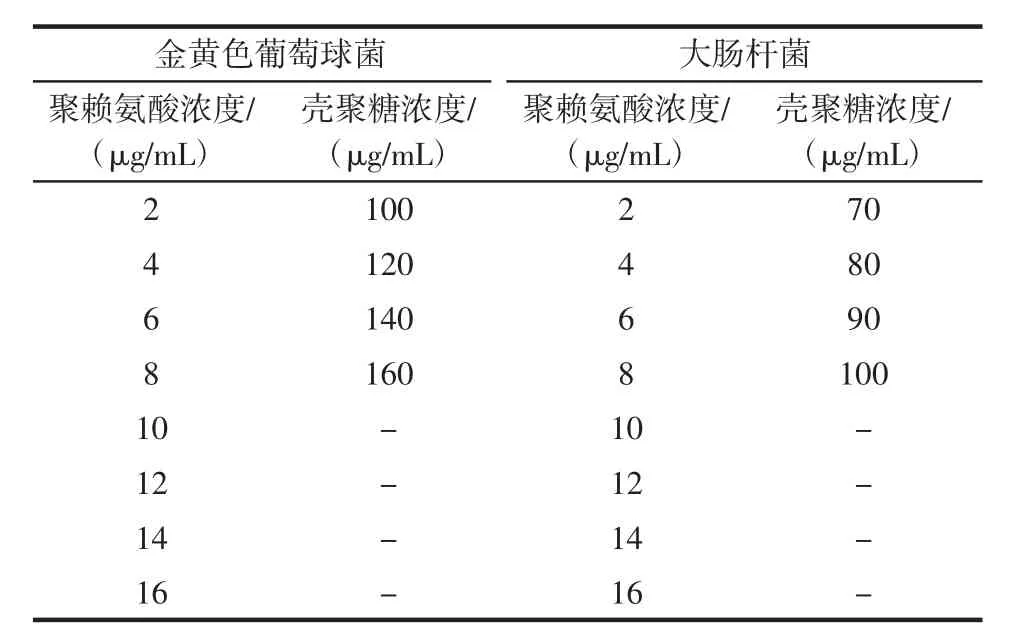
表2 壳聚糖、ε-聚赖氨酸复配浓度Table 2 The combined concentration of ε-polylysine and chitosan
1.3.7 Checkerboard法计算联合抑菌指数(fractional inhibitory concentration index,FICI)值
采用Checkerboard法计算FICI值,从而评估壳聚糖和ε-聚赖氨酸相互抑菌作用[18-19]。FICI计算公式如下。FICI=壳聚糖和ε-聚赖氨酸复配溶液MIC/壳聚糖MIC+壳聚糖和ε-聚赖氨酸复配溶液MIC/ε-聚赖氨酸MIC
当 FICI≤0.5 时,为协同效应;0.5<FICI≤1,为相加效应;1<FICI≤2,为无关效应;FICI>2,为拮抗效应。
1.3.8 蛋白质泄漏量的测定
参考文献[20]的方法,测定蛋白质泄漏量。取5 mL的金黄色葡萄球菌菌液,离心5 min(8 000 r/min,4℃)后弃上清液,用0.85%的生理盐水将菌液重悬至40 mL。吸取 2 mL ε-聚赖氨酸溶液(35 μg/mL)、壳聚糖溶液(180 μg/mL)和复配溶液(16 μg/mL ε-聚赖氨酸、100 μg/mL壳聚糖)分别与2 mL金黄色葡萄球菌菌液混匀,处理时间为72 h。样品用0.85%的生理盐水稀释5倍,离心5 min(8 000 r/min,4℃)后测定蛋白质浓度,无菌生理盐水作为空白对照,计算蛋白质泄漏量。
取5 mL的大肠杆菌菌液,离心5 min(8 000 r/min,4℃)后弃上清液,用0.85%的生理盐水将菌液重悬至40 mL。吸取 2 mL ε-聚赖氨酸溶液(20 μg/mL)、壳聚糖溶液(240 μg/mL)和复配溶液(6 μg/mL ε-聚赖氨酸、100 μg/mL壳聚糖)分别与2 mL大肠杆菌菌液混匀,处理时间为72 h。样品用生理盐水稀释5倍,离心5 min(8 000 r/min,4℃)后测定蛋白质浓度,无菌生理盐水作为空白对照,计算蛋白质泄漏量。
1.4 数据处理
每个试验重复测定3次,取其平均值,应用SPSS 16.0对数据进行处理,并用Graphpad Prism 9作图。
2 结果与分析
2.1 壳聚糖对大肠杆菌和金黄色葡萄球菌的影响
壳聚糖对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度见表3。
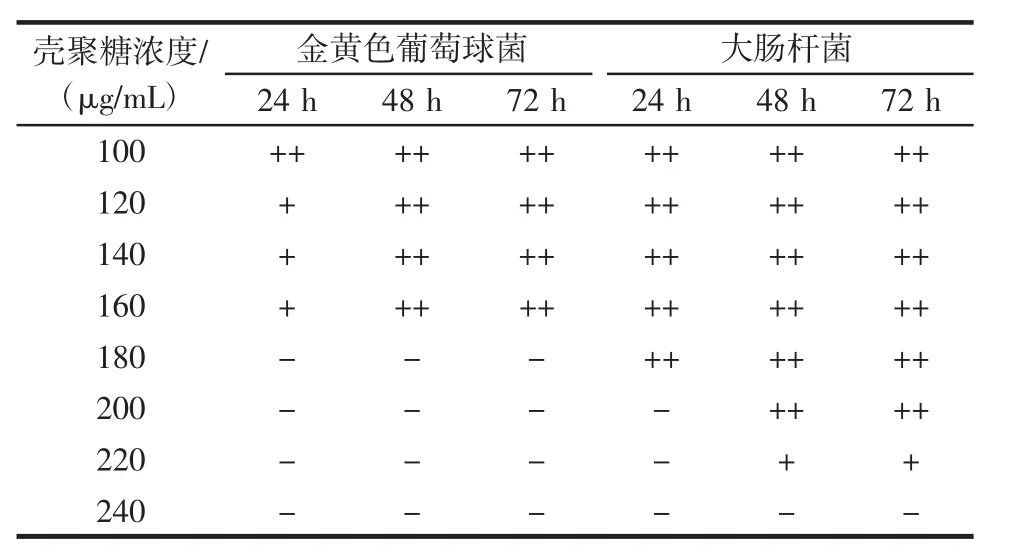
表3 壳聚糖对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度Table 3 Minimum inhibitory concentration of chitosan against Staphylococcus aureus and Escherichia coli
由表3可知,壳聚糖的抑菌活性随着壳聚糖浓度增加而增强。不同处理时间下,壳聚糖对金黄色葡萄球菌的最小抑菌浓度均为180 μg/mL。当抑制时间24 h时,壳聚糖对大肠杆菌的最小抑菌浓度为200 μg/mL。当抑制时间48、72 h时,壳聚糖对大肠杆菌的最小抑菌浓度为240 μg/mL。由此可知,当抑制时间为72 h时,壳聚糖对金黄色葡萄球菌的最小抑菌浓度(180 μg/mL)小于对大肠杆菌的最小抑菌浓度(240 μg/mL)。
2.2 ε-聚赖氨酸对大肠杆菌和金黄色葡萄球菌的影响
ε-聚赖氨酸对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度见表4。
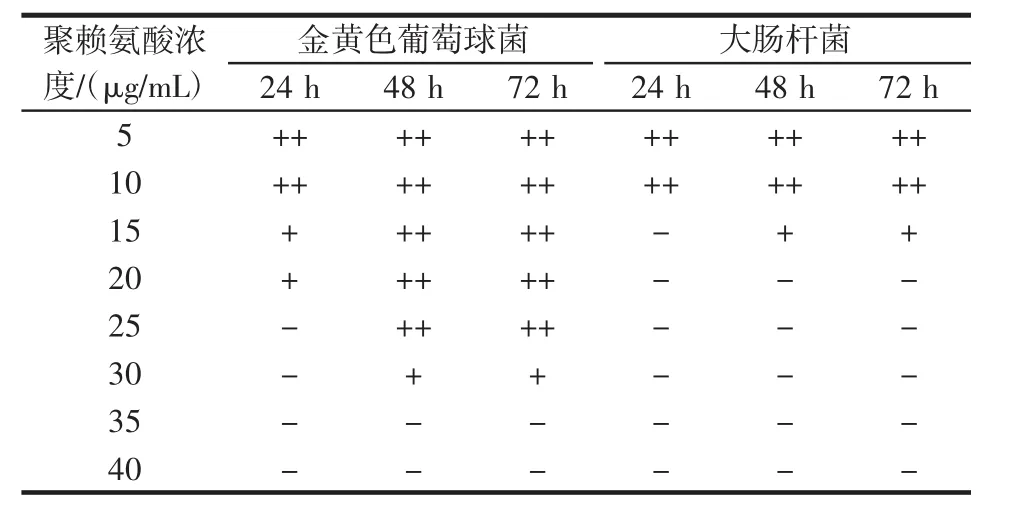
表4 ε-聚赖氨酸对金黄色葡萄球菌和大肠杆菌的最小抑菌浓度Table 4 Minimum inhibitory concentration of ε-polylysine against Staphylococcus aureus and Escherichia coli
由表4可知,当抑制时间为24 h时,ε-聚赖氨酸对金黄色葡萄球菌最小抑菌浓度为25 μg/mL;ε-聚赖氨酸对大肠杆菌的最小抑菌浓度为15 μg/mL。当抑制时间为48 h时,ε-聚赖氨酸对金黄色葡萄球菌最小抑菌浓度为35 μg/mL,ε-聚赖氨酸对大肠杆菌的最小抑菌浓度为20 μg/mL。当抑制时间为72 h时,ε-聚赖氨酸对金黄色葡萄球菌最小抑菌浓度为35 μg/mL;ε-聚赖氨酸对大肠杆菌的最小抑菌浓度为20 μg/mL。由此可知,ε-聚赖氨酸对大肠杆菌的最小抑菌浓度小于金黄色葡萄球菌的最小抑菌浓度。
2.3 Checkerboard法测试抑菌效果
2.3.1 壳聚糖和ε-聚赖氨酸复配溶液对金黄色葡萄球菌的影响
采用Checkerboard法评价壳聚糖和ε-聚赖氨酸的复配溶液对金黄色葡萄球菌和大肠杆菌的抑菌效果,并根据FICI指数预测壳聚糖和ε-聚赖氨酸之间的相互抑菌作用的类型。壳聚糖和ε-聚赖氨酸复配溶液对金黄色葡萄球菌的抑菌效果见表5。

表5 壳聚糖和ε-聚赖氨酸复配溶液对金黄色葡萄球菌的抑菌效果Table 5 The antibacterial activity of the combination of chitosan and ε-polylysine against Staphylococcus aureus
由表5可知,当抑制时间为24、48 h时,壳聚糖和ε-聚赖氨酸的 FICI值为 1.01~1.29(1<FICI≤2),由此提示壳聚糖对金黄色葡萄球菌的相互作用的类型为无关效应。当抑制时间为72 h时,壳聚糖和ε-聚赖氨酸复配溶液对金黄色葡萄球菌具有叠加抑菌的作用(0.5<FICI≤1)。由此可知:当抑制时间为72 h时,16 μg/mL ε-聚赖氨酸和 100 μg/mL 壳聚糖的复配溶液对金黄色葡萄球菌的抑制作用最佳。
2.3.2 壳聚糖和ε-聚赖氨酸对大肠杆菌的影响
壳聚糖和ε-聚赖氨酸复配溶液对大肠杆菌的抑菌效果见表6。
由表6可知,当抑制时间为48、72 h时,壳聚糖和ε-聚赖氨酸复配溶液对大肠杆菌均具有叠加抑菌的作用(0.5<FICI≤1)。与抑制时间24 h相比,在抑制时间为48、72 h条件下,壳聚糖和ε-聚赖氨酸复配溶液对大肠杆菌叠加抑菌作用更加稳定。由此可知,抑制时间为 72 h 时,6 μg/mL ε-聚赖氨酸和 100 μg/mL 壳聚糖的复配溶液对大肠杆菌的抑制作用最佳。
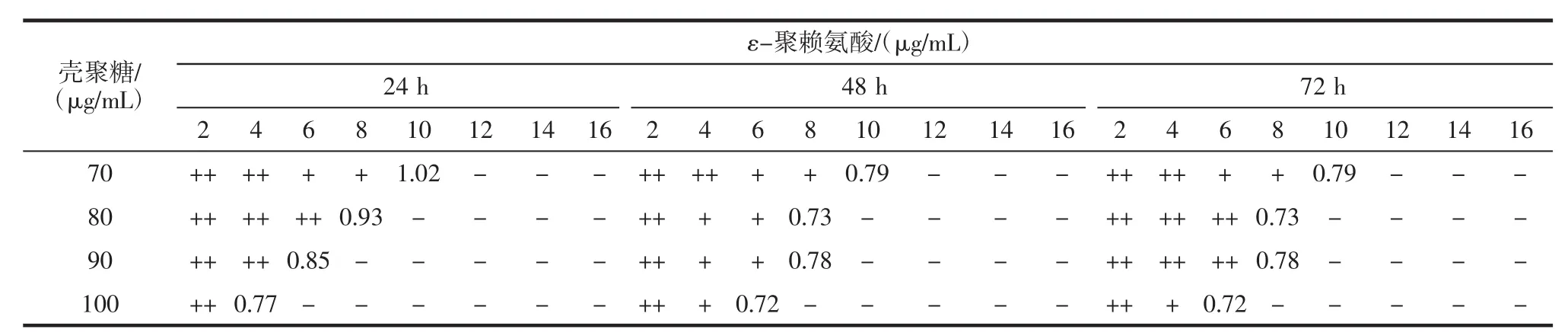
表6 壳聚糖和ε-聚赖氨酸复配溶液对大肠杆菌的抑菌效果Table 6 The antibacterial activity of the combination of chitosan and ε-polylysine against Escherichia coli
2.3.3 不同抑菌剂对大肠杆菌和金黄色葡萄球菌蛋白质泄漏量的影响
不同抑菌剂对金黄色葡萄球菌的蛋白质泄漏量的影响见图1。
通过测定蛋白质的泄漏可以用于评价抑菌剂的抑菌效果。由图1可知,壳聚糖、ε-聚赖氨酸及壳聚糖和ε-聚赖氨酸复配溶液对金黄色葡萄球菌的蛋白质泄漏量显著高于空白对照组(P<0.05)。由此可知,壳聚糖、ε-聚赖氨酸及其复配溶液能够导致金黄色葡萄球菌的蛋白质发生泄漏,由此导致金黄色葡萄球菌的失活。壳聚糖和ε-聚赖氨酸复配溶液导致的金黄色葡萄球菌蛋白质泄漏作用显著高于单独使用壳聚糖和ε-聚赖氨酸(P<0.05)。由此可知,壳聚糖和ε-聚赖氨酸复配溶液对金黄色葡萄球菌的抑菌活性强于壳聚糖和ε-聚赖氨酸单独使用的抑菌效果。
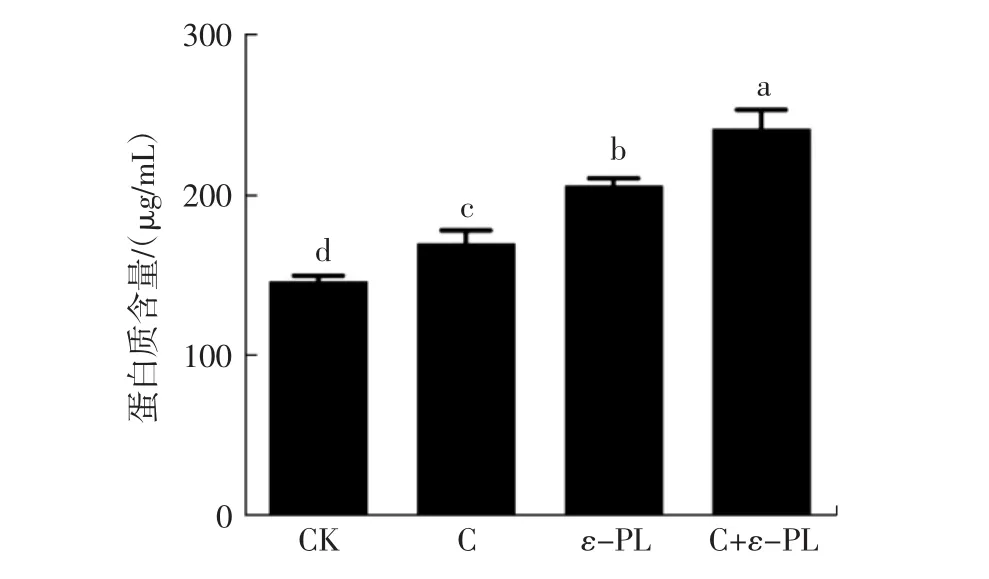
图1 不同抑菌剂对金黄色葡萄球菌的蛋白质泄露量的影响Fig.1 Effect of different preservative on the protein released from Staphylococcus aureus
不同抑菌剂对大肠杆菌的蛋白质泄漏量的影响见图2。
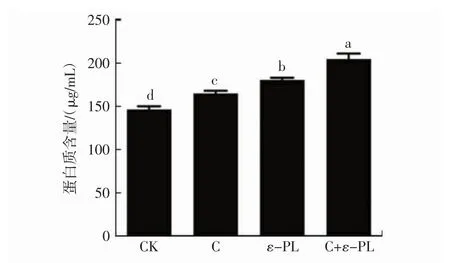
图2 不同抑菌剂对大肠杆菌的蛋白质泄漏量的影响Fig.2 Effect of different preservative on the protein released from Escherichia coli
由图2可知,壳聚糖、ε-聚赖氨酸及壳聚糖和ε-聚赖氨酸复配溶液对大肠杆菌的蛋白质泄漏量显著高于空白对照组(P<0.05)。由此可知,壳聚糖、ε-聚赖氨酸及其复配溶液能够导致大肠杆菌的蛋白质发生泄漏,导致大肠杆菌失活。壳聚糖和ε-聚赖氨酸复配溶液导致的大肠杆菌的蛋白质泄漏量显著高于单独使用壳聚糖和ε-聚赖氨酸(P<0.05)。
3 讨论与结论
壳聚糖和ε-聚赖氨酸复配溶液会产生聚合物,增加微生物蛋白质的泄漏量,使微生物失活,两者对金黄色葡萄球菌和大肠杆菌具有叠加抑菌作用。6 μg/mL ε-聚赖氨酸和100 μg/mL壳聚糖的复配溶液对大肠杆菌的抑制作用最佳。16 μg/mL ε-聚赖氨酸和 100 μg/mL壳聚糖的复配溶液对金黄色葡萄球菌的抑制作用最佳。叶青青等[21]研究发现壳聚糖/聚赖氨酸复合膜对金黄色葡萄球菌和大肠杆菌具有抑菌作用,试验结果与本研究结果一致。通过研究壳聚糖及ε-聚赖氨酸的复配溶液的抑菌效果,改变过去单一的保鲜方式,提高壳聚糖成膜的均匀性,增加ε-聚赖氨酸保鲜抑菌效果,为两者在天然食品防腐剂中的配合应用提供了理论参考。
