糊米汁对烟叶发酵过程中微生物的影响
2016-04-26李士林王宜君张薄博汤朝起许赣荣
李士林,王宜君,张薄博,汤朝起,许赣荣
(1. 江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122;
2. 上海烟草集团有限责任公司,上海200082)
糊米汁对烟叶发酵过程中微生物的影响
李士林1,王宜君1,张薄博1,汤朝起2,许赣荣1
(1. 江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡214122;
2. 上海烟草集团有限责任公司,上海200082)
摘要:研究了糊米汁对烟叶发酵过程中微生物种群及种群数量的变化,初步了解了糊米汁对烟叶微生物的影响。通过添加糊米汁的培养基对烟叶微生物进行液态培养和固态培养。结果表明:在糊米汁堆积式发酵与糊米汁培养基中,糊米汁对烟叶的好氧细菌、厌氧细菌都有非常明显的抑制作用,糊米汁用量越多,抑制作用越明显;但是在普通培养基中施加糊米汁,却对霉菌和酵母没有明显的抑制作用。糊米汁只在烟叶堆积式固态发酵过程中表现出抑制霉菌和酵母的作用,说明糊米汁抑制微生物生长的机制主要是它具有黏性,施加到烟叶中会使烟叶相互粘结,阻碍了O2的传递进而抑制了霉菌和酵母的生长。
关键词:糊米汁;烟叶;微生物;发酵
糊毛烟主要产自四川什邡、广汉等地,是一种独具特色的地方性原料烟叶[1],主要用于制作雪茄烟[2],其传统制作工艺是将收获、晒制好并进行初步堆积发酵过的烟叶沾上糊米汁,堆积起来进行固态发酵所制成的烟叶,俗称糊毛烟。固态发酵后的烟叶吸食品质得到了明显改善。对于糊米汁在烟叶发酵中所起到的作用鲜有文献报道。烟叶的固态发酵,一般是在低水分含量条件下进行的,目的是防止烟叶的霉变,而添加糊米汁到烟叶时,明显会增加烟叶的含水量,但糊毛烟在数月的发酵过程中,却可避免烟叶的发霉,因此从原理上分析,在烟叶中施加糊米汁,有抑制烟叶微生物发酵霉变的作用。烟叶发酵主要是烟叶中自带的微生物与多种复合酶体系的共同作用。糊米汁是否影响烟叶微生物的代谢活动是个值得研究的课题。本文中,笔者就糊米汁对烟叶自带微生物的作用进行研究,以期为糊米汁烟叶发酵提供研究基础。
1材料与方法
1.1材料与仪器
上部烟叶,由上海烟草集团有限责任公司提供,为2012年福建烟叶;FA1004型电子天平,上海舜宇恒平科学仪器有限公司;PL602-S型电子天平,Mettler Toledo仪器上海仪器有限公司;PB-10 pH计、Sartorius MA-40型红外线水分测试仪,德国赛多利斯公司;PYX-XHS-405电热恒温培养箱,上海跃进医疗器械厂;SW-CJ-IFD超净工作台,苏州安泰空气技术公司。
细菌液态培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,去离子水1 L,pH7.0~7.2,121 ℃灭菌20 min[3]。
细菌琼脂培养基:在细菌液态培养基基础上添加20 g琼脂。
霉菌液态培养基:蛋白胨5 g,葡萄糖10 g,KH2PO41 g,MgSO4·7H2O 0.5 g,氯霉素0.1 g,蒸馏水1 L[4]。
霉菌琼脂培养基:在霉菌液态培养基基础上添加20 g琼脂。
酵母液态培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 L,pH6.0[5]。
酵母琼脂培养基:在酵母液态培养基基础上添加20 g琼脂。
1.2实验方法
1.2.1糊米汁的制作方法
取适量大米放到铁锅中炒,先中火炒到大米变黄,再大火炒,当大米膨胀成黑色团状时再中火炒,直到炒到大米粘在一团,此过程大约14 min。按料水比1∶ 2.7(g/L)加凉开水,再煮沸10 min,过滤得到糊米汁,其波美度18,pH 3.74[6]。
1.2.2固态发酵方法
三角瓶发酵:称取30~90 g烟叶,喷洒体积分数40%糊米汁,装入500 mL三角瓶中,于培养箱中30 ℃发酵。
框发酵(模拟堆积式发酵):称取5 kg烟叶,喷洒体积分数20%~40%糊米汁,补充适量水使烟叶的水分为40%,装入发酵框中,压紧,于培养箱中30 ℃发酵。
1.3分析方法
将上部烟叶剪成碎片,取烟叶碎片10.0 g于盛有100 mL无菌水的三角瓶中,37 ℃振荡20 min,制成菌悬液。
1.3.1好氧细菌平板计数法
在超净台中将菌悬液稀释成一定浓度,取200 μL均匀涂在细菌琼脂培养基平板中,于培养箱中37 ℃培养24 h。
1.3.2厌氧细菌双层平板计数法
在超净台中取稀释一定浓度的菌悬液200 μL,均匀涂在细菌琼脂培养基平板中,再倒入一层40 ℃左右未凝固的细菌培养基,待冷却凝固后于培养箱中37 ℃培养24 h。
1.3.3酵母和霉菌平板计数法
在超净台中取稀释一定浓度的菌悬液200 μL,均匀涂在霉菌和酵母琼脂培养基平板中,于培养箱中30 ℃培养2~4 d[7]。
(1)
式中:w—烟叶中水分的质量分数;5—200 μL菌悬液折算成1 mL的系数。
2结果与讨论
2.1糊米汁在发酵上部烟叶过程中对微生物种群数量的影响
糊毛烟是将烟叶沾取糊米汁后堆积在一起进行发酵而成的,本实验用框模拟了糊毛烟的发酵方式,设计糊米汁的用量(体积分数)为0、20%、40%,对糊米汁发酵烟叶过程中的霉菌、细菌和酵母的种群数量进行检测,以了解糊米汁在发酵过程中对烟叶微生物的影响。
2.1.1发酵过程中霉菌种群数量的变化
糊毛烟由于经常翻堆,每次翻堆后烟叶水分会降低很多,从而避免了烟叶发霉。本实验为了探究糊米汁在发酵过程对霉菌的影响,故没有进行翻堆。当发现烟叶发霉时停止发酵,测定发酵过程中的霉菌种群数量,结果如图1所示。
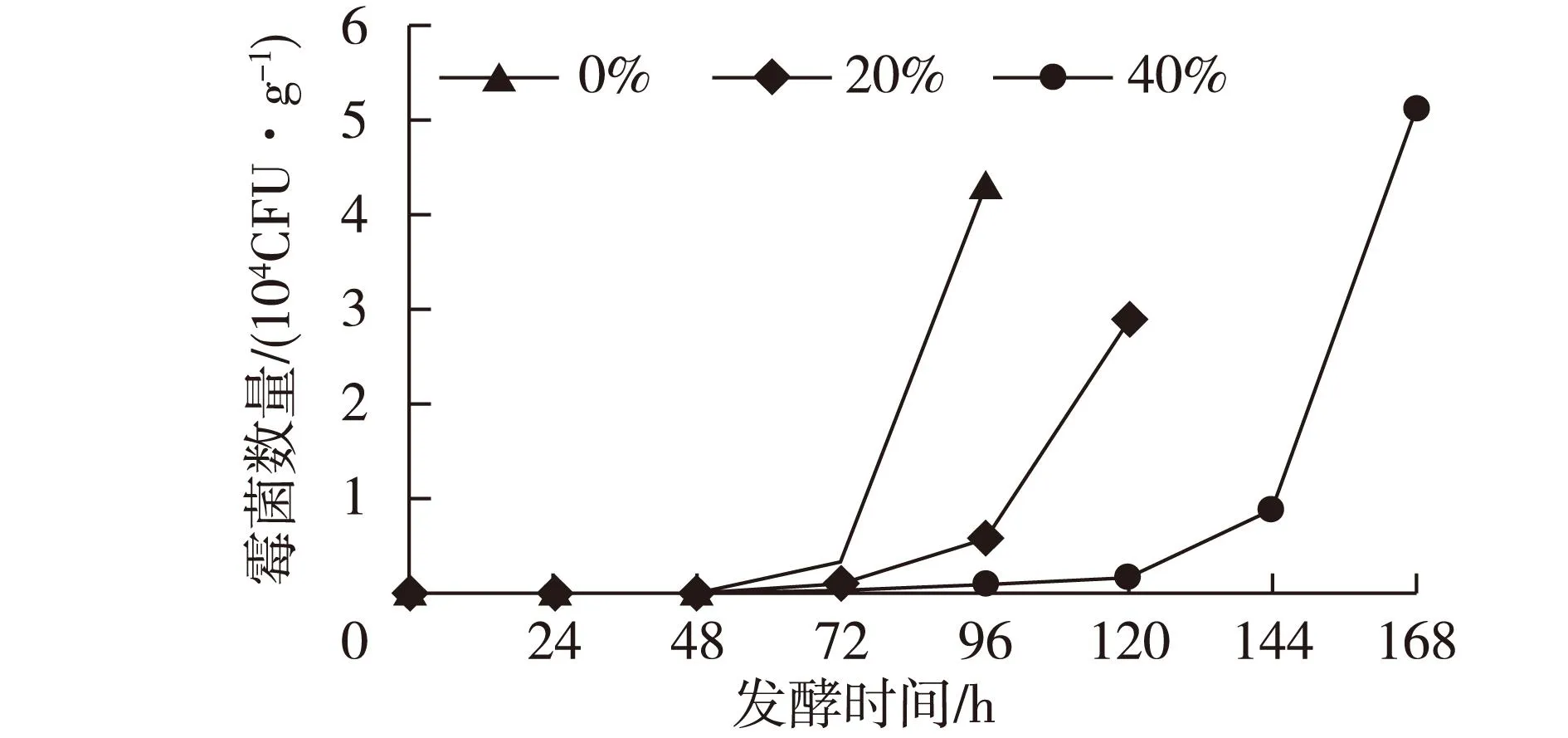
图1 糊米汁用量对烟叶发酵过程中霉菌种群数量的影响Fig.1 Effects of fried-rice leachate content on the amount of mould during tobacoo fermentation
由图1可见:对照组(0%糊米汁)发酵第96 h时烟叶霉变,此时霉菌的种群数量是4.3×104CFU/g;糊米汁用量为20%时,烟叶发酵到第120 h时霉变,此时霉菌的种群数量是2.9×104CFU/g;糊米汁用量为
40%时,烟叶发酵到第168 h时霉变,此时霉菌的种群数量是5.1×104CFU/g。可见,当霉菌的种群数量达到104CFU/g时,烟叶就已经霉变(烟叶上霉变达到肉眼可见程度)。糊米汁在烟叶堆积式固态发酵过程中有着明显的抑制霉菌的作用,糊米汁添加量越多,抑制效果越明显。(实验结果起始霉菌种群数量为0,只能说明笔者所用检测方法里没有检测出来霉菌种群,不代表烟叶本身没有霉菌种群。)
2.1.2发酵过程中细菌的变化
对糊米汁发酵烟叶过程中的好氧细菌和厌氧细菌种群数量进行测定,结果如图2所示。

图2 糊米汁用量对烟叶发酵过程中细菌种群数量的影响Fig.2 Effects of fried-rice leachate content on the amount of bacteria during tobacoo fermentation
由图2可见:发酵过程中烟叶好氧细菌和厌氧细菌均呈递减的趋势,添加糊米汁的发酵过程中,好氧细菌和厌氧细菌递减的幅度均明显大于对照组,说明糊米汁对烟叶的细菌有非常明显的抑制作用,糊米汁用量越多,抑制效果越明显。
2.1.3发酵过程中酵母的变化
对糊米汁发酵烟叶过程中的酵母种群数量进行测定,结果如表1所示。
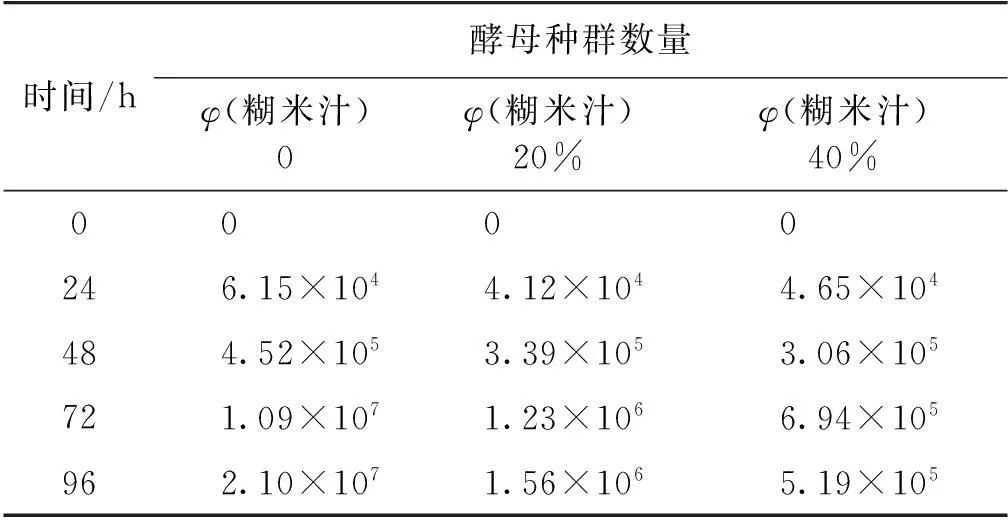
表1 糊米汁用量对烟叶发酵过程中酵母种群数量的影响
由表1可见,对照组发酵过程中烟叶酵母的种群数量迅速增加,添加糊米汁发酵过程中酵母种群数量增加很少,说明糊米汁对烟叶中酵母有较明显的抑制作用,糊米汁用量越多,抑制效果越明显。(实验结果起始酵母种群数量为0,只能说明笔者所用检测方法里没有检测出来酵母种群,不代表烟叶本身没有酵母种群。)
2.2糊米汁对烟叶微生物抑制作用的验证
糊米汁在烟叶堆积式固态发酵过程中对细菌、霉菌和酵母有着明显的抑制作用,为了验证糊米汁是否对微生物有抑制作用,笔者利用三角瓶液态培养和琼脂平板培养进行了验证试验。
2.2.1糊米汁对霉菌的影响
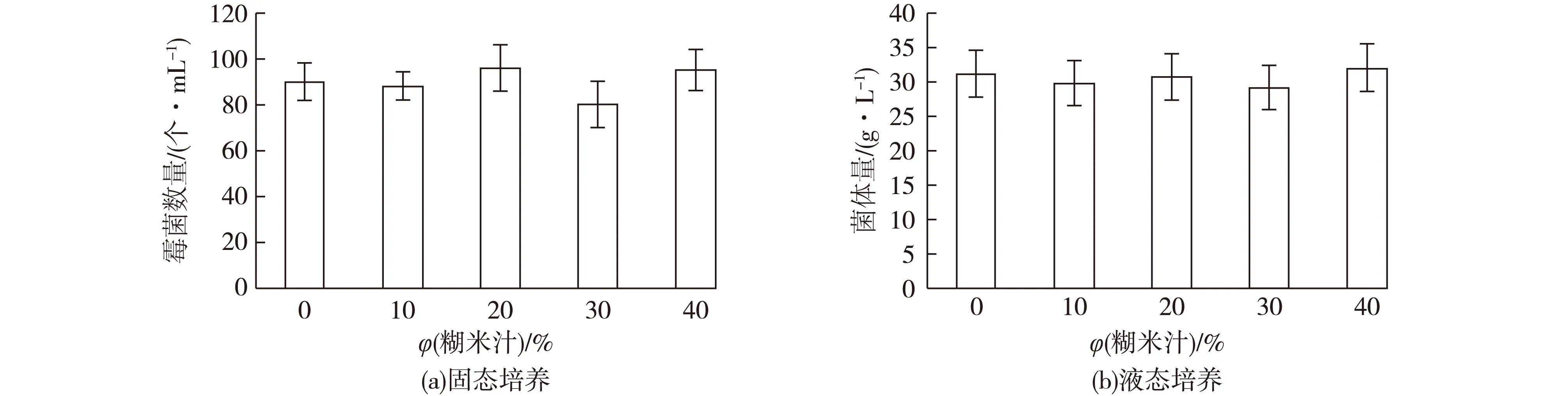
图3 不同糊米汁体积分数培养基对霉菌的影响Fig.3 Effects of different diffirent fried-rice leachate content medium on mold number
将发霉的烟叶用无菌水制备成霉菌孢子悬浮液,吸取等量孢子悬浮液涂于含糊米汁10%、20%、30%和40%的霉菌琼脂培养基上,30 ℃培养3 d后进行平板菌落计数;吸取等量霉菌孢子悬浮液添加到含0~40%糊米汁的100 mL霉菌液态培养基中(500 mL三角瓶),于摇瓶培养箱中,30 ℃、180 r/min培养2 d,培养液过滤烘干后称菌体质量,结果如图3所示。由图3可见,不同浓度糊米汁琼脂培养基中长出的霉菌菌落数基本一致,说明糊米汁本身在固态培养中对霉菌没有明显的抑制作用。不同浓度糊米汁液态培养后霉菌菌体量相差很小,说明糊米汁液态培养对霉菌没有明显的抑制作用。
由前面实验可知,糊米汁在烟叶堆积式发酵过程中对霉菌有明显的抑制作用。这可能是糊米汁具有黏性,在堆积式发酵中会使烟叶相互黏结在一起,阻碍了O2的传递,从而抑制了霉菌的生长。为了验证这一推论,设计不同烟叶填充度进行发酵,称取30~90 g烟叶,喷洒质量分数40%糊米汁,装入500 mL三角瓶中,于培养箱中30 ℃发酵,测定了糊米汁发酵烟叶过程中开始发霉的时间,结果如图4所示。
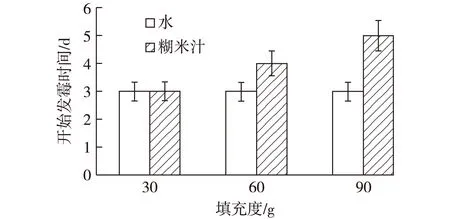
图4 填充度对发酵过程中烟叶开始发霉时间的影响Fig.4 Effects of different filling degree on moldy time of tobacco leaves
由图4可见,当填充度为30 g时,糊米汁发酵与对照组同时发霉,说明在物料比较松散的情况下,糊米汁对霉菌没有抑制作用。当填充度为60 g和90 g时,糊米汁发酵比对照组发霉时间分别延迟1和2 d,说明在物料压紧的情况下糊米汁对霉菌有明显的抑制作用。糊米汁在物料压紧的情况下使烟叶相互黏结在一起,阻碍了O2的传递,进而抑制了霉菌的生长。
2.2.2糊米汁对烟叶细菌的影响
由前面实验可知,糊米汁对烟叶好氧细菌和厌氧细菌有明显的抑制作用,笔者利用糊米汁液态和固态培养来验证糊米汁对好氧细菌和厌氧细菌的抑制作用,结果如图5所示。由图5可知:不同浓度的糊米汁培养基pH也不同(糊米汁本身的pH在3.8左右),本实验同时也探究了糊米汁本身的pH是否是抑制细菌的一个因素。
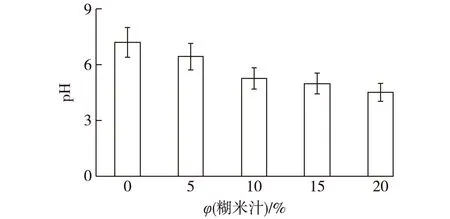
图5 不同糊米汁含量对培养基pH的影响Fig.5 Effect of diffirent fried-rice leachate content on medium pH
将上部烟叶剪成碎片,取烟叶碎片10.0 g于盛有100 mL无菌水的三角瓶中,37 ℃振荡20 min,制成菌悬液,将菌悬液稀释适当倍数涂布于含有0~25%糊米汁的细菌培养基平板中,37 ℃培养24 h后菌落计数;取菌悬液1 mL接种于含0~25%糊米汁的细菌培养基中,37 ℃、200 r/min 培养24 h,取培养液涂平板进行菌落计数,结果如图6~7所示。
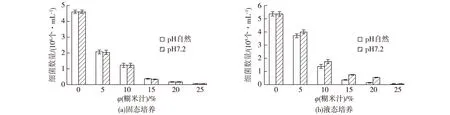
图6 不同糊米汁含量培养基对好氧细菌的影响Fig.6 Effects of different fried-rice leachate content medium on aerobic bacteria number
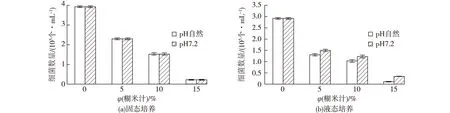
图7 不同糊米汁含量培养基对厌氧细菌的影响Fig.7 Effects of different diffirent fried-rice leachate content medium on anaerobic bacteria number
由图6~图7可见:糊米汁固态和液态培养对烟叶好氧细菌和厌氧细菌均有非常明显的抑制作用;自然pH与pH 7.2的糊米汁固态培养基对烟叶好氧细菌和厌氧细菌均没有显著变化,说明糊米汁的酸性因素在固态发酵过程中对烟叶细菌没有明显的抑制作用,自然pH糊米汁液态培养后烟叶好氧细菌和厌氧细菌的种群数量少于pH 7.2的糊米汁液态培养,说明糊米汁的酸性因素在液态培养中对烟叶细菌有一定的抑制作用,但pH 7.2时的糊米汁对细菌的抑制作用仍然随着糊米汁含量的增加而加强,说明糊米汁除了pH因素外,还有其他因素对细菌有抑制作用。
2.2.3糊米汁抑制酵母的研究

图8 不同糊米汁含量培养基对酵母的影响Fig.8 Effects of different diffirent fried-rice leachate content medium on yeast number
烟叶中只发现一种呈红色的酵母。将该酵母接种于盛有100 mL酵母液态培养基的三角瓶中,30 ℃、200 r/min 培养12 h制成酵母种子液,种子液稀释适当倍数分别涂布于含0~40%糊米汁酵母琼脂培养基平板中,30 ℃培养24 h后菌落计数;取种子液1 mL接种于含0~40%糊米汁液态培养基中,30 ℃、200 r/min 培养24 h,取培养液稀释适当倍数后,分别涂布于含0~40%糊米汁酵母琼脂培养基平板中,30 ℃培养24 h后菌落计数,结果如图8所示。由图8可见,糊米汁固态和液态培养对烟叶酵母均没有明显的抑制作用,这与2.1.3节的实验结果是不一致的。糊米汁在堆积式发酵中对酵母的抑制作用原理可能与抑制霉菌的原理是一样的。本实验进一步设计不同烟叶填充度进行发酵,称取30~90 g烟叶,喷洒质量分数40%糊米汁,装入500 mL三角瓶中,于培养箱中30 ℃发酵96 h后测定酵母的种群数量,结果如图9所示。
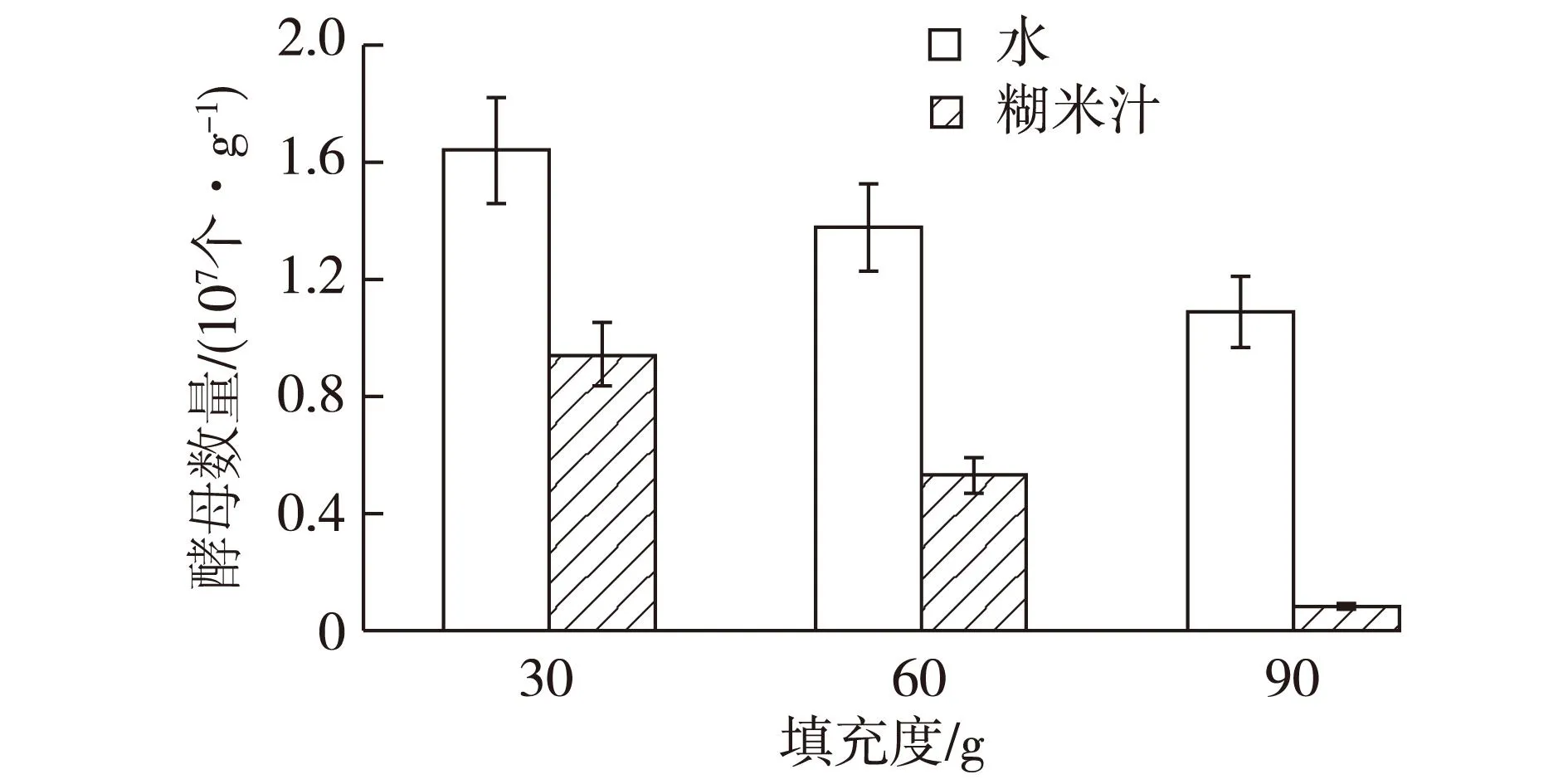
图9 不同填充度发酵过程中烟叶酵母种群数量的影响Fig.9 Effects of different filling degree on yeast number on the tobacco leaves
由图9可见,填充度越高,酵母的种群数量越少,说明O2的传递会明显的影响酵母的生长。在相同填充度条件下,糊米汁发酵比水发酵的酵母种群数量明显少。这可能是由于糊米汁的黏性,使烟叶相互黏结在一起,使物料间O2的传递比对照组(加水)慢,从而更加抑制了酵母的生长。
2.3结论
通过研究糊米汁框发酵和糊米汁培养过程中烟叶微生物的变化,初步确定了糊米汁对烟叶微生物的作用:糊米汁对烟叶的好氧细菌、厌氧细菌有非常明显的抑制作用,糊米汁用量越多,抑制作用越明显;糊米汁本身对霉菌和酵母没有明显的抑制作用,但在堆积式固态发酵过程中却表现出了抑制霉菌和酵母的作用,这主要是糊米汁具有黏性,可以使烟叶相互黏结,阻碍了O2的传递进而抑制了霉菌和酵母的生长。
参考文献:
[1]周锦龙,徐云进,赵强,等.一种糊毛烟打叶复烤工艺:101773288[P].2010-07-14.
[2]徐云进,纵坤,尚智慧,等.一种改善糊毛烟吸味质量的处理料:101731739[P].2010-06-16.
[3]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
[4]苏世彦.真菌培养基原理分析与应用[J].食品科学,1994(5):45-51.
[5]董晓燕.生物化学实验[M].北京:化学工业出版社,2007.
[6]周锦龙,鲍穗,李凌,等.糊米制作工艺:101700140[P].2010-05-15
[7]沈萍,范秀容,李广斌.微生物试验[M].3版.北京:高等教育出版社,1999:215.
(责任编辑管珺)
Effect of roasted-rice leachate on tabacco microorganismsduring fermentation process
LI Shilin1,WANG Yijun1,ZHANG Bobo1,TANG Zhaoqi2,XU Ganrong1
(1. Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China; 2. Shanghai Tobacco Group Co. Ltd.,Shanghai 200082,China)
Abstract:Microbial changes in tobacco leaves during roasted-rice leachate fermentation were studied,to reveal the impact of roasted-rice leachate on tobacco microbial fermentation, both in liquid culture and solid-state culture. Roasted-rice leachate inhibited aerobic and anaerobic bacteria. The more roasted-rice leachate used,the more inhibition observed. Roasted-rice leachate itself did not inhibit mold and yeast,but it showed to suppress the growth of mold and yeast during stacked solid state fermentation process. The phenomenon might be caused by the extraordinary viscosity of fried-rice leachate,which could hinder the oxygen transfer and thus inhibit the growth of aerobic molds.
Keywords:roasted-rice leachate;tobacco leaves;microorganism;fermentation
中图分类号:Q93
文献标志码:A
文章编号:1672-3678(2016)02-0041-06
作者简介:李士林(1987—),男,山东临沂人,研究方向:发酵工学;许赣荣(联系人),教授,E-mail:grxu123@126.com
基金项目:上海烟草集团有限责任公司科技项目(SZBCW201000744)
收稿日期:2014-02-26
doi:10.3969/j.issn.1672-3678.2016.02.008
