人轮状病毒G1P[8]型感染树鼩原代小肠上皮细胞模型的建立
2017-05-18李道群彭杰甸子芩王文广张阿梅冯悦牛华代解杰夏雪山
李道群,彭杰,甸子芩,,王文广,张阿梅,冯悦,牛华,代解杰*,夏雪山*
(1. 昆明理工大学生命科学与技术学院,昆明 650500;2. 昆明理工大学附属医院(云南省第一人民医院),昆明 650032;3. 中国医学科学院/北京协和医学院医学生物学研究所树鼩标准化研究与疾病动物模型创建省创新团队,昆明 650118)
研究报告
人轮状病毒G1P[8]型感染树鼩原代小肠上皮细胞模型的建立
李道群1,彭杰1,甸子芩1,2,王文广3,张阿梅1,冯悦1,牛华2,代解杰3*,夏雪山1*
(1. 昆明理工大学生命科学与技术学院,昆明 650500;2. 昆明理工大学附属医院(云南省第一人民医院),昆明 650032;3. 中国医学科学院/北京协和医学院医学生物学研究所树鼩标准化研究与疾病动物模型创建省创新团队,昆明 650118)
目的 探究树鼩原代小肠上皮细胞的增殖特性,建立人轮状G1P[8]型病毒体外感染树鼩原代小肠上皮的细胞模型。方法 采用胶原酶XI和中性蛋白酶I联合消化法获取树鼩原代小肠上皮细胞,经纯化和鉴定,用人轮状G1P[8]型病毒感染细胞,测定培养上清的病毒滴度和载量,并用Western blot和间接免疫荧光检测法检测人轮状病毒G1P[8]型VP6蛋白的表达情况,评价人轮状G1P[8]型病毒体外对树鼩原代小肠上皮细胞的感染性。结果 分离的树鼩原代小肠上皮细胞经传代培养纯化,获得纯度达90%树鼩原代小肠上皮细胞。对树鼩原代小肠上皮细胞、原代肾细胞、HCT116细胞和MA104细胞进行轮状病毒易感性比较,确定树鼩原代小肠上皮细胞可以被人轮状病毒G1P[8]感染,培养72 h时病毒滴度可达到2.0×105TCID50/mL。经Western blot和间接免疫荧光发现在人轮状G1P[8]型病毒感染树鼩原代小肠上皮细胞1~5 d均能检测到人轮状病毒VP6蛋白的表达和分布。结论 确立了树鼩原代小肠上皮细胞的分离、纯化与培养方法,并建立了人轮状G1P[8]型病毒感染树鼩原代小肠上皮细胞的体外模型。
树鼩原代小肠上皮细胞;轮状病毒;病毒增殖特性;VP6蛋白
轮状病毒(rotavirus, RV)感染是导致全球范围内五岁以下婴幼儿急性肠胃炎脱水腹泻的主要原因,每年会导致44万婴幼儿死亡,对全世界婴幼儿的公共健康构成了严重威胁[1]。中国是RV感染的多发区和高发区,婴幼儿感染率高达65%,以人轮状G1P[8]型病毒株感染群体为主[2]。虽然对RV的研究已经有几十年的历史,但是目前仍没有治疗RV的特效药物和理想的疫苗[3]。RV感染的动物模型可分为感染模型与疾病模型,成年猪、猴、牛、羊和鼠等可被病毒感染,但不出现腹泻等显著临床症状,成为感染模型;幼龄乳鼠和无菌猪可被病毒感染并出现腹泻等典型疾病症状,称为疾病模型。RV感染大型哺乳动物饲养成本高、技术操作难度较大,而小型动物繁殖能力强、易于操作和成本低等优势,使得RV感染小型哺乳动物越来越得到人们的重视。由于动物属性、病毒与动物对应性等因素的影响,RV感染模型、尤其人源RV感染模型与疾病模型较难建立,导致RV感染与致病的机制研究受到较大限制[4-6]。
树鼩(Tupaiabelangeri, tree shrew)是一种攀鼩目的小型哺乳类动物,易饲养、管理和经济低廉,进化程度较高,在新陈代谢和解剖学特性等方面与人接近,是一种在生物医学研究中很有应用价值的新型实验动物。已有研究证实,多数对多种人类病毒易感,包括人甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)和单纯疱疹病毒(HSV-1和HSV-2)等[7-10]。万新邦等[11]用含有RV的婴儿粪便悬液对树鼩进行灌胃,首次证实树鼩对人RV易感。庞其方[12]和朱婉萍等[13]分别用中草药和牛乳铁蛋白对感染人RV的树鼩模型进行治疗,树鼩排毒滴度、腹泻和死亡率均得到改善。RV对树鼩感染及致病性的初步确认,对在细胞层次探究RV的感染与致病性提出新的要求。
本研究成功建立了一种树鼩原代小肠上皮细胞的分离方法,并进行了纯化和鉴定,初步建立了人RV G1P[8]型病毒体外感染树鼩原代树鼩小肠上皮细胞模型。人RV感染树鼩动物小肠上皮细胞模型的建立,可以为RV感染树鼩原代小肠上皮细胞致病性研究提供新的证据,并佐证树鼩疾病动物模型建立的可行性。
1 材料与方法
1.1 实验动物、病毒株和细胞
选用清洁级的3~4月龄子一代雄性健康中缅树鼩5只,体重130~145 g,购自中国医学科学院医学生物学研究所树鼩种质资源中心【SCXK(滇)2013-0001】,饲养和实验操作均在昆明理工大学实验动物中心进行。
RV标准株(菌株编号:GDV085),来自中国典型培养物保藏中心,以MA104细胞进行扩增培养,经测定其滴度为2.0×106TCID50/mL。
1.2 树鼩原代小肠上皮细胞的培养和鉴定
按体重比例对树鼩腹腔注射苯巴比妥进行麻醉。解剖取出小肠,延纵轴切开,用镊子剔除肠道内容物和肠膜粘液,用含双倍青链霉素的D-Hanks’洗涤5遍,将其剪成1 mm3左右的肉糜状物,然后转移至100 U/mL胶原酶XI和0.04 mg/mL的中性蛋白酶I的混合消化酶液中,37℃水浴30 min,每隔10 min漩涡振荡30 s。待30 min消化完全后取出500 r/min离心5 min,弃去上清酶液,加入完全培养基洗涤1遍,然后加入含有2%山梨醇的组织分散液,500 r/min离心3 min(该步骤重复5次)。收集上清液转移至新的离心管中,500 r/min离心15 min,弃去上清液,重悬细胞,接入T-25培养瓶中,37 ℃ 5% CO2培养,2 d更换1次培养液,至传代。
为了获取较为纯的树鼩原代小肠上皮细胞,本实验采用了相差消化法和相差贴壁法。经2~3代次培养即可获得较纯的小肠上皮细胞。鉴定使用角蛋白18(CK18)抗体(购自Abcam,使用根据说明书)进行免疫荧光检测上皮样细胞的比例和纯度。1.3 RV病毒感染树鼩原代小肠上皮细胞和病毒增殖特性
按感染复数为0.1(MOI=0.1)的RV病毒感染MA104细胞,维持培养至72 h时收取培养上清,为用于感染树鼩原代小肠上皮细胞的病毒液。以感染复数为3(MOI=3)的RV病毒接种原代树鼩原代小肠上皮细胞,同时设MA104细胞作为阳性对照,在培养箱中孵育2 h后弃除上清,使用PBS洗5遍,以最后1次洗液作为0 d对照,加入含1μg/mL胰酶的无血清DMEM维持培养液,放入细胞培养箱培养每隔12 h后收集感染上清,然后提取上清中的核酸,一步法RT-PCR检测病毒核酸,上游引物VP6-F:TGTATGTATGGATGAAATGGC,下游引物VP6-R:TAATGGAAGCTACCGTGAAA,扩增片段为893 bp;TaqMan探针法荧光定量PCR检测上清中的病毒载量,定量上游引物:RV-F1(891-914 bp)-TTATTATTTCAGTTGATGCGTCCA,下游引物RV-R1(1034-1055 bp)-TGCTAACAGAGTTTCATTTGCG,探针序列为:Probe(947-972 bp):TCCACAAGCACAACCTTTTCAGCACC,扩增片段为165 bp,具体操作步骤参阅[14]。
1.4 RV病毒滴度检测
采用组织细胞培养半数感染剂量(50% tissue culture infective dose, TCID50)法测定,在96孔培养板中进行,用不含血清的DMEM培养液将其按照1∶10稀释成10-1~10-6等系列浓度,将培养成单层MA104细胞的96孔板用PBS洗涤2遍,再将不同稀释度的病毒加入到96孔细胞培养板每孔100 μL,每个浓度重复6次。设置正常对照细胞,37℃孵育2 h后吸弃病毒液,加入无血清的细胞培养液200 μL/孔(含1 μL/mL胰酶)。37℃ 5%CO2培养,连续观察。当能够出现细胞病变CPE的最低稀释度的病毒孔中,不再继续出现CPE时,计数每个稀释度出现CPE的细胞孔数,按照Reed-Muench方法计算病毒的TCID50。
1.5 RV VP6蛋白在树鼩原代小肠上皮细胞中的表达
Western blot 检测RV VP6蛋白表达。以感染复数为3(MOI=3)将RV接种到铺有树鼩原代小肠上皮细胞的6孔板中,分别收取1、3 d和5 d被感染细胞,提取总蛋白,蛋白定量后,上样量均为20 μg,进行SDS-PAGE电泳,转膜后用一抗和二抗进行细胞中RV VP6蛋白检测(anti-mouse VP6 一抗和HRP二抗均购自Abcam,具体使用根据说明书)。
间接免疫荧光法检测RV VP6蛋白在树鼩小肠上皮细胞中的表达分布情况。细胞感染48 h后甲醇固定,经一抗和二抗标记,荧光显微镜下检测被感染细胞中VP6蛋白的分布情况(anti-mouse VP6一抗和 goat anti-mouse FITC二抗均购自Abcam,具体使用参照说明书)。
2 结果
2.1 树鼩原代小肠上皮细胞的分离及鉴定
细胞培养条件:DMEM(88%)+ FBS(10%)+青链霉素(1%)+EGF(10 ng/mL)+DMSO(1%)+肝素钠(100 μg/mL)+胰岛素(2.5 μg/mL),将树鼩的原代小肠上皮细胞分离后进行培养至第5天,可见细胞形态呈现出不规则多边形的上皮样,细胞之间轮廓清晰(图1a),生长旺盛。经过2代次纯化,红圈部分中的成纤维细胞逐渐减少(图1b、c),通过角蛋白CK18抗体进行免疫荧光鉴定,可见几乎所有的细胞都呈现出绿色荧光,树鼩原代小肠上皮细胞的纯度达90%(图1d)。

注:a:树鼩原代小肠上皮细胞(100×);b:经过第1代纯化的原代小肠上皮细胞形态(100×);c:经过第2代纯化的原代小肠上皮细胞形态(100×);d:原代小肠上皮细胞免疫组化染色(100×)。红圈部分为夹杂着成纤维细胞的树鼩原代小肠上皮细胞。图1 树鼩原代小肠上皮细胞的培养、纯化和鉴定Note. a: Primary small intestinal epithelial cells from tree shrew (100×); b: Morphology of the first generation primary intestinal epithelial cells after of purification (100×); c: Morphology of the second generation primary intestinal epithelial cells after purification (100×); d: Immunohistochemical staining of primary small intestinal epithelial cells (100×).Fig.1 Culture, purification and identification of the primary small intestinal epithelial cells from tree shrew
2.2 树鼩原代小肠上皮细胞的培养和增殖
通过MTT法测定树鼩原代小肠上皮细胞细胞活力(维持培养至16 d),并绘制细胞生长增殖曲线(图2)。结果表明树鼩原代小肠上皮细胞在培养至10 d时,细胞的增殖一直呈现上升趋势比MA104达到增殖平台期慢些(10 d左右达到增殖平台期)。而10~12 d的平台期中,树鼩的原代小肠上皮细胞增殖能力较MA104细胞呈下降趋势,同时12 d以后细胞增殖均开始下降,表明原代小肠上皮细胞和MA104细胞开始发生凋亡。
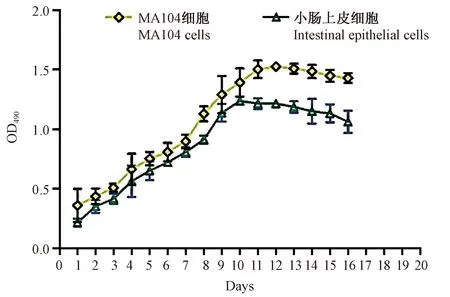
图2 树鼩小肠上皮细胞增殖曲线Fig.2 Growth curves of the tree shrew small intestinal epithelial cells
2.3 RV感染树鼩原代小肠上皮细胞与病毒的增殖
将RV病毒接种至单层MA104细胞中,添加1 μg/mL胰酶的无血清DMEM培养液培养72 h后收取上清。经测定病毒的滴度为2.0×106TCID50/mL。
收集RV感染树鼩原代小肠上皮细胞的0 d洗涤液和未感染及感染5 d后的培养上清,提取病毒核酸进行RT-PCR检测,结果如图3a所示,树鼩原代小肠上皮细胞、树鼩原代肾细胞、HCT116和MA104细胞的培养上清中均扩增检测到核酸片段,大小为165 bp,而未感染阴性对照组未扩增出目的条带。
用实验室建立的Taqman探针法检测感染前后上清的病毒载量,发现感染树鼩原代小肠上皮细胞培养上清的病毒载量为5.32×104copies/μL,明显高于其0 d洗液(1.6×102copies/μL);对照组MA104细胞感染后的培养上清病毒载量(7.75×106copies/μL)和树鼩原代小肠细胞感染后差异显著,相对0 d洗液均增殖,与树鼩原代肾原代(1.7×104copies/μL)和HCT116(7.52×104copies/μL)差异无显著性,如图3-(b)所示。

注:(a)M. DL2000 marker;1. RV感染树鼩原代小肠上皮细胞0 d洗液; 2. RV感染树鼩原代肾细胞培养5 d上清; 3. RV感染树鼩原代小肠上皮细胞培养5 d上清; 4. RV感染HCT116培养5 d上清; 5. RV感染MA104培养5 d上清; 6. 未感染树鼩小肠上皮细胞培养5 d上清。(b)ns为差异无显著性;*表示P<0.05差异有显著性。图3 RV感染树鼩原代小肠上皮细胞的检测Note. a: M, DL2000 marker. 1. Wash solution of the small intestinal epithelial cells after RV infection; 2. The culture supernatant of primary renal cells of tree shrew at 5 days after RV infection. 3. The culture supernatant of primary small intestinal epithelial cells of tree shrew at 5 days after infection. 4. The culture supernatant of HCT116 cells at 5 days after infection. 5. The culture supernatant of MA104 cells at 5 days after infection. b: ns represents non-significant differences; *P<0.05, significant differences.WS:wash solution;PRC:primary renal cells;IEC:Intestinal epithelial cells.Fig.3 Detection of RV-infected primary small intestinal epithelial cells of the tree shrew
将RV按最适感染复数(MOI=3)接种至单层树鼩原代小肠上皮细胞中,然后每隔12 h收取培养上清,连续收取5 d,测定其载量和滴度,绘制RV感染树鼩原代小肠上皮细胞的增殖曲线(图4)。病毒感染树鼩原代小肠上皮细胞后,滴度和载量呈现逐渐递增,两者变化基本一致,在轮状病毒感染72 h后,病毒滴度和载量均出现最大值2.0×105TCID50/mL和约为1×106copies/mL,之后出现了上下波动的状况,通过0~120 h的RV感染滴度和载量变化趋势,说明RV病毒能够在树鼩原代小肠上皮细胞上复制和增殖。

图4 RV在树鼩原代小肠上皮细胞中的增殖曲线Fig.4 Proliferation curves of RV in the primary small intestinal epithelial cells of tree shrew
2.4 Western blot 检测RV VP6蛋白在树鼩原代小肠上皮细胞中的表达
原代小肠上皮细胞感染后的第1天就可以检测到RV VP6蛋白的表达,同时在5 d内均能够检测到RV VP6蛋白表达。其中第1天表达量低,第5天表达较高(见图5)。未感染RV病毒5 d原代小肠上皮细胞(阴性对照)未检测到VP6蛋白的表达,阳性对照RV感染MA104细胞5 d可检到VP6蛋白表达。

图5 Western blot检测RV VP6蛋白在树鼩原代小肠上皮细胞中的表达Fig.5 Western blot results of the expression of RV VP6 protein in the primary small intestinal epithelial cells of tree shrew
免疫荧光检测RV感染48 h的树鼩原代小肠上皮细胞,结果表明:RV VP6蛋白表达情况相对于阴性未感染轮状病毒的树鼩原代小肠上皮细胞来说,只能见到DAPI复染的细胞核(见图6)。而RV感染树鼩原代小肠上皮细胞可以观察到VP6蛋白分布于细胞核的边缘,主要围绕在细胞的胞质中,表明RVVP6蛋白主要在被感染细胞的细胞质中表达,并且在细胞内进行RV复制活动。这一现象和同一时间段RV感染宿主MA104细胞后的现象相一致。

图6 免疫荧光检测RV VP6在树鼩原代小肠上皮细胞中的表达Fig.6 Expression of RV VP6 protein in the primary small intestinal epithelial cells of tree shrew detected by immunofluorescence
3 讨论
RV感染动物模型主要是以幼龄小鼠、乳鼠、无菌猪、兔以及猴作为研究对象,但是小鼠在遗传和亲缘关系上与人较远,而非人灵长类的猴等大型哺乳类动物的成本较高。树鼩作为一种新的低等灵长类动物,因其与人类的亲缘关系较近、成本低、繁育周期短等优点,现已被广泛应用于人类相关重大疾病的研究[7]。最近,庞其方[12]和朱婉萍等[13]在与人发病机理相似的树鼩感染轮状病毒模型基础上,采用药物治疗人RV感染进行了评价,但均未对人RV感染树鼩病毒亚型、树鼩胃肠道细胞易感性、感染特性和细胞病变等方面进行更为详细的研究,限制了其进一步的应用价值。本研究通过建立原代树鼩小肠上皮细胞体外感染模型,从原代小肠上皮细胞增殖、病毒感染原代细胞特征等研究,为RV在树鼩原代小肠上皮细胞内的复制特性和树鼩体内模型的优化提供了依据。采用混合酶液消化法获取树鼩原代小肠上皮细胞,对培养条件优化和细胞鉴定[15,16]。本文对树鼩原代小肠上皮细胞生长增殖特性研究发现:树鼩原代小肠上皮细胞在12 d以内完成对数生长期至平台期,并能在对数期维持生长活力,说明树鼩原代小肠上皮细胞能够满足体外人RV感染实验的条件。
其次,对RV感染树鼩原代小肠上皮细胞5 d内的蛋白和病毒载量的测定,表明RV感染树鼩原代小肠上皮细胞后,确实存在RV RNA的复制和蛋白表达量的增长。同时对RV感染不同宿主细胞(MA104)的研究,病毒表达水平由高到低依次为MA104 > HCT116 >树鼩原代小肠上皮细胞>树鼩原代肾细胞。可能是对非宿主细胞的选择性适应能力不同所造成感染效率存在差异所致。间接免疫荧光结果表明,阴性对照未检测到病毒VP6蛋白表达,仅可见细胞核存在,而阳性MA104细胞可见明显细胞核和病毒蛋白VP6的表达,树鼩原代小肠上皮细胞,同样存在明显的病毒蛋白VP6的表达,证明了轮状病毒对树鼩原代小肠上皮细胞的易感性。
本研究成功分离并优化了树鼩原代小肠上皮细胞的培养条件,得到较纯且生长状态良好的原代小肠上皮细胞,成功建立了人RV G1P[8]型病毒体外感染树鼩小肠上皮细胞模型。通过被感染小肠上皮细胞内外病毒的核酸和蛋白水平的表达检测,均能够证明人RV可以感染体外树鼩原代小肠上皮细胞。这些研究结果为进一步深入研究人RV的体外感染机制奠定了基础,也为人RV树鼩活体感染模型与疾病模型的建立提供佐证。
[1] Shao L, Fischer D D, Kandasamy S,et al. Comparative in vitro and in vivo studies of porcine rotavirus G9P [13] and human rotavirus Wa G1P [8][J]. J Virol, 2016, 90(1): 142-151.
[2] Dian Z, Fan M, Wang B, et al. The prevalence and genotype distribution of rotavirus A infection among children with acute gastroenteritis in Kunming, China[J]. Arch Virol, 2017,162(1): 281-285.
[3] 黄敏, 黄英. 轮状病毒腹泻研究进展[J]. 华西医学, 2014, 29(4): 780-782.
[4] 宋丽军, 赵文昌, 谭晓梅, 等. Wa 株轮状病毒感染昆明小鼠乳鼠腹泻模型的建立及影响因素考察[J]. 辽宁中医药大学学报, 2013, 15(4): 11-14.
[5] 陈涣. 中药止泻液对鼠轮状病毒肠炎肠道水通道蛋白影响的研究[D]. 广州医学院, 2009.
[6] 罗军, 孙晓梅, 宋志忠, 等. 轮状病毒感染实验动物模型的研究进展[J]. 实验动物科学 ISTIC, 2015, 32(1): 48-50, 54.
[7] 郑永唐, 姚永刚, 徐林. 树鼩基础生物学与疾病模型[M]. 云南科技出版社,2014.
[8] 陈瑾, 代解杰, 孙晓梅. 树鼩肝炎动物模型的研究进展[J]. 中国比较医学杂志, 2008, 18(2): 59-62.
[9] 崔照琼, 杨卫, 李艳琼, 等. 树鼩 HSV-1 感染模型的建立[J].中国病原生物学杂志, 2016,11(4):325-328.
[10] 戴长柏. 人单纯疱疹病毒Ⅱ型 (HSV-II) 实验感染树鼩的研究[J]. 动物学研究, 1985, 6(3): 53, 71
[11] 万新邦, 庞其方, 丘福禧, 等. 成年的中国云南树鼩对人轮状病毒易感性的实验研究[J]. 中华微生物学和免疫学杂志, 1985, 5(4): 304-306.
[12] 庞其方, 万新邦, 丘福喜. 中草药 “秋泻灵”实验治疗树鼩人工感染轮状病毒肠炎的研究[J]. 昆明医学院学报, 1983, 4(3): 7.
[13] 朱婉萍, 孔繁智. 牛乳铁蛋白对感染轮状病毒树鼩的治疗试验[J]. 中国现代应用药学, 2012, 29(5): 397-400.
[14] 彭杰, 胡晓星, 冯悦, 等. 人 G1 型轮状病毒 TaqMan 荧光定量检测方法的建立与应用[J]. 中国人兽共患病学报, 2016, 32(6): 512-517.
[15] Macartney KK, Baumgart DC, Carding SR, et al. Primary murine small intestinal epithelial cells, maintained in long-term culture, are susceptible to rotavirus infection[J]. JVirol, 2000, 74(12): 5597-5603.
[16] 王静, 张彦明, 仝钢, 等. 新生仔猪小肠上皮细胞的分离培养和鉴定[J]. 畜牧兽医学报, 2010, 41(1): 92-98.
Establishment of a model of tree shrew primary small intestinal epithelial cells infected with human rotavirus G1P[8]
LI Dao-qun1,PENG Jie1,DIAN Zi-qin1,2,WANG Wen-guang3,ZHANGA A-mei1,FENG Yue1,NIU Hua2,DAI Jie-jie3*,XIA Xue-shan1*
(1. Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China; 2. The Affiliated Hospital of Kunming University of Science and Technology, Kunming 650034; 3. Yunnan Provincial Innovation Group of Tree Shrew Standard Culture and Animal Model, Institute of Medical Biology,Chinese Academy of Medical Sciences and Peking Union Medical College, Kunming 650118)
Objective To explore the proliferation characteristics of primary small intestinal epithelial cells of tree shrews and the characteristics of human rotavirus (RV) G1P[8] infection to these cells, and establish a model of tree shrew primary small intestinal epithelial cells infected with human rotavirus G1P[8]. Methods The primary small intestinal epithelial cells were obtained by collagenase XI and dispase I digestion from tree shrew. After purification and identification, the obtained primary small intestinal epithelial cells were infected with RV. Then, culture supernatants of infected cells were collected every 12 hours after infection. Viral titer and viral load were subsequently determined. Western blot and indirect immunofluorescence observation were used to detect the expression of RV protein VP6 in the primary cells. The infectivity of RV to the tree shrew primary cells was finally evaluated.Results After purification and identification of primary epithelial cells from the tree shrew, high purity above 90% primary tree shrew small intestinal epithelial cells was obtained. These primary small intestinal epithelial cells could be infected with RV virus by comparing the virus infectivity to primary renal cells, HCT116 cells and MA104 cells. The virus titer reached to 2.0×105TCID50/mL at 72 h after infection. Using Western blot and indirect immunofluorescence observation, the specific viral protein of VP6 was determined to be expressed in the tree shrew primary small intestinal epithelial cells, and were located in the cytoplasm from days 1 to 5. Conclusions The separation, purification and cultivation methods of tree shrew primary small intestinal epithelial cells are successful, and the tree shrew model of RV-infected the tree shrew primary small intestinal epithelial cells is successfully established.
Primary intestinal epithelial cells, Tree shrews;Rotavirus;Virus proliferation;Protein VP6
XIA Xue-shan, E-mail: oliverxia2000@aliyun.com;DAI Jie-jie, E-mail: djj@imbcams.com.cn
国家科技支撑计划项目(编号:2014BAI01B01)。
李道群(1988-),男,博士研究生,研究方向:病毒树鼩模型。E-mail: lidaoqunyq@163.com
夏雪山,教授,研究方向:分子病毒学,E-mail: oliverxia2000@aliyun.com; 代解杰,研究员,主要研究方向:疾病动物模型,E-mail: djj@imbcams.com.cn
Q95-33
A
1005-4847(2017) 02-0111-06
10.3969/j.issn.1005-4847.2017.02.001
2016-12-06
