多花筋骨草高频再生体系的建立
2016-03-17赵佳佳迟德富
赵佳佳,宇 佳,迟德富
(东北林业大学林学院,中国 哈尔滨 150040)
多花筋骨草高频再生体系的建立
赵佳佳,宇佳,迟德富*
(东北林业大学林学院,中国 哈尔滨150040)
摘要为了建立一个高效的多花筋骨草组织培养再生体系,以多花筋骨草嫩叶为外植体,进行了不同激素配比对愈伤组织诱导,不定芽增殖及根诱导.结果表明:6-BA,KT及2,4-D组合从外植体诱导出愈伤;6-BA和NAA组合可从外植体诱导出苗;6-BA可诱导不定芽及不定芽增殖;IBA可诱导根系发生.
关键词多花筋骨草;外植体;愈伤组织;不定芽;组织培养
Establishment of a Complete Plant Regeneration System onAjugaMultiflora
ZHAOJia-jia,YUJia,CHIDe-fu*
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
AbstractTender leaves ofAjugamultiflorawere used to study the effect of different concentration ratios of hormones on the callus induction, adventitious bud multiplication, root genesis and development differentiation. The results showed that callus was induced from explants on the medium with different concentration ratios of 6-BA, KT and 2,4-D. Plant developments are induced by explants on the medium with 6-BA, as well as with NAA.The best hormone for adventitious bud induction and adventitious bud multiplication is 6-BA. Root induction occurs on the medium with IBA.The goal of this research is to establish an effective regeneration system forAjugamultiflora.
Key wordsAjugamultifloraBunge; explant; callus; adventive bud; tissue culture
多花筋骨草(AjugamultifloraBunge)是唇形科(Lamiaceae)筋骨草属(AjugaL.)常绿多年生草本植物.株高25~30 cm,轮伞花序,花冠蓝紫色或蓝色,较集中开放时间为4~5月,种子成熟期在5~6月[1].该植物具有清肺止咳、缓解咽喉肿痛、清热解毒之功效,可用于治疗肝炎、腹泻、外伤出血等病症,对多种细菌性病症有抑制功能[2].近来研究发现该属植物具有收缩血管、抗肿瘤、抑菌等药理活性[3].服用筋骨草以后,临床检测到的白细胞数值增加,血清中谷丙转氨酶的活力显著下降,表明其对病毒性疾病及肿瘤确有一定疗效[4].目前已从该属中分离提取出甾体类、苷类、黄酮类、二萜类及多糖类等活性物质,研究表明该植物所含的蜕皮甾酮能调节核糖体中蛋白的合成,影响核酸mRNA的合成速率,并在一定程度上调节动物体内的血糖血脂,降低胆固醇[5-6].其所含的β-蜕皮甾酮是一种能调控昆虫生长发育的天然化合物,因此具有较高的潜在应用价值.一些学者希望利用蜕皮甾酮来影响昆虫的生长发育或其生理机能,抑制昆虫的生活力和发育速度,从而达到长期有效地控制有害生物种群的目的[7-8].
国内外对筋骨草成分的提取和分离主要以天然植物资源为主,然而许多种类资源有限,数量急剧减少,日渐处于濒危状态.现在多花筋骨草多采用分株繁殖,无法满足实际生产需要.植物离体繁殖不受地理气候条件限制,且能降低成本、缩短生长周期、节省土地,还可保证材料来源一致、遗传背景均一、重复性好.同时,离体保存的材料不易受各种病虫害及杂菌的侵染,有利于种质资源的地区间及国际间的交换[9].世界上已建成许多年产百万苗木的组织培养工厂,繁育了许多种组培苗,组培苗市场已经国际化[10].目前有关多花筋骨草组织培养方面的研究尚未见报道.本研究以多花筋骨草为试验材料,首先通过高效液相法分别测得其根、茎、叶的蜕皮激素含量,发现以叶片中最多,茎次之,根中最少.因此对多花筋骨草叶片进行离体培养,脱分化获得愈伤组织,利用细胞全能性进行再分化,以器官发生型形成完整植株.同时通过叶片离体培养,不经过愈伤组织阶段,直接诱导分化不定芽,研究并得到其高频再生的最适培养基,建立了再生频率高达90%以上的多花筋骨草离体快繁体系.为多花筋骨草的大规模生产、基因转化以及遗传、生理、生化和病理学的研究奠定一定基础.
1材料与方法
1.1试验材料
本试验材料采自辽宁省沈阳福陵森林公园,移栽至东北林业大学林学院实验室.经东北林业大学生命科学学院植物教研室郑宝江副教授鉴定为多花筋骨草.
1.2试验方法
1.2.1外植体处理将叶片于流动自来水下冲洗20 min;在超净工作台上用体积分数(下同)为70%的酒精消毒30 s;无菌水冲洗3次;加入适量的2.5%的NaClO溶液,置100 r/min摇床上8 min;去除NaClO溶液后,再用无菌水彻底冲洗残留的NaClO溶液,约5~6次;最后用无菌滤纸吸去外植体表面的水分;用解剖刀切去叶片边缘,再将其切成1 cm2大小叶片,正面朝上接种于诱导培养基上.
1.2.2培养基及培养条件愈伤诱导培养基:MS+0.2 mg/L 6-BA+0.2mg/L KT+(0,0.2,0.4,0.6,0.8,1.0)mg/L 2,4-D;胚性愈伤诱导培养基:MS+1.0 mg/L 6-BA+0.2 mg/L 2,4-D;不定芽诱导培养基:MS+(0.5,1.0,1.5,2.0) mg/L 6-BA;生根培养基:MS+(0.3,0.6,0.9) mg/L IBA;直接诱导不定芽培养基:MS+0.05 mg/L NAA+(0.5,1.0,1.5,2.0) mg/L 6-BA, 以上培养基均加入20 g/L 蔗糖,5.5~7.0 g/L 琼脂,将pH值调至6.2~6.4.培养条件为温度25 ℃,光照强度2 000 lx,光/暗周期为16 h/8 h.
1.2.3叶片愈伤组织及不定芽的诱导以MS为基本培养基,采用0.2 mg/L 6-BA+0.2 mg/L KT与(0,0.2,0.4,0.6,0.8,1.0 ) mg/L 2,4-D的激素组合对叶片进行愈伤组织诱导,每种培养基接种20瓶,培养25 d,重复3次.将愈伤继代于MS+1 mg/L 6-BA+0.2 mg/L 2,4-D的培养基上,进行多花筋骨草胚性愈伤组织的诱导.将质量较好的胚性愈伤组织转接至MS+(0.5,1.0,1.5,2.0 ) mg/L 6-BA的培养基上,进行不定芽的诱导,培养条件为温度25 ℃,光照强度2 000 lx,光/暗周期为16 h/8 h. 观察不定芽的诱导情况.
1.2.4不定芽的增殖培养用不定芽诱导培养基诱导出密集的不定芽后,切成1 cm2大小的方块进行继代培养,继代培养基与诱导培养基相同,25 d后统计外植体分化情况.
1.2.5丛生芽的生根培养及移栽将诱导的高于4 cm的健壮幼苗转接到生根培养基中.生根培养基为MS+(0.3,0.6,0.9)mg/L IBA,培养25 d后统计生根情况.将形成完整根系的植株移栽到已消毒的蛭石:腐殖土为1∶1的栽培基质中,移栽前要先炼苗5~6 d,即对试管苗提高光强锻炼,同时将瓶口包扎物打开,使其慢慢适应外界环境,增强小苗体质以提高移苗成活率.
1.2.6不经愈伤阶段直接获得不定芽采用MS(蔗糖20 g/L,琼脂5.5~7 g/L,pH值6.2~6.4)培养基,附加(0.5,1.0,1.5,2.0) mg/L 6-BA和 0.05 mg/L NAA的激素组合,研究直接诱导不定芽的高频最佳激素组合.
1.2.7数据统计25 d后进行外植体诱导率的统计,同时观察愈伤组织、不定芽及根的生长状况.
诱导率=(诱导出的愈伤或不定芽个数/未污染的外植体个数)×100%.
2结果与分析
2.16-BA,KT与2,4-D组合对多花筋骨草愈伤诱导的影响
外植体培养8 d时叶片膨大、卷曲,15 d开始出愈伤,并且叶片由深绿变为浅绿,愈伤(图1A)由紧致变得疏散.培养25 d时植物激素 0.2 mg/L 6-BA,0.2 mg/L KT 与不同浓度2,4-D组合对多花筋骨草愈伤组织诱导结果见表1.由表1可见,不添加2,4-D时外植体仅仅膨大卷曲而无愈伤组织;2,4-D为 0.2 mg/L时仅在叶片伤口贴合培养基处有少量愈伤组织并且质地较硬,深绿色;2,4-D为 0.4 mg/L时整个外植体被愈伤覆盖,愈伤组织为疏松颗粒状,黄绿色;0.8 mg/L,1.0 mg/L 的2,4-D培养时整个外植体被愈伤覆盖但愈伤水泽状部分褐化,颜色为乳白色.因此,一定范围内较高浓度的2,4-D有利于多花筋骨草良好愈伤组织的诱导;超过这一浓度范围诱导出的愈伤开始出现水泽状,呈乳白色,并且褐化现象也相对明显;浓度较低时诱导的愈伤较硬、量少、颜色深.若从进一步提高植株再生率来考虑,以0.2 mg/L 6-BA, 0.2 mg/L KT与0.4 mg/L 2,4-D激素组合诱导的愈伤组织为最佳.图1B为植物激素组合诱导的多次继代的松散愈伤.
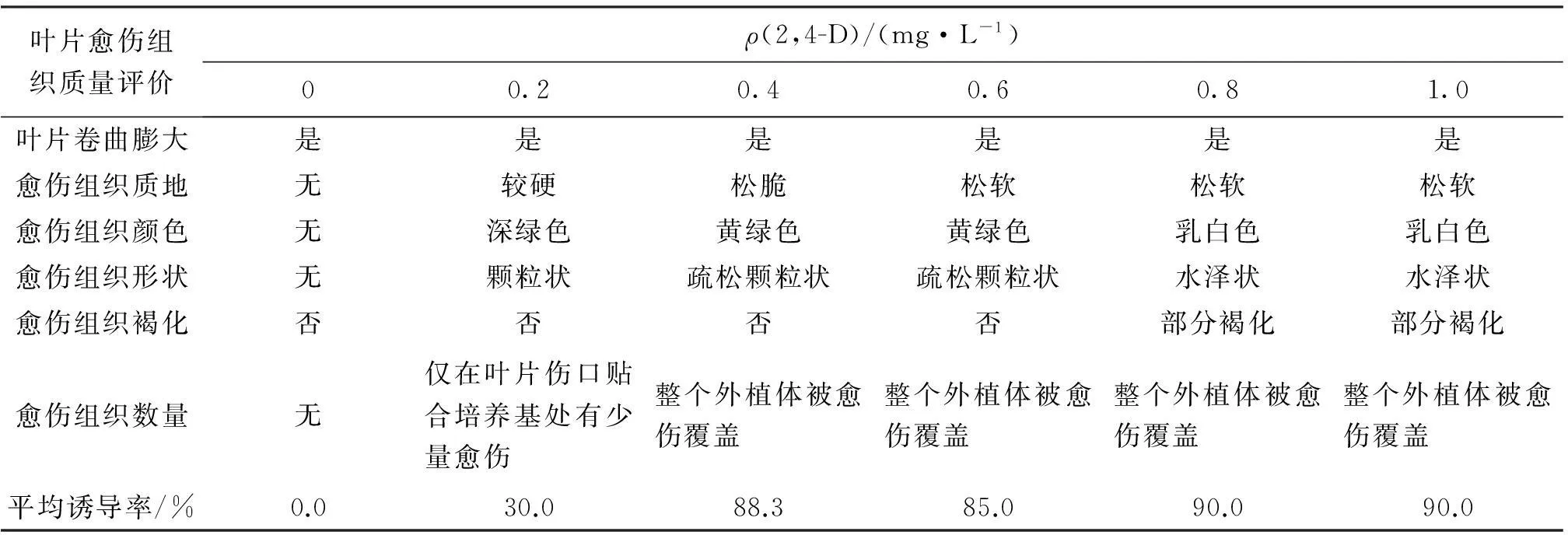
表1 0.2 mg/L 6-BA,0.2 mg/L KT 与不同质量浓度2,4-D 配比的培养基中愈伤诱导情况
2.2愈伤组织再分化的比较
先将愈伤组织接到胚性愈伤组织诱导培养基内进行胚性诱导,再转接到只含 6-BA的MS培养基中进行芽诱导,到第7 d时部分愈伤褐化,无褐化部分愈伤变绿并伴有膨大生长,25 d诱导出芽,但多数芽表现出玻璃化现象(图1C),仅有16.7%的芽正常.对愈伤组织在不同浓度6-BA中不定芽的分化率情况进行比较,分化率结果见表2.由表2可知,6-BA为0.5 mg/L时不能诱导出不定芽,6-BA质量浓度超过1.0 mg/L后即可分化出不定芽,但浓度越高玻璃化率越严重,仅1.0 mg/L 的6-BA能分化出少量正常苗.
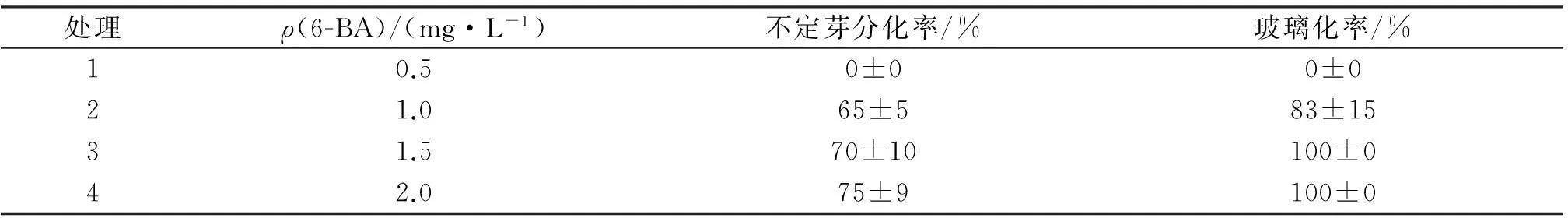
表2 6-BA不同配比培养基中愈伤组织再分化情况

A.叶片诱导愈伤;B.多次继代愈伤;C.再生芽点;D.丛生芽;E.丛生芽;F.不定根诱导A.The callus induced by leaf; B.Multiple transgenerational callus; C.regeneration buds; D.bud clumps; E.bud clumps; F. induction of adventitious root图1 多花筋骨草再生过程不同时期的生长状态Fig.1 Growth state of Ajuga multiflora Bunge in different regeneration periods
2.36-BA与NAA组合直接诱导不定芽
根据Stamp[11]等和von Adventivknospen[12]等研究结果,设计了NAA与6-BA激素不同配比的诱导不定芽试验.结果表明,较低浓度NAA配合低浓度的6-BA有利于多花筋骨草外植体直接诱导不定芽发生.除MS+0.5 mg/L 6-BA+0.05 mg/L NAA组合培养的叶片仅表现出卷曲膨大但无芽点无愈伤外,其他各组合均在培养12 d后仅切口处膨大或微有愈伤组织,之后开始显现芽点,20 d后已有多数芽点,分化出小苗.表明6-BA质量浓度在1 mg/L 以上时均可诱导出不定芽.而且以1 mg/L诱导效果最好,其他质量浓度均有不同程度的玻璃化现象发生,6-BA为1.5 mg/L时玻璃化率为20%,6-BA为2.0 mg/L时玻璃化率为42%.对叶片外植体在不同质量浓度6-BA与NAA激素组合中不定芽的分化情况对比,分化率结果见表3.

表3 6-BA 和 NAA 不同配比培养基中不定芽诱导情况
2.46-BA对多花筋骨草叶芽增殖诱导的影响
诱导出的优质小苗转接到增殖培养基中进行继代,观察叶芽增殖情况,见表4.由表4可知,不添加6-BA时,叶芽平均增殖数只有3.33个,随6-BA质量浓度升高叶芽增殖个数先迅速增加后平稳升高,1.0 mg/L的 6-BA诱导的叶芽平均增殖数达到10个左右且无玻璃化现象,平均植株高度为1.1 cm,6-BA为1.5 mg/L时叶芽平均诱导数仍近10个,但出现17%的玻璃化率并且植株高度下降为0.73 cm,6-BA为2.0 mg/L时玻璃化率达到47%,植株平均高度为0.66 cm.因此,6-BA为1 mg/L时对多花筋骨草叶芽增殖诱导效果最佳.
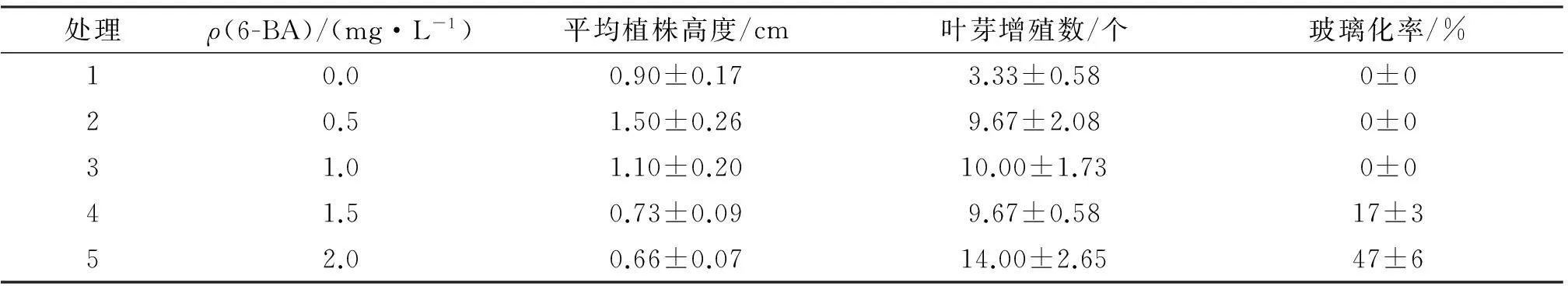
表4 6-BA不同配比培养基中叶芽增殖的情况
2.5完整植株的诱导
将长度大约为2 cm的无根苗接种在MS+(0.3,0.6,0.9)mg/L IBA 的培养基(pH 6.2~6.4)上培养,2~3周后即可诱导出根,形成完整的植株(图1F).3个浓度的IBA均可诱导出发达的根系(表5),IBA为1 mg/L时根长可达8.0 cm,然而此根系太长不利于移栽操作;0.3和0.6 mg/L的IBA有利于诱导良好的根系发生,即根系发达,有一定程度木质化且长度适宜.为节约材料,选择0.3 mg/L IBA进行根系诱导.

表5 不同培养基中诱导不定芽的生根情况
2.6植株移栽成活率
选择具有完整根系的多花筋骨草植株,除去其培养瓶的包扎物,在自然光照条件下炼苗5~6 d,然后洗净根系上残留的琼脂,移栽于V(蛭石)∶V(腐殖土)为1∶1的栽培基质中培养,并用遮阴网遮阴,保证所需湿度,2~3 d浇一次营养液.移栽成活率可达90%以上.由此可见具有发达且一定木质化的根系,是获得高成活率试管苗移栽的关键.
3讨论
本试验以多花筋骨草嫩叶为外植体,MS+0.2 mg/L 6-BA+0.2 mg/LKT+0.4 mg/L 2,4-D 诱导愈伤组织较好,所得愈伤组织质地松脆,呈黄绿色,大多数为颗粒状.MS+1 mg/L 6-BA可诱导茎芽,但用愈伤诱导的叶芽常伴有玻璃化现象,而MS+1 mg/L 6-BA+0.05 mg/L NAA有利于叶片直接分化不定芽,并且诱导时间较短,玻璃化现象相对较轻,长势良好,更适于叶芽增殖.MS+0.3 mg/L IBA适于生根培养,所得根系发达,有一定程度木质化,移栽宜成活.有研究表明:植物生长调节物质对植物离体培养中的细胞脱分化、再分化及形态建成起着重要的调节作用.一般来说,2,4-D诱导的愈伤不能分化出芽,需转入含有细胞分裂素的分化培养基中培养2-3代才能出芽[13-14].研究报道6-BA促进愈伤组织不定芽的发生,长势和成芽数量随其浓度升高而降低,这与本试验结果一致[15].因此,可将愈伤组织用高浓度6-BA诱导后再转入低浓度增殖,从而获得较好的分化率.高浓度的6-BA会导致严重的玻璃化现象,这与高红兵[16]等研究一致.高浓度6-BA影响诱导的组培苗内源激素失衡,从而导致了玻璃化现象的发生.
本研究初步建立了多花筋骨草离体快速繁殖体系,在短时间内可以获得大量无菌苗,缩短生长周期、节省土地、降低成本、并且不受地理气候条件限制.目前,有关多花筋骨草快速繁殖及组织培养方面的研究尚未见报道.本体系的建立为多花筋骨草次生代谢产物的大规模生产及基因转化研究奠定了基础.
参考文献:
[1]刘开全,邓洪平,马学萍. 国产唇形科筋骨草属(Ajuga)研究概况[J]. 曲靖师范学院学报, 2010,29(6):32-35.
[2]江苏新医学院.中药大辞典 [M].上海:上海人民出版社, 1977.
[3]MIDORI T, HARUKUNI T, HOYOKU N,etal. Cancer chemopreventive a-gents (antitumor-promoters) from Ajuga decumbens[J]. J Nat Prod, 1999,62(7):972.
[4]杨秀伟. 麻花头属和漏芦属药用植物中蜕皮甾酮类成分及其生物活性研究[J]. 中国现代中药, 2013,15(11):922-935.
[5]CATALAN R E, MARTINES A M, ARAGONES M D. In vitro effect of ecdysterone on protein kinase activity[J]. Comp Biochem Physiol, Part B, 1982,71(2):301-303.
[6]TAKEI M, ENDO K, NISHIMOTO N,etal. Effect of ecdysterone on histamine release from rat peritoneal mast cells [J]. J Pharm Sci, 1991,80(4):309-310.
[7]黎昕,钱晶晶,李晓灿,等. 匍枝筋骨草悬浮培养生产蜕皮甾酮的研究[J]. 中国农学通报, 2013,29(34):127-133.
[8]赵晓杰. IBA、NAA、光质对匍枝筋骨草生长及β-蜕皮甾酮含量的影响[D].哈尔滨:东北林业大学, 2011.
[9]王征. 杜仲组织培养及愈伤组织植株再生体系的建立[D].长沙:中南林业科技大学, 2013.
[10]黄晓红. 药用植物广豆根组培快繁体系的建立[D].南宁:广西大学,2012.
[11]STAMP J A, COLBY S M, MEREDITH C P. Improved shoot organogenesis from leaves of grape[J]. J Am Soc Hortic Sci, 1990,115(6):1038-1042.
[12]VON ADVENTIVKNOSPEN D B. Adventitious bud formation in leaf explants of some grapevine rootstock and scion cultivars[J]. Vitis, 1990,29:151-158.
[13]李文静,李学强,贾毛毛,等. 6-BA、NAA和2,4-D不同配比对荠菜愈伤组织诱导、生长及植株再生的影响[J]. 植物生理学报, 2012,48(2):141-146.
[14]王晓春,师尚礼,梁慧敏,等. 2,4-D和6-BA组合配比对金达苜蓿愈伤组织诱导与分化的影响[J]. 草地学报, 2010,18(2):219-222.
[15]赵晓杰,迟德富,李晓灿. 匍枝筋骨草再生体系构建[J]. 中国农学通报, 2011,27(4):120-124.
[16]高红兵,唐晓杰,孟庆繁.高浓度 6-BA 诱导酸樱桃苗的玻璃化苗内源激素含量变化[J].林业科学研究, 2006,19(4):488-490.
(编辑WJ)
中图分类号Q813.1+2
文献标识码A
文章编号1000-2537(2016)01-0030-05
*通讯作者,E-mail:chidefu@126.com
基金项目:国家自然科学基金资助项目(31370649)
收稿日期:2015-04-04
DOI:10.7612/j.issn.1000-2537.2016.01.006
