甲硝唑脑病个案汇总分析
2015-12-29苟双梅付学涛
苟双梅,付学涛
(1.雅安市中医医院药剂科,四川 雅安 625000;2.芦山县人民医院药剂科,四川 芦山 625600)
甲硝唑脑病个案汇总分析
苟双梅1,付学涛2
(1.雅安市中医医院药剂科,四川 雅安 625000;2.芦山县人民医院药剂科,四川 芦山 625600)
目的:调查甲硝唑脑病(MIE)的临床特征、发生原因及治疗措施,为临床合理用药提供参考。方法:采用回顾性的调查方法,检索CNKI、VIP及PubMed数据库,收集2005 – 2015年5月国内外报道的甲硝唑引起脑病的文献,对患者年龄、用药情况、给药剂量、临床症状、影像学表现、不良反应发生时间和特点及转归等进行分析。结果:共有25例患者因使用甲硝唑引起脑病。其中,男性14例和女性11例,年龄范围21 ~ 78岁;25例MIE患者的临床表现主要包括小脑功能障碍(22例次,64.70%)和精神状态改变(8例次,23.52%)。甲硝唑引起脑病的平均时间是68 d,平均日剂量为1480 mg。停用甲硝唑后,大部分患者好转或症状完全消失。治愈时间中位数为6周。几乎所有患者接受磁共振成像(MRI)脑部扫描。结论:甲硝唑脑病可能并不是一个剂量或时间相关的现象,对于肝损害的患者存在高风险,在临床使用过程中应注意其脑病的发生。
甲硝唑;脑病;神经系统毒性;系统回顾
甲硝唑是治疗阿米巴病、滴虫、幽门螺杆菌、非感染性结肠炎、肝性脑病、厌氧菌感染的首选药物,临床常用于治疗艰难梭菌感染,最常见的药品不良反应有恶心、味觉障碍、厌食、腹部绞痛[1]。甲硝唑使用过程中可能会产生一些神经系统的副作用,如小脑综合征、癫痫、自主神经病变、视神经病变以及周围神经病变,这种罕见事件的确切发病率尚不确定[2-3]。甲硝唑引起的脑病(metronidazole-induced encephalopathy,MIE)鲜有报道,被确定为长期使用甲硝唑引起的不良影响,从头痛、动作不协调、共济失调到痉挛发作,是一种罕见的临床条件下长期使用甲硝唑所致。典型的表现为渐进性的临床恶化,如:构音障碍,步态不稳,四肢的感觉变化,混乱,恶心,呕吐,在小脑齿状核、胼胝体、中脑和大脑白质出现多个病变信号。停止用药后,症状往往是可以逆转的,虽然确切的发病率和甲硝唑脑病机理目前尚不明确。为了更好地了解甲硝唑在使用过程中诱发脑病的情况,本文着重对2005 – 2015年5月甲硝唑引起脑病的病例个案报道进行分析和探讨,旨为临床安全合理应用该药提供参考。
1 资料与方法
以“甲硝唑”、“脑病”、“神经毒性”、“脑炎”、“中枢系统损害”为关键词检索CNKI及VIP数据库,检索时限均为2005 – 2015年5月;以“metronidazole”、“encephalopathy”或“neurotoxicity”、“encephalitis”或“neurotoxicity syndromes”为关键词检索PubMed数据库(2008 – 2015年5月)。详细记录使用甲硝唑并出现脑病及神经毒性或神经系统损害的个案病例报道。排除综述及无法追溯病例具体情况的其他研究性论文或个案病例;重复发表文献等。对每篇个案报道的患者特征(年龄、性别),用药暴露史(剂量和持续时间),具体的毒性症状和影像学表现,用药累积剂量及预后等情况进行详细汇总分析。
2 结果
2.1 一般情况
共收集相关个案报道23篇,涉及病例25例,其中,男性14例(56%),女性11例(44%),年龄21 ~ 78岁,年龄中位数为58岁。具体见表1。
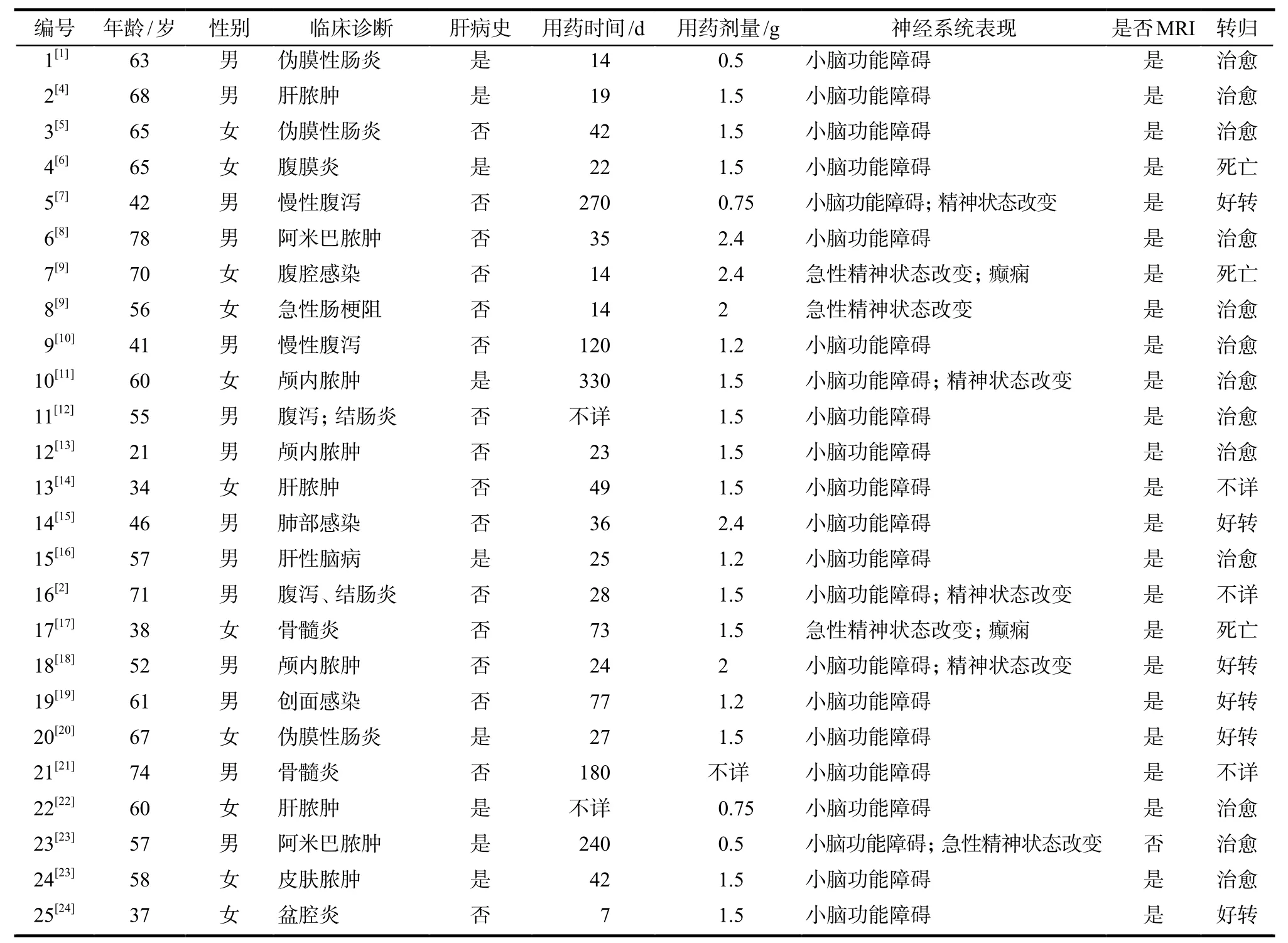
表1 甲硝唑脑病的临床表现Tab 1 Clinical characteristics of patients with metronidazole-induced encephalopathy
2.2 原患疾病
在选用甲硝唑进行治疗的适应证中,32%为脓肿(8例,肝脓肿、颅内脓肿、阿米巴脓肿),24%为炎症性肠病(6例),8%为艰难梭菌感染(2例),8%为腹膜炎(2例),8%为骨髓炎(2例),8%为皮肤软组织感染(2例),其余占12%(3例,盆腔炎、肝性脑病、肺部感染)。
2.3 MIE患者的临床表现
MIE的临床特点通常包括心理状态的改变,小脑功能障碍和癫痫发作[3]。25例MIE患者中,大多数的临床症状表现为共济失调、构音障碍。其他症状包括精神状态的改变,周围神经病变,无力,眩晕,恶心,呕吐,感觉损失,视觉障碍,或癫痫发作。25例MIE患者的临床表现包括小脑功能障碍(22例次,64.70%);精神状态改变(8例次,23.52%,其中2例次癫痫发作),其他症状(4例次,11.76%)包括眩晕、恶心、呕吐、视觉障碍等。22例患者出现小脑功能障碍,具体症状主要为:构音障碍(20例次,35.08%),共济失调(18例次,31.57%),运动障碍(7例次,12.28%),辨距不良(5例次,8.77%),眼球震颤(4例次,7.02%),宽基步态(3例次,5.26%)。小脑功能障碍的患者中,63.63%(14例)是男性,平均年龄为58.7岁,甲硝唑治疗的中位时间为35.5 d(14 ~ 270 d)。精神状态改变的患者中,50%为男性(4例),平均年龄为56.5岁,甲硝唑治疗的中位时间为50.5 d(14 ~ 330 d)。具体见表1。
2.4 MIE患者的影像学表现
MIE患者通常显示在脑MRI特征对称性病变,这种病变一般局限于小脑齿状核周围的区域,然而也可能在胼胝体、中脑、脑桥、脑白质、基底神经节等,显示多个对称性病变,在T2加权和弥散加权图像均显示高信号。齿状核双侧受累常用来区分MIE和其原因引起的脑病的MRI特征表现[25-26]。几乎所有的患者进行脑成像检查,24例患者行MRI检查,1例行CT检查,5例患者同时行CT和MRI检查。大部分(64.70%)病例为小脑功能病变,20例次(32.78%)为小脑齿状核受累,14例次(22.95%)为胼胝体参与病变,6例次(9.84%)为脑白质参与病变,其余(34.43%)为中脑、脑桥、延髓、基底核等受累,详见表2。8例精神状态改变的患者,均有小脑齿状核病变,其中3例患者[9,17]的精神状态改变是他们唯一的症状表现,病变均在小脑齿状核及中脑受累。24例患者均行颅脑MRI,影像结果均显示异常分辨率,其中14例(58.33%)患者提供了治疗后恢复的时间。14例患者颅脑MRI恢复最短时间为7 d,最长为4个月。停药后,大部分患者的症状可在1 ~ 3 d得到改善,2例患者症状改善历时7 d,2例患者症状改善历时2周。患者症状改善的时间与颅脑MRI的恢复时间不相符,MRI表现出了一定的延后性。

表2 甲硝唑脑病影像学病变部位分布Tab 2 Lesion distribution of MIE on imaging
2.5 用药情况
25例个案报道中,2例患者为口服给药,其余均为静脉注射给药。25例患者中,1例患者用药剂量未记载,使用甲硝唑治疗后出现MIE的平均时间为68 d(7 ~ 330 d),其中4例(16.67%)患者服用药物≤14 d,1例(4.17%)患者≤7 d。平均日剂量为1480 mg(500 ~2000 mg),累积剂量为68 g(10.5 ~ 202 g)。由此可知,大剂量长时间使用甲硝唑易导致MIE,但同时也有小剂量短时间出现MIE的病例。
甲硝唑分子结构中硝基被厌氧菌还原,产生亚硝基团和咪唑基团物质,氧化DNA,使DNA链断裂,导致细胞死亡。甲硝唑30% ~ 60%在肝脏代谢,通过脑脊液,并穿过血脑屏障。药物的半衰期为6 ~ 8 h,但在肝性脑病的患者中,由于肝功能的下降,其清除率减少了三分之一,因此药物的半衰期增加约3倍,这些患者更易出现痉挛、脑病、眩晕等中枢不良反应[17]。本研究结果显示,25例患者中,1例用药剂量未记载,有9例是合并长期的肝病病史,其中2例为肝癌,肝硬化失代偿期,小剂量、短时间[1]内即出现MIE,其余7例均为慢性肝病。有肝病病史患者,使用甲硝唑出现脑病的累积剂量及时间的中位数分别为37 g(7 ~ 156 g)、26 d(19 ~ 330 d)。其余16例肝功能正常患者使用甲硝唑出现脑病的累积剂量及时间的中位数分别为56 g(10.5 ~ 202 g)、35.5 d(7 ~ 270 d)。由此可知,对于有肝病病史的患者,其用药累积剂量、用药时间均明显小于没有肝病的患者。
2.6 治疗和转归
25例患者中,13例(59.09%)治愈,6例(27.27%)好转,3例(13.63%)患者出现死亡(1例其他并发症引起死亡,其余2例因出现深度昏迷继而导致呼吸衰竭死亡)。大多数患者停用甲硝唑后临床症状可在5 d内改善,偶尔有几例患者合并四肢远端周围神经病变的症状,给予静脉滴注强的松、维生素B1、维生素B12、维生素C等药物,症状改善稍微延后1周左右[10,12,15]。
3 讨论
甲硝唑是治疗阿米巴病、滴虫、厌氧菌感染的首选药物,其常见的不良反应为胃肠道反应(12% ~ 64%),而神经系统毒性的发生率大概在12% ~ 24%[27]。MIE是一种罕见的不明发病和停药后预后良好的药品不良反应。本文统计分析结果与Kuriyama等[3]对MIE系统综述对比,数据大致相似:患者平均年龄为50 ~60岁,性别60岁以上为男性,使用甲硝唑的平均时间为50 ~ 60 d。65% ~ 77%临床症状为小脑功能障碍。
3.1 MIE发生特点
甲硝唑引起的中枢神经系统毒性是严重且罕见的事件。MIE可发生于男性和女性成人任何年龄段,主要表现为小脑功能障碍、精神状态改变或癫痫发作。MIE与长期、高累积剂量使用甲硝唑治疗有关。然而,也有小剂量的甲硝唑短时间内引起MIE的文献报道。对于老年患者、严重肝功能不全甚至肝硬化等有可能降低药物代谢的患者,MIE的风险大大增加,当使用甲硝唑治疗时,需要调整给药剂量,减少累积剂量和给药时间,尤其对于终末期肝病的患者,应谨慎监测患者用药过程中神经症状的变化。小脑齿状核、胼胝体为最常见的颅脑MRI受累异常表现。停药后大部分患者症状可在短时间内改善,但临床症状的改善和颅脑MRI恢复没有相关性,仍需要密切复查。虽然预后一般是好的,但也有死亡病例。
3.2 MIE发生机制
MIE的发病机制目前尚不清楚,多数MIE引起的病灶完全为可逆的。目前有文献报道认为引起MIE的机制主要为:(1)甲硝唑代谢产物可以结合RNA而非DNA,RNA可能抑制蛋白质的合成,这可能会促进变性[28];(2)甲硝唑的中间代谢产物通过小脑和前庭系统抑制神经递质γ-氨基丁酸(GABA)受体的调节[29];(3)由于硝基咪唑类衍生物产生有毒的自由基通过与儿茶酚胺类神经递质的氧化反应,生成金属离子和自由基损伤大脑中含有的神经细胞,从而增加水的含量,引起轴突退化[12,25];(4)甲硝唑对于神经系统的影响可能是因为甲硝唑被人体肠道菌群酶转化成硫胺素拮抗剂,抑制硫胺素磷酸化,从而抑制维生素B1的效果,推测其有可能为甲硝唑的毒性代谢[30]。
4 建议
MIE与用药累积剂量有关,与给药方式无关,绝大多数病例均可在正常用法用量下发生。由于MIE的发生时间较晚,甚至是数周或数月才出现,不容易发现和判断。因此提示临床医生在用药过程中应格外注意,特别是对于门诊患者在使用该药时,提示患者尤其是老年人或合并有肝病患者,如用药期间出现共济失调、构音障碍、无力、眩晕、恶心、呕吐、感觉损失、视觉障碍或癫痫等症状时,应及时就医进行必要检查,同时给予适当糖皮质激素及营养神经药物进行治疗,并行神经系统检查及早期的MRI诊断,以便早期发现MIE,及时处理救治,以提高治愈率降低死亡率。
[1] Knorr JP, Javed I, Sahni N, et al. Metronidazole-induced encephalopathy in a patient with end-stage liver disease[J]. Case Reports Hepatol, 2012, 2012: 209258.
[2] Kim H, Kim YW, Kim SR, et al. Metronidazole-induced encephalopathy in a patient with infectious colitis: a case report[J]. J Med Case Rep, 2011, 5: 63.
[3] Kuriyama A, Jackson JL, Doi A, et al. Metronidazole-induced central nervous system toxicity: a systematic review[J]. Clin Neuropharmacol, 2011, 34(6): 241-247.
[4] Yamamoto T, Abe K, Anjiki H, et al. Metronidazole-induced neurotoxicity developed in liver cirrhosis[J]. J Clin Med Res, 2012, 4(4): 295-298.
[5] Godfrey MS, Finn A, Zainah H, et al. Metronidazole-induced encephalopathy after prolonged metronidazole course for treatment of C. difficile colitis[J]. BMJ Case Rep, 2015, 16(5): 1-4.
[6] Hobbs K, KStern-Nezer S, Buckwalter MS, et al. Metronidazoleinduced encephalopathy: not always a reversible situation[J]. Neurocrit Care, 2015, 22(3): 429-436.
[7] Chakrabarti S, Pan K. Metronidazole-induced encephalopathy: an uncommon scenario[J]. N Z Med J, 2014, 127(1393): 120-122.
[8] Iqbal A, Tripathi K, Rai M, et al. Clinical and imaging perspective and unanswered questions in a case of metronidazole induced encephalopathy[J]. Ann Indian Acad Neurol, 2013, 16(4): 569-571.
[9] Huang YT, Chen LA, Cheng SJ. Metronidazole-induced encephalopathy: case report and review literature[J]. Acta Neurol Taiwan, 2012, 21(2): 74-78.
[10] Naqi R, Azeemuddin M, Beg MA. Magnetic resonance imaging of metronidazole induced encephalopathy[J]. J Pak Med Assoc, 2012, 6(8): 843-844.
[11] Jang HJ, Sim SY, Lee JY, et al. Atypical metronidazole-induced encephalopathy in anaerobic brain abscess[J]. J Korean Neurosurg Soc, 2012, 52(3): 273-276.
[12] Bottenberg MM, Hegge KA, Eastman DK, et al. Metronidazoleinduced encephalopathy: a case report and review of the literature[J]. J Clin Pharmacol, 2011, 51(1): 112-116.
[13] Sevy A, Moyse E, Million M, et al. Central and peripheral neurotoxicity of metronidazole after treatment for brain abscess[J]. Acta Neurochir, 2011, 153(12): 2491-2492.
[14] Retamal-Riquelme E, Soto-San Martín H, Vallejos-Castro J, et al. Reversible neurotoxicity secondary to metronidazole: report of one case[J]. Rev Med Chil, 2014, 142(3): 386-390.
[15] Kim SM, Shin HW, Han HJ, et al. Serially changing metronidazole-induced encephalopathy[J]. Can J Neurol Sci, 2011, 38(6): 921-924.
[16] Cheong HC, Jeong TG, Cho YB, et al. Metronidazole-induced encephalopathy in a patient with liver cirrhosis[J]. Korean J Hepatol, 2011, 17(2): 157-160.
[17] Groothoff MV, Hofmeijer J, Sikma MA, et al. Irreversible encephalopathy after treatment with high-dose intravenous metronidazole[J]. Clin Ther, 2010, 32(1): 60-64.
[18] Bahn Y, Kim E, Park C, et al. Metronidazole induced encephalopathy in a patient with brain abscess[J]. J Korean Neurosurg Soc, 2010, 48(3): 301-304.
[19] Graves TD, Condon M, Loucaidou M, et al. Reversible metronidazole-induced cerebellar toxicity in a multiple transplant recipient[J]. J Neurol Sci, 2009, 285(1-2): 238-240.
[20] Higashi M, Irioka T, Matsumoto T, et al. Metronidazole-induced encephalopathy[J]. Intern Med, 2013, 52(7): 843-844.
[21] Desai JA, Dobson J, Melanson M, et al. Metronidazole-induced encephalopathy: case report and review of MRI findings[J]. Can J Neurol Sci, 2011, 38(3): 512-513.
[22] Galvez M, Brahm J, Miranda M. Movement disorders as a manifestation of metronidazole-induced encephalopathy in a patient with chronic liver disease[J]. Mov Disord, 2009, 24(12): 1864-1866.
[23] Kim KH, Choi JW, Lee JY, et al. Two cases of metronidazoleinduced encephalopathy[J]. Korean J Gastroenterol, 2005, 45(3): 195-200.
[24] 武建宏,孙宗琴.甲硝唑致脑白质及周围神经损害1例[J].人民军医,2012,55(4):323.
[25] Ahmed A, Loes DJ, Bressler EL. Reversible magnetic resonance imaging findings in metronidazole-induced encephalopathy[J]. Neurology, 1995, 45(3 Pt 1): 588-589.
[26] Kim DW, Park JM, Yoon BW, et al. Metronidazole-induced encephalopathy[J]. J Neurol Sci, 2004, 224(1-2): 107-111.
[27] George WL, Kirby BD, Sutter VL, et al. Intravenous metronidazole for treatment of infections involving anaerobic bacteria[J]. Antimicrob Agents Chemother, 1982, 21(3): 441-449.
[28] Kim E, Na DG, Kim EY, et al. MR imaging of metronidazoleinduced encephalopathy: lesion distribution and diffusionweighted imaging findings[J]. AJNR Am J Neuroradiol, 2007, 28(9): 1652-1658.
[29] Evans J, Levesque D, Knowles K, et al. Diazepam as a treatment for metronidazole toxicosis in dogs: a retrospective study of 21 cases[J]. J Vet Intern Med, 2003, 17(3): 304-310.
[30] Alston TA, Abeles RH. Enzymatic conversion of the antibiotic metronidazole to an analog of thiamine[J]. Arch Biochem Biophys, 1987, 257(2): 357-362.
Metronidazole-induced encephalopathy: a review of medical literature
GOU Shuang-mei1, FU Xue-tao2
(1. Department of Pharmacy, Ya'an Hospital of Traditional Chinese Medicine, Ya'an 625000, China; 2. Department of Pharmacy, Lushan People's Hospital, Lushan 625600, China)
Objective:To investigate the clinical characteristics, occurrence reasons and therapeutic measures of metronidazole-induced encephalopathy (MIE), and provide references for clinical rational drug use.Methods:With retrospective method, CNKI, VIP and PubMed databases were retrieved. The case reports of metronidazole-induced encephalopathy were collected from medical literature in domestic and abroad between 2005 and May 2015. The data were analyzed in respect of the distribution of patients' age, the dosage and administration of metronidazole, clinical characteristics of adverse drug reactions, imaging manifestations, onset time, consequence and prognosis.Results:A total of 25 patients developed MIE. They comprised 14 men and 11 women with the age ranging from 21 to 78 years. Among 25 patients, clinical characteristics of MIE included cerebellar dysfunction (22 cases, 64.70%), altered mental status (8 cases, 23.52%). The average onset time of MIE was 68 days, the average daily dose was 1480 mg. Most patients either improved or had complete recovery after metronidazole withdrawal. However, three patients died. The median time of recovery was 6 weeks. Nearly all patients underwent magnetic resonance imaging (MRI) examination.Conclusion:Metronidazole-induced encephalopathy does not seem to be a dose- or time-related phenomenon. While, the patients with liver damage were the high risk population of MIE. It should be paid more attention to MIE in clinical applications.
Metronidazole; Encephalopathy; Nervous system toxicity; Systematic review
R969.3
A
1672 – 8157(2015)06 – 0368 – 05
2015-06-16
2015-09-07)
苟双梅,女,主管药师,主要从事医院药学工作。
E-mail:1953288189@qq.com
