递增注射脂多糖诱导慢性免疫应激对仔猪生长性能的影响
2015-12-21贾安峰冯京海张敏红李泽阳徐胜胜
贾安峰 冯京海* 张敏红 李泽阳,2 常 玉 徐胜胜 何 川
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.安徽农业大学动物科技学院,合肥 230036;3.安徽农业大学生命科学学院,合肥 230036)
集约化养殖条件下畜禽容易发生免疫应激,严重影响畜禽的健康和生长性能。虽然脂多糖(LPS)不是实际生产中导致动物免疫应激的唯一或主要因素,但LPS可模拟动物免疫应激,且重复性好[1],因而被广泛用于免疫应激机理[1-4]及营养干预研究[5-8]。目前常采用注射大肠杆菌LPS诱导畜禽免疫应激,研究免疫应激时的营养调控技术[5-8]。单次注射LPS可引起动物血浆中炎症细胞因子浓度急剧升高,但4~8 h即恢复至注射前水平[9],因此仅能模拟急性短期免疫应激。一些研究人员采用多次重复注射LPS的方式模拟慢性免疫应激,但畜禽对LPS极易产生耐受性[10-11]。为降低LPS的耐受性,延长免疫激活的时间,Rakhshandeh等[1]采用隔天重复注射 LPS,每次注射剂量递增12%的方法,发现LPS提高注射期内生长猪的体温、血浆白细胞数量和急性期蛋白含量,表明重复注射递增剂量的LPS可以诱导慢性免疫应激,是一种研究生长猪慢性免疫激活时营养物质代谢和营养干预的适宜模型[1]。随后研究人员采用该模型研究了慢性免疫应激与热应激的互作[4]、慢性免疫应激过程中唾液应激指标的变化[3]以及营养调控[8]。Paulo 等[4]在研究中发现,第1次注射LPS后血浆炎性细胞因子水平显著升高,但随后注射LPS不再引起炎性细胞因子水平的升高,表明即使注射剂量递增12%,仍不足以缓解生长猪对LPS的耐受性。另外,研究发现免疫应激降低仔猪平均日采食量(ADFI)、平均日增重(ADG)[5-6,12-13]和增 重 耗 料 比 (G/F)[4,6-7,14],但对饲料消化率的研究较少。本试验旨在研究递增30%注射LPS诱导仔猪慢性免疫应激的效果及对仔猪饲粮营养物质表观消化率的影响。
1 材料与方法
1.1 试验动物与试验设计
选用 18 头(28±2)日龄断奶仔猪[(8.22±0.89)kg],单笼适应 5 d 后,参考 Carroll等[15]的方法,实施非手术法颈静脉插管(MMCVCB 1-20-13,北京天地和协公司)。插管护理5 d,剔除拉稀瘦弱仔猪2头。采用完全随机试验设计,将剩余16头随机分为2个组(对照组、LPS组),每组8个重复。试验期15 d,LPS组分别在试验第1、3、5、7、9、11、13 和 15 天给仔猪静脉注射 LPS(L2880,Sigma),初始按80μg/kg BW 注射,以后注射剂量每次递增30%,对照组注射相应剂量的生理盐水。整个试验期仔猪自由饮水,每天08:00、12:00、16:00和20:00饲喂仔猪基础饲粮,其组成及营养水平见表1。
1.2 样品采集与测定方法
1.2.1 生长性能
分别在试验第1、5、9和15天静脉注射前称取仔猪体重和饲粮重,并据此计算ADG、ADFI和G/F。
1.2.2 营养物质表观消化率测定
以个体为单位,记录试验第5~10天采食量,并收集试验第5~10天全部粪便,当天粪样混合均匀后称重,取1/2于65℃烘干,室温回潮后称重,-20℃保存。参照《饲料分析及饲料质量检测技术》[16]测定饲粮样品和粪样中干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)和总能(GE)。饲粮中各营养物质表观消化率计算公式如下:
某养分表观消化率(%)=[(饲粮某养分总量-粪中某养分总量)/饲粮某养分总量]×100。
1.2.3 血浆指标测定
分别在试验前1 天(-1 d)和试验第1、5、9、13天LPS注射3 h后从颈静脉插管中抽取10 mL血液,置于肝素钠抗凝管中,静置 30 min,3 000 r/min离心15 min,分离血浆,-20℃保存,用于测定皮质醇、结合珠蛋白、白细胞介素-1β(IL-1β)含量。
结合珠蛋白和IL-1β的酶联免疫吸附测定(ELISA)试剂盒购自南京建成生物工程研究所;皮质醇ELISA试剂盒购自美国R&D公司。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.3 数据处理与分析
同一组内不同时间点的差异采用SAS 9.2统计软件中一般混合线性模型(GLM)进行单因素重复测量方差分析和Duncan氏法多重比较;同一时间点不同组间的差异采用t检验进行显著性分析。P<0.05为差异显著性标准。结果用“平均值±标准差”表示。
2 结果与分析
2.1 递增注射LPS对仔猪血浆中IL-1β、结合珠蛋白和皮质醇含量的影响
由表2可知,t检验结果表明,试验前(-1 d)LPS组仔猪血浆中各指标与对照组之间无显著差异(P>0.10);试验第 1、5 天 LPS 组血浆中 IL-1β、结合珠蛋白和皮质醇含量均极显著高于对照组(P<0.01);试验第9天LPS组血浆中结合珠蛋白含量极显著高于对照组(P=0.01),皮质醇含量有高于对照组的趋势(P=0.10);试验第13天LPS组血浆中除结合珠蛋白含量显著高于对照组(P<0.05)外,IL-1β和皮质醇含量均与对照组无显著差异(P>0.10)。上述结果表明,隔天注射LPS至第9天时,LPS仍具有明显的免疫激活作用,但随着注射次数的增加,仔猪对LPS的耐受性逐渐增强,即使增大注射剂量,LPS免疫激活作用仍逐渐降低。
经重复测量方差分析得出,注射前后对照组仔猪血浆中IL-1β、结合珠蛋白和皮质醇含量无显著差异(P>0.10),而LPS组各项指标均有极显著变化(P<0.01),其中与注射前(-1 d)相比,试验第1、5天仔猪血浆中IL-1β、结合珠蛋白和皮质醇含量均显著升高(P<0.05),试验第 9、13天除结合珠蛋白含量仍较高(P<0.05)外,血浆IL-1β和皮质醇含量恢复至注射前水平。重复测量方差分析的结果与t检验的结果基本一致。

表2 递增注射LPS对仔猪血浆中IL-1β、结合珠蛋白和皮质醇含量的影响Table 2 Effects of increasing administration of lipopolysaccharide on the contents of IL-1β,haptoglobin and cortisol in plasma of piglets
2.2 递增注射LPS对仔猪生长性能的影响
由表3可见,与对照组相比,注射LPS导致仔猪3个阶段ADG分别降低了40.00%(P<0.01)、29.52%(P<0.05)和 19.30%(P<0.05);ADFI分别降低了 25.09%(P=0.01)、23.15%(P<0.05)和19.47%(P<0.05);G/F 无显著差异(P>0.10)。上述结果表明,在整个试验期内注射LPS对仔猪ADG和ADFI均有显著影响,但随着注射次数的增加,LPS对仔猪的影响逐渐减小,表明仔猪对LPS的耐受性逐渐增强。
经重复测量方差分析得出,随日龄增加,对照组仔猪 ADFI和 ADG极显著增加(P<0.01),而G/F无显著变化(P>0.10);随着日龄和LPS注射次数的增加,LPS组仔猪的ADG和ADFI同样极显著增加(P<0.01);另外LPS组仔猪后期(9~15 d)G/F显著高于前期(1 ~8 d,P<0.05),表明随注射次数的增加,仔猪对LPS的耐受性逐渐增强。

表3 递增注射LPS对仔猪生长性能的影响Table 3 Effects of increasing administration of lipopolysaccharide on growth performance of piglets(n=8)
2.3 递增注射LPS对仔猪营养物质表观消化率的影响
由表4可见,注射LPS导致仔猪DM表观消化率下降了5.43%(P<0.05),有降低 GE表观消化率的趋势(P=0.06),EE和CP的表观消化率虽略有降低,但未达到显著水平(P>0.10)。
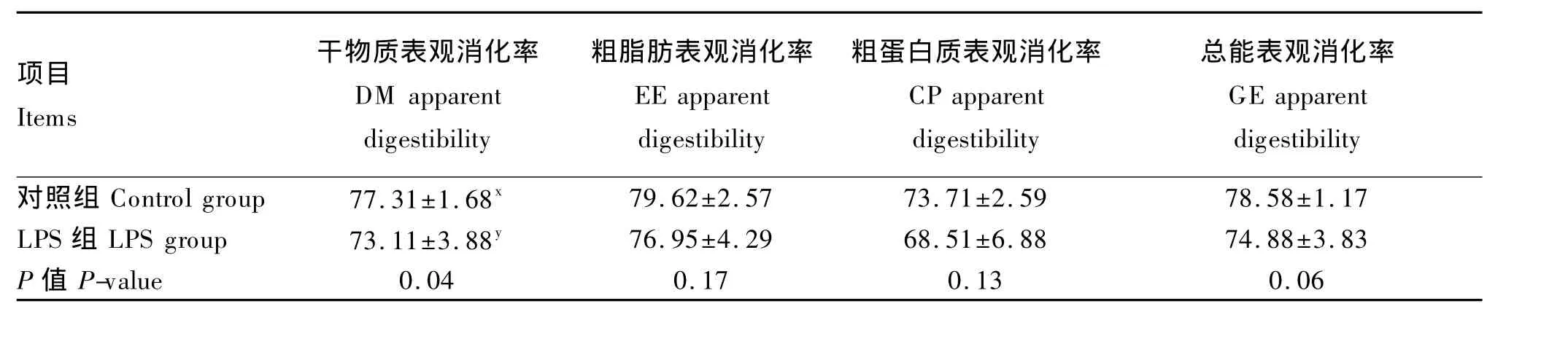
表4 递增注射LPS对仔猪营养物质表观消化率的影响Table 4 Effects of increasing administration of lipopolysaccharide on nutrient apparent digestibility of piglets(n=8)%
3 讨论
3.1 递增注射LPS对仔猪血浆中IL-1β、结合珠蛋白和皮质醇含量的影响
虽然LPS不是畜禽生产中诱发免疫应激的唯一因素,但作为一种非病原性免疫激活剂,注射后可引起畜禽血浆炎性细胞因子水平升高,影响下丘脑-垂体-肾上腺、甲状腺和生长轴[4,8],诱导畜禽出现精神抑郁、食欲不振、嗜睡、发热等典型的免疫应激现象[4],并且LPS诱导畜禽免疫应激的重复性好,具有较好的生物安全性[1],因而被广泛用于免疫应激[1-4]及营养干预的相关研究[5-8]。但是LPS免疫应激模型存在一定的局限性,首先LPS只能诱导短期急性免疫应激,单次注射LPS可引起动物血浆中炎症细胞因子浓度急剧升高,但4~8 h即恢复至注射前水平[9],而多次重复注射容易使畜禽产生 LPS耐受性[10-11]。Rakhshandeh等[1]采用隔天重复注射LPS,每次注射剂量递增12%的方法降低LPS的耐受性,成功诱导生长猪慢性免疫应激。然而Paulo等[4]应用该模型发现,第1次注射LPS后猪血浆炎性细胞因子水平显著升高,但随后注射LPS不再引起炎性细胞因子水平的升高,表明即使注射剂量递增12%,仍不足以缓解生长猪对LPS的耐受性。本试验LPS初始注射剂量为80μg/kg BW,随后逐次递增30%,发现随着注射次数的增加,LPS免疫激活的作用仍逐渐降低,但是至试验第5天血浆IL-1β依然维持显著高含量,而且在整个试验期内结合珠蛋白始终维持高含量,表明本试验采用的递增注射LPS的方法可诱导仔猪产生慢性免疫应激,且效果优于 Rakhshandeh 等[1]的模型。
3.2 递增注射LPS对仔猪生长性能的影响
畜禽发生免疫应激时采食量和生长速度显著下降[4-6,14],本试验同样发现,仔猪应激期间 ADFI和ADG显著降低。免疫应激可能通过以下机制抑制畜禽的采食和生长速度:1)促进炎症细胞因子过量分泌[7,9],炎性细胞因子作用于中枢和外周神经系统,抑制畜禽的采食行为及代谢[17],直接注射IL-1可显著降低肉鸡的ADG和ADFI证明了这一机制[18];2)抑制生长激素和 IGF的分泌,进而降低畜禽的 ADG 和 ADFI[7,12,19];3)抑制甲状腺素的分泌[4],降低食糜在胃肠道中流通速度,抑制采食;4)促进糖皮质激素分泌[6,20],通过 mTOR通道调控肉鸡采食行为[21],本试验也发现血浆中皮质醇含量显著升高。
免疫应激除抑制畜禽采食和生长外,还降低畜禽的饲料转化效率[4-5,7,14]。本研究发现,虽然LPS组的G/F与对照组无显著差异(这可能由于样本量少,组内变异过大,掩盖了组间差异),但重复测量方差分析发现,LPS组仔猪后期G/F显著高于前期,间接表明注射LPS降低了饲料转化效率。饲料转化效率下降表明饲料消化率和饲料利用率降低。本试验发现,递增注射LPS降低了饲料DM的表观消化率,有降低GE表观消化率的趋势。有关免疫应激影响仔猪饲料消化率的研究很少,但是有研究发现,免疫应激时仔猪肠道中脂肪酶、胰蛋白酶活性显著降低[22],小肠指数和大肠指数显著降低[23],肠道的绒毛高度显著降低,隐窝深度显著增加[24],导致小肠线粒体损伤[25],提高小肠HSP70的表达[2]。这些结果表明,免疫应激对畜禽的影响是全身性的,可能通过降低采食量影响饲料的消化率和利用率,抑制畜禽的生长。
4 结论
①递增30%注射LPS提高仔猪5 d内血浆IL-1β和皮质醇含量,并使整个注射期内血浆结合珠蛋白含量显著升高,ADG和ADFI显著降低。表明递增30%注射LPS诱导仔猪出现慢性免疫应激,抑制了仔猪生长。
②递增30%注射LPS可降低仔猪饲料DM表观消化率,有降低GE表观消化率的趋势。
[1] RAKHSHANDEH A,DE LANGE C F M.Evaluation of chronic immune system stimulation models in growing pigs[J].Animal,2012,6(2):305-310.
[2] HOU Y Q,YAO K,WANG L,et al.Effects ofα-ketoglutarate on energy status in the intestinal mucosa of weaned piglets chronically challenged with lipopolysaccharide[J].British Journal of Nutrition,2011,106(3):357-363.
[3] ESCRIBANO D,CAMPOS P H R F,GUTIÉRREZ A M,et al.Effect of repeated administration of lipopolysaccharide on inflammatory and stress markers in saliva of growing pigs[J].The Veterinary Journal,2014,200(3):393-397.
[4] CAMPOS P H R F,MERLOT E,DAMON M,et al.High ambient temperature alleviates the inflammatory response and growth depression in pigs challenged with Escherichia coli lipopolysaccharide[J].The Veterinary Journal,2014,200(3):404-409.
[5] KELEY E B,SPEARS J W,AUMAN S K.Dietary phosphorus and an inflammatory challenge affect performance and immune function of weanling pigs[J].Journal of Animal Science,2001,79(2):413-419.
[6] LIU Y L ,LI D F,GONG L M,et al.Effects of fish oil supplementation on the performance and the immunological,adrenal,and somatotropic responses of weaned pigs after an Escherichia coli lipopolysaccharide challenge[J].Journal of Animal Science,2003,81(11):2758-2765.
[7] MAO X F,PIAO X S,LAI C H,et al.Effects ofβglucan obtained from the Chinese herb Astragalus membranaceus and lipopolysaccharide challenge on performance,immunological,adrenal,and somatotropic responses of weanling pigs[J].Journal of Animal Science,2005,83(10):2775-2782.
[8] KIM J C,MULLAN B P,FREY B,et al.Whole body protein deposition and plasma amino acid profiles in growing and/or finishing pigs fed increasing levels of sulfur amino acids with and without Escherichia coli lipopolysaccharide challenge[J].Journal of Animal Science,2012,90(Suppl.4):362-365.
[9] WEBEL D M,FINCK B N,BAKER D H,et al.Time course of increased plasma cytokines,cortisol,and urea nitrogen in pigs following intraperitoneal injection of lipopolysaccharide[J].Journal of Animal Science,1997,75(6):1514-1520.
[10] ASH SA,GRIFFIN G E.Effect of parenteral nutrition on protein turnover in endotoxaemic rats[J].Clinical Science,1989,76(6):659-666.
[11] DEITCH E A.Animal models of sepsis and shock:a review and lessons learned [J].Shock,1998,9(1):1-11.
[12] WRIGHT K J,BALAJI R,HILL C M,et al.Integrated adrenal,somatotropic,and immune responses of growing pigs to treatment with lipopolysaccharide[J].Journal of Animal Science,2000,78(7):1892-1899.
[13] GAINES A M,CARROLL J A,YI G F,et al.Effect of menhaden fish oil supplementation and lipopolysaccharide exposure on nursery pigsⅡ.Effects on the immune axis when fed simple or complex diets containing no spray-dried plasma[J].Domestic Animal Endocrinology,2003,24(4):353-365.
[14] DRITZ S S,OWEN K Q,GOODBAND R D,et al.Influence of lipopolysaccharide-induced immune challenge and diet complexity on growth performance and acute-phase protein production in segregated earlyweaned pigs[J].Journal of Animal Science,1996,74(7):1620-1628.
[15] CARROLL J A,DANIEL J A,KEISLER D H,et al.Non-surgical catheterization of the jugular vein in young pigs[J].Laboratory Animals,1999,33(2):129-134.
[16] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业出版社,2010.
[17] BESEDOVASKY H O,DEL R A.Immune-neuro-endocrine interactions:facts and hypotheses[J].Endocrine Reviews,1996,17(1):64-102.
[18] KLASING K C,LAURIN D E,PENG R K,et al.Immunologically mediated growth depression in chicks:influence of feed intake,corticosterone and interleukin-1[J].Journal of Nutrition,1987,117(9):1629-1637.
[19] LI J,LI D F,XING J J,et al.Effects of β-glucan extracted from Saccharomyces cerevisiae on growth performance,and immunological and somatotropic responses of pigs challenged with Escherichia coli lipopolysaccharide[J].Journal of Animal Science,2006,84(9):2374-2381.
[20] EICHER S D,MCKEE C A,CARROLL J A,et al.Supplemental vitamin C and yeast cell wallβ-glucan as growth enhancers in newborn pigs and as immunomodulators after an endotoxin challenge after weaning[J].Journal of Animal Science,2006,84(9):2352-2360.
[21] 张玉俊.糖皮质激素影响肉仔鸡采食量的机制研究[D].泰安:山东农业大学,2011.
[22] 冯焱.免疫应激对肉鸡消化系统、免疫功能及肠道微生物区系的影响[D].杨凌:西北农林科技大学,2012.
[23] 陈静,刘显军,张飞,等.谷氨酰胺对免疫应激仔猪肠道指数的影响研究[J].中国饲料,2010(4):34-40.
[24] BURKHOLDER K M,THOMPSON K L,EINSTEIN M E,et al.Influence of stressors on normal intestinal microbiota,intestinal morphology,and susceptibility to Salmonella enteritidis colonization in broilers[J].Poultry Science,2008,87(9):1734-1741.
[25] Lobo S M,BACKER D D,SUN Q H,et al.Gut mucosal damage during endotoxic shock is due to mechanisms other than gut ischemia[J].Journal of Applied Physiology,2003,95(5):2047-2054.
