Cbl-b基因shRNA干扰载体的构建及鉴定
2015-11-29胡彬倪娜娜吕雅琳陈浩刘毅孙建方
胡彬 倪娜娜 吕雅琳 陈浩 刘毅 孙建方
Cbl-b基因shRNA干扰载体的构建及鉴定
胡彬 倪娜娜 吕雅琳 陈浩 刘毅 孙建方
目的 构建小鼠Cbl-b基因RNA干扰(RNAi)的真核表达质粒,并初步鉴定其干扰效果,为后续研究Cbl-b在黑素瘤免疫治疗中的作用奠定基础。方法 根据基因库提供的Cbl-b cDNA序列,设计并合成4对短发夹结构的互补DNA序列,克隆至载体PGPU6/GFP/Neo构建重组质粒,并予以DNA测序鉴定。重组干扰质粒构建成功后,将干扰质粒与Cbl-b过表达载体共转染293T细胞,于转染后48 h,通过实时荧光定量PCR法及蛋白质印迹法检测各质粒对Cbl-b基因的表达抑制效应。结果 测序分析证实,4对shRNA寡核苷酸序列分别成功插入至shRNA真核表达载体PGPU6/GFP/Neo中,将构建成功的PGPU6/GFP/Neo-shRNA质粒与Cbl-b真核表达载体共转染细胞48 h后,通过荧光实时定量PCR法及Western印迹测定,发现4条shRNA序列对Cbl-b的表达均有一定的抑制效应,其中以1号shRNA序列重组质粒对Cbl-b表达的抑制程度最高(P<0.05)。结论 成功构建并筛选出沉默效应最高的Cbl-b shRNA真核细胞表达载体。
泛素蛋白连接酶类;RNA,小分子干扰;黑色素瘤;基因,Cbl-b
Cbl-b属于泛素连接酶E3家族中的成员,近年的研究发现,其直接参与了T细胞的活化及免疫耐受过程,是体内介导T细胞免疫无能的内源性调节因子之一[1-2]。我们应用RNA干扰技术,参照Cbl-b CDS区序列,设计了4条siRNA候选序列,并据此设计了其相应的发夹状shRNA序列,构建shRNA真核表达载体,然后通过细胞转染实验,筛选出对Cbl-b沉默效率最高的shRNA表达载体。
一、试剂与材料
1.试剂:载体pGPU6/GFP/Neo(上海吉玛制药技术有限公司);pdsRed1-N1-cb1b过表达质粒由本室构建;DH5α感受态细胞(北京全式金生物公司);293T细胞(中国科学院上海生化与细胞所);DMEM培养基、Opti-MEM培养基、胎牛血清(美国 Gibco公司);脂质体 LipofbctamineTM2000、Trizol Reagent(美国Invitrogen公司);SYBR实时荧光定量试剂盒(日本TaKaRa公司);Cbl-b的单克隆抗体(sc-8006)(美国Santa Cruz公司);HRP标记的IgG二抗(北京中杉金桥生物技术有限公司);PVDF膜(美国Millipore公司);PCR引物由北京六合华大基因科技股份有限公司合成;其余为国产分析纯。
2.实验仪器与设备:CO2细胞培养箱(美国Thermo Scientific公司);ABI7300实时荧光定量 PCR仪(美国Applied Biosystems公司);低温离心机、医用超低温冷冻箱、酶标仪(美国Thermo Scientific公司);凝胶成像及分析装置,聚丙烯酰胺凝胶电泳仪,聚丙烯酰胺凝胶垂直电泳槽,微型转膜仪(美国Bio-Rad公司);超纯水仪(美国Millipore公司)。
二、方法
1.Cbl-b基因shRNA表达模板序列设计及合成:针对Cbl-b的CDS区设计并合成了针对不同靶位点的siRNA序列,并根据siRNA序列设计合成相应的shRNA序列。在shRNA中的循环结构选择TTCAAGAGA,避免终止信号的形成,转录终止信号选用T6结构。shRNA正向链的5′添加CACC序列,与Bbs I酶切后形成的粘末端互补;反向链的5′添加了GATC,与BamH I酶切后形成的粘末端互补。如果siRNA的第1个碱基不是G,则在CACC序列后补加1个G。另设计随机序列作为阴性对照,并经BLAST比较没有发现同源序列,命名为NC。
2.shRNA载体的构建及鉴定:分别取2μl上述合成的DNA正义和反义链表达模板,加入16μl退火缓冲液,94℃水浴5min,自然冷却至室温,使互补的正、反向链模板结合形成双链。将退火后形成双链的寡核苷酸链与经BamH I和Bbs I双酶切后的载体pGPU6/GFP/Neo用T4 DNA连接酶连接过夜。以连接产物转化E.coliDH5α感受态细菌,在氨苄西林抗性平板上筛选阳性克隆,并对挑选的克隆经质粒小提后行酶切电泳并送北京六合华大基因科技股份有限公司进行测序鉴定。
3.细胞培养和转染:293T细胞常规培养于含10%胎牛血清、100 U/ml青霉素、100 mg/L链霉素的DMEM培养基中,37℃、5%CO2饱和湿度培养箱培养。将状态良好、处于对数生长期的细胞用0.25%胰酶消化,用完全培养基悬浮成单细胞悬液,细胞计数后,1.5×106细胞/孔接种6孔板;混匀后于37℃、5%CO2培养 24 h。将 0.8μg干扰表达载体质粒pGPU6/GFP/Neo-shRNA1,pGPU6/GFP/Neo-shRNA2,pGPU6/GFP/Neo-shRNA3,pGPU6/GFP/Neo-shRNA4及阴性对照载体质粒pGPU6/GFP/Neo-NC分别与0.8μg Cbl-b过表达载体pdsRed1-N1-Cbl-b混匀后转染细胞,转染程序按lipofectamin2000操作说明进行。转染48 h后,在荧光倒置显微镜下观察转染效率并收集细胞。实验同时设立过表达组、过表达阴性对照组(过表达载体及阴性对照载体共转染)、空载对照组、阴性对照组(只转染阴性对照质粒组)。
4.实时荧光定量PCR法检测mRNA水平变化:细胞转染后48 h,收集细胞加入Trizol液提取细胞总RNA,并通过逆转录试剂盒合成cDNA。然后以各组cDNA为模板进行实时荧光定量PCR扩增,根据实时荧光定量PCR扩增曲线得到各实验组目标和内参基因的阈值循环数(Ct值),采用△△Ct的方法进行相对定量。扩增Cbl-b基因所用上游引物为5′-GTGACTGGGGACGGCAATATCCTAC-3′;下游引物 5′-TAAA GATAAAAGCCTTCCCT GCTAC-3′。β肌动蛋白扩增上游引物为5′-CCCTGGCACCCAGCA C-3′。下游:5′-GCCGAT CCACACGGAGTAC-3′。扩增条件:95℃2min;95 ℃ 10 s;62 ℃ 40 s;40个循环后行熔解曲线分析。
5.蛋白质印迹检测Cbl-b蛋白表达:细胞转染48 h后,经胰酶消化,4℃离心5min,收集各组细胞,并用预冷PBS洗3次。根据细胞蛋白提取试剂盒操作步骤提取各组细胞蛋白。上样前蛋白样品与等量2×加样缓冲液混匀,煮沸5min,上样到10%SDS-PAGE中,每孔按20μl上样。电泳分离后转至PVDF膜,使用加样缓冲液封闭转印膜2 h,加入适当稀释的Cbl-b一抗,4℃孵育过夜,次日TBST漂洗3次后加入二抗,室温孵育2 h,洗膜,ECL显色。用Cbl-b与内参灰度比值表示Cbl-b蛋白的相对表达量,使用Gel-Pro Analyzer软件分析处理。
三、结果
1.Cbl-b-shRNA序列的设计及合成:根据小鼠Cbl-b基因的编码序列设计的4对siRNA序列,经BLAST分析小鼠基因库中同源序列,未发现包含该序列的其他基因,说明4个靶点特异性较好。然后结合shRNA载体的结构及shRNA设计原则,由siRNA序列设计并合成了相应shRNA序列(表1)。同时设计相应的阴性对照序列。

表1 针对小鼠Cbl-b基因设计的4对shRNA寡核苷酸序列
2.重组质粒测序结果:由4对shRNA序列构建的重组质粒经测序鉴定构建成功,插入的序列和目标序列完全一致,没有插入、缺失、突变等异常(图1)。
3.荧光实时定量PCR检测结果:pdsRed1-N1-Cbl-b转染293T细胞后,细胞内Cbl-b的表达水平明显升高(Cbl-b过表达载体转染组,Cbl-b载体与阴性对照质粒共转染组),而pdsRed1-N1-Cbl-b与各干扰质粒共转染后,Cbl-b mRNA的水平则明显下降(Cbl-b过表达载体+pGPU6/GFP/NeoshRNA1,Cbl-b 过表达载体 +pGPU6/GFP/Neo-shRNA2,Cblb过表达载体+pGPU6/GFP/Neo-shRNA3,Cbl-b过表达载体 +pGPU6/GFP/Neo-shRNA4),其中以shRNA-1载体对Cbl-b基因mRNA的沉默效率最高(图2),差异有统计学意义(n=3,P<0.05)。
4.蛋白质印迹检测结果:结果显示(图3),pdsRed1-N1-Cbl-b转染后的293T细胞高表达Cbl-b蛋白,而共转染干扰质粒的实验组Cbl-b蛋白的表达水平则明显减低,其中shRNA-1载体对Cbl-b蛋白的沉默为最高,其蛋白表达水平经灰度分析下调了 88%(n=3,P<0.05)。
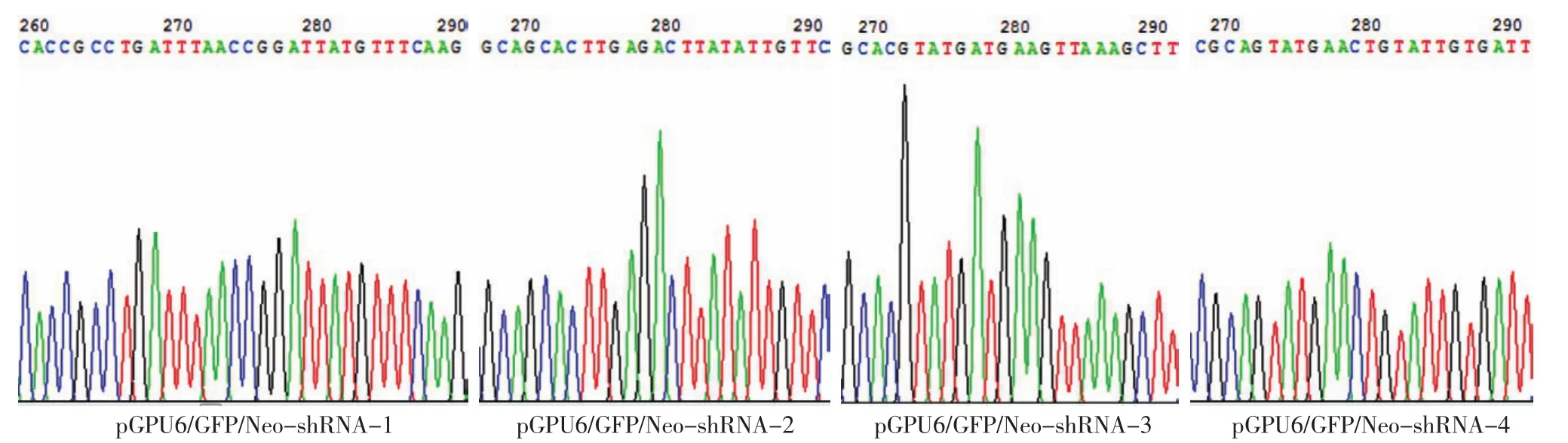
图1 重组质粒的测序结果 插入的序列和目标序列完全一致,没有插入、缺失、突变等异常

图2 各组Cbl-b基因mRNA表达水平的检测 C:Cbl-b过表达载体转染组;C+N:Cbl-b载体与阴性对照质粒共转染组;B:空白细胞组;N:阴性对照质粒转染组;K:Cbl-b载体对应空载组;1:Cbl-b过表达载体+pGPU6/GFP/Neo-shRNA1;2:Cbl-b过表达载体+pGPU6/GFP/Neo-shRNA2;3:Cbl-b过表达载体+pGPU6/GFP/Neo-shRNA3;4:Cbl-b过表达载体 +pGPU6/GFP/Neo-shRNA4

图3 蛋白印迹检测各组Cbl-b基因蛋白水平的表达 1:Cbl-b过表达载体+pGPU6/GFP/Neo-shRNA-1组;2:Cbl-b过表达载体+pGPU6/GFP/Neo-shRNA-2组;3:Cbl-b过表达载体+pGPU6/FP/Neo-shRNA-3组;4:Cbl-b过表达载体+pGPU6/GFP/Neo-shRNA-4组;5:Cbl-b载体对应空载组;6:Cbl-b过表达载体转染组;7:Cblb载体与阴性对照质粒共转染组;8:阴性对照质粒转染组;9:空白细胞组
四、讨论
Cbl-b是泛素连接酶E3家族的重要成员,可使细胞内许多重要信号分子泛素化,使其失去功能或介导其通过泛素-蛋白酶体/溶酶体途径降解。Cbl-b在免疫耐受、变态反应及细胞分化等过程中起重要作用[3-4]。Cbl-b控制着T细胞对弱抗原肽反应活化的阈值[5],其表达的下调可降低T细胞对免疫抑制信号的反应性。当外来抗原刺激时,即使在没有共刺激信号分子的辅助下,Cbl-b缺陷T细胞的增殖以及细胞因子分泌能力也有所增强[6-7]。另外,除了参与控制近端抗原受体信号途径外,Cbl-b可能还介导某些特定的T细胞活化途径,如由Vav1介导的免疫突触的形成[8]。体外抑制试验发现,Cbl-b-/-CD4+T细胞对Treg及TGFβ介导的免疫抑制效应均可产生一定的抵抗力[9]。对Cbl-b分子的深入研究,有助于寻求肿瘤免疫治疗中的新的靶标分子。
RNA干扰技术是一项依赖RNA的转录后基因沉默技术,能通过双链RNA(dsRNA)特异性地抑制与其序列同源的靶基因mRNA的表达[10]。它作为一种简便、高效、特异地抑制靶基因表达的新技术而广泛应用于基因功能分析、抗病毒和肿瘤治疗的研究中。常用体外化学合成小片段siRNA,此法操作简单快速,但其RNA干扰效应仅呈瞬时效应,难以持久。shRNA表达载体系统产生短发夹型RNA来完成RNA干扰,其DNA表达框转录产物可以在细胞内自发形成siRNA[11-12]。针对同一基因的不同靶点而产生不同的干扰效果,提示RNA干扰具有一定的靶点效应,同时也说明利用RNA干扰进行相关研究前,首先需要对干扰序列进行筛选。本实验的目的基因导入采用载体法,针对小鼠Cbl-b基因设计合成4条编码目标shRNA的DNA,并插入适用于RNAi实验的表达质粒pGPU6/GFP/Neo,构建编码目的shRNA的真核表达质粒。这比直接导入siRNA能产生更持久的沉默效应。
从实验结果可以看出,我们所制备的质粒经测序鉴定,插入的序列和目标序列一致,没有插入、缺失、突变等异常,表明成功构建了携带shRNA的真核表达载体,经实时荧光定量PCR和蛋白质印迹检测,设计的shRNA都能在一定程度上沉默靶基因mRNA以及蛋白的表达,其中以shRNA1的沉默效应最强,其功能有待进一步探讨。
[1]Heissmeyer V,Macián F,Im SH,et al.Calcineurin imposes T cell unresponsiveness through targeted proteolysis of signaling proteins[J].Nat Immunol,2004,5(3):255-265.
[2]Jeon MS,Atfield A,Venuprasad K,et al.Essential role of the E3 ubiquitin ligase Cbl-b in T cell anergy induction [J].Immunity,2004,21(2):167-177.
[3]Mueller DL.E3 ubiquitin ligases as T cell anergy factors[J].Nat Immunol,2004,5(9):883-890.
[4]Paolino M,Penninger JM.E3 ubiquitin ligases in T-cell tolerance[J].Eur J Immunol,2009,39(9):2337-2344.
[5]Gronski MA,Boulter JM,Moskophidis D,et al.TCR affinity and negative regulation limit autoimmunity [J].Nat Med,2004,10(11):1234-1239.
[6]Bachmaier K,Krawczyk C,Kozieradzki I,et al.Negative regulation of lymphocyte activation and autoimmunity by the molecular adaptor Cbl-b[J].Nature,2000,403(6766):211-216.
[7]ChiangYJ,KoleHK,BrownK,etal.Cbl-bregulatestheCD28dependence of T-cell activation[J].Nature,2000,403(6766):216-220.
[8]Krawczyk C,Bachmaier K,Sasaki T,et al.Cbl-b is a negative regulator of receptor clustering and raft aggregation in T cells[J].Immunity,2000,13(4):463-473.
[9]Wohlfert EA,Callahan MK,Clark RB.Resistance to CD4+CD25+regulatory T cells and TGF-beta in Cbl-b-/-mice[J].J Immunol,2004,173(2):1059-1065.
[10]Ortiz-Quintero B.RNA interference:from origins to a novel tool for gene silencing[J].Rev Invest Clin,2009,61(5):412-427.
[11]Liu YP,Schopman NC,Berkhout B.Dicer-independent processing ofshorthairpinRNAs[J].NucleicAcidsRes,2013,41(6):3723-3733.
[12]韩永智,孙建方,周武庆,等.短发卡RNA对人黑素瘤细胞BRAF 基因的沉默作用[J].中华皮肤科杂志,2006,39(11):625-628.
2014-05-22)
(本文编辑:吴晓初)
Construction and identification of a short hairpin RNA expression vector targeting the Cbl-b gene
Hu Bin,Ni Nana,Lyu Yalin,Chen Hao,Liu Yi,Sun Jianfang.Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s:Sun Jianfang,Email:Sunjf57@163.com;Liu Yi,Email:dr.liuyi@gmail.com
ObjectiveTo construct a eukaryotic expression plasmid vector encoding Cbl-b gene-specific short hairpin RNAs (shRNAs),and to evaluate its interference effect,so as to lay a foundation for further study on the role of Cbl-b in the immunotherapy of malignant melanoma.MethodsAccording to the sequence of Cbl-b cDNA,4 pairs of shRNAs targeting the Cbl-b gene were designed and synthesized,and then inserted into the plasmid PGPU6/GFP/Neo to construct recombinant plasmids.After identification by DNA sequencing,the 4 shRNA expression vectors were cotransfected into 293T cells with the Cbl-b gene eukarytic expresson plasmid,respectively.The knockdown efficiency of these shRNA expression plasmids on Cbl-b expression was evaluated by real-time(RT)fluorescence-based quantitative PCR and Western blot at 48 hours aftert transfection.ResultsSequencing analysis revealed that all the 4 pairs of shRNAs were successfully inserted into the eukarytic expression vector PGPU6/GFP/Neo.As RT-PCR and Western blot showed,all the 4 shRNA-expressing vectors could downregulate Cbl-b expession,and the NO.1 shRNA-expressing vector displayed the strongest interference effect(P<0.05).ConclusionsA eukaryotic expression plasmid vector was successfully constructed for Cbl-b gene-specific shRNAs,and the most effective shRNA was selected in this study.
Ubiquitin-protein ligases;RNA,small interfering;Melanoma;Genes,Cbl-b
10.3760/cma.j.issn.0412-4030.2015.03.018
国家自然科学基金面上项目(81171513)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
孙建方,Email:sunjf57@163.com;刘毅,Email:dr.liuyi@gmail.com
