miR-498靶向磷酸烯醇丙酮酸羧激酶1对口腔鳞状细胞癌细胞生长的影响
2022-07-18李立恒王蕊王芹张智轶安峰张璇王晓明张凡
李立恒 王蕊 王芹 张智轶 安峰 张璇 王晓明 张凡
河北北方学院附属第一医院1口腔科,2病理科(河北张家口 075000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部最常见的恶性肿瘤之一,且癌细胞的增殖、侵袭和转移是OSCC 患者死亡的主要原因[1-2]。因此,阐明OSCC 的潜在分子机制有助于为OSCC 患者确定新的治疗策略。近年来研究发现[3-4],MicroRNA(miRNA)在包括OSCC 在内的人类癌症中异常表达,且在肿瘤的发生、进展和转移中起着至关重要的作用。有研究显示[5],位于染色体19q13.41 上的miR-498 在三阴性乳腺癌细胞中高表达,下调miR-498 可抑制三阴性乳腺癌细胞的增殖;而磷酸烯醇丙酮酸羧激酶1(phosphoenolpyruvate carboxykinase 1,PCK1)作为糖异生途径中的一个限速酶,在肝癌细胞中低表达,过表达PCK1 可抑制肝癌细胞的增殖[6]。但miR-498 及PCK1 对OSCC 细胞生长的影响尚未见报道,基于此,本研究主要探讨miR-498 对OSCC 细胞增殖、凋亡、迁移及侵袭的作用以及内部的分子机制,以期为OSCC 的临床诊治提供新的分子靶标。
1 材料与方法
1.1 OSCC 组织和细胞系 收集2019年2月至2021年2月期间,在本院采用外科切除术进行手术治疗的OSCC 患者的OSCC 组织及与之匹配的癌旁组织,共150 对。将所有组织标本置于液氮中冷冻保存备用,所有患者均签署知情同意书。人OSCC 细胞系HSC-3、SCC-15、SCC-9 及人正常口腔角质细胞HOK 均购自美国典型菌种保藏中心。
1.2 主要试剂与仪器 miR-498 模拟物(miR-498 mimics)及其阴性对照(miR-NC)、miR-498 抑制物(anti-miR-498)及其阴性对照(anti-miR-NC)、siRNA PCK1(si-PCK1)及其阴性对照(si-NC)、PCK1过表达物(OE-PCK1)及其阴性对照(OE-NC)均购自美国ThermoFisher 公司;LipofectamineTM2000转染试剂盒、胎牛血清(FBS)、DMEM 培养基、BCA试剂盒均购自美国Bio-Rad 公司;PrimeScriptTMRT Master Mix、TransStart®Green qPCR SuperMix 均 购自TaKaRa公司;Trizol试剂、ECL化学发光试剂盒均购自美国Sigma 公司;PCK1、GAPDH 兔多克隆抗体(anti-PCK1、anti-GAPDH)、辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自美国Abcam 公司;荧光定量PCR 仪购自美国ABI 公司;CO2培养箱均购自德国SIGMA 公司。
1.3 细胞培养与转染 人OSCC 细胞系HSC-3、SCC-15、SCC-9 及人正常口腔角质细胞HOK 均在含有10% FBS 的DMEM 培养基中培养,培养条件为37 ℃、5% CO2。收集对数生长期的SCC-15 细胞,严格按照LipofectamineTM2000 转染试剂盒操作说明书操作步骤对SCC-15 细胞进行转染,并分组为:对照组(细胞未转染)、miR-NC 组(miR-NC 转染细胞)、miR-498 mimics 组(miR-498 mimics 转染细胞)、anti-miR-NC 组(anti-miR-NC 转染细胞)、antimiR-498 组(anti-miR-498 转染细胞)、miR-NC+OENC 组(miR-NC 和OE-NC 共转染细胞)、miR-NC+OE-PCK1 组(miR-NC 和OE-PCK1 共转染细胞)、miR-498 mimics+OE-NC 组(miR-498mimics 和OENC 共转染细胞)、miR-498 mimics+OE-PCK1 组(miR-498 mimics 和OE-PCK1 共转染细胞)、antimiR-NC+si-NC 组(anti-miR-NC 和si-NC 组共转染细胞)、anti-miR-NC+si-PCK1 组(anti-miR-NC 和si-PCK1 共转染细胞)、anti-miR-498+si-NC 组(antimiR-498 和si-NC 共转染细胞)、anti-miR-498+si-PCK1 组(anti-miR-498 和si-PCK1 共转染细胞)。
1.4 qRT-PCR 检测OSCC 组织及细胞中miR-498表达水平 Trizol 试剂用于从OSCC 组织及细胞中提取总RNA。使用PrimeScriptTMRT Master Mix 合成cDNA,利用TransStart®Green qPCR SuperMix 在ABI 7500 荧光定量PCR 系统上进行PCR 扩增反应,并使用以下引物:miR-498 正向:5′-GGTTTGAAGCCAGGCGGTTTC-3′,反向:5′-CAGTGCAGGGTCCGAGGTAT-3′;U6 正向:5′-CTCGCTTCGGGCAGCACA-3′,反向:5′-AACGCTTTCACGAATTTGCGT-3′。使用2-ΔΔCt方法以U6 作为内部对照计算miR-498 相对表达水平。
1.5 CCK-8 法检测细胞增殖 将各组SCC-15 细胞以2×104个/孔的密度接种在96 孔板中,并在补充有10% FBS 的DMEM 中孵育过夜。在转染后24、48、72 h,分别向每孔中加10 μL CCK-8 溶液,在37 ℃下孵育2 h 后,利用酶标仪检测450 nm 波长处的吸光度。
1.6 流式细胞术检测细胞凋亡 将各组SCC-15细胞经胰蛋白酶消化后,用PBS 洗涤,并用20 μL 膜联蛋白V 结合缓冲液将细胞重悬,然后将10 μL 膜联蛋白V 异硫氰酸荧光素(Annexin V-FITC)加入细胞重悬液中,37 ℃下孵育15 min,并在黑暗中加入5 μL 碘化丙啶(PI)复染30 min。使用流式细胞仪检测细胞凋亡率。
1.7 Transwell 实验检测细胞侵袭与迁移 对于细胞迁移实验,将细胞以3×104个/mL 的密度接种到Transwell 上腔室中,并将500 μL 含有10% FBS的DMEM 培养液作为化学引诱剂添加到Transwell下腔室。在5%CO2、37 ℃条件下孵育24 h 后,用棉签刮去上腔室中的细胞,并用100%甲醇固定,0.4%结晶紫染色20 min。然后,漂洗细胞并干燥。在倒置显微镜下随机选择6 个视图观察,并统计细胞迁移数目。
对于细胞侵袭实验,将基质胶预先涂在Transwell 上腔室中,待其自然干燥后,将细胞以5×104个/mL 的密度接种到预先涂有基质胶的上腔室中,其余步骤同细胞迁移实验。
1.8 双荧光素酶报告基因实验验证miR-498 与PCK1靶向关系 使用targetscan 网站预测miR-498与PCK1 的结合位点。分别构建PCK1 的野生型(WT)和突变型(MUT)3′-UTR 区质粒,标记为WTPCK1、MUT-PCK1。按照LipofectamineTM2000 转染试剂盒说明书将WT-PCK1 和MUT-PCK1 分别与miR-NC 或miR-498 mimics 共转染于SCC-15 细胞,每组设置6 个复孔,转染48 h 后,使用双重荧光素酶报告基因分析系统评估相对荧光素酶活性。
1.9 Western blot检测PCK1蛋白表达 使用总蛋白提取试剂盒从细胞中提取总蛋白,并通过BCA蛋白测定试剂盒测定蛋白质浓度。使用10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶进行电泳以分离等量的蛋白质,然后将蛋白质转移到聚偏二氟乙烯(PVDF)膜上,将膜用5%脱脂牛奶在37 ℃下封闭2 h,然后与一抗anti-PCK1、anti-GAPDH在4 ℃下孵育过夜。第二天用TBST 将膜洗涤后,加入HRP 标记的羊抗兔二抗于室温下孵育1 h,利用ECL 发光试剂盒可视化蛋白,Image 软件对灰度值进行量化分析。
1.10 统计学方法 所有统计分析采用SPSS 25.0版进行,数据用()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-498 在OSCC 组织及细胞中的表达OSCC 组织中miR-498 的表达水平明显高于癌旁组织[(2.65 ± 0.34)vs.(1.04 ± 0.15),P<0.05];与人正常口腔角质细胞HOK(1.03±0.14)比较,人OSCC细胞系HSC-3(2.05 ± 0.21)、SCC-15(2.75 ± 0.31)、SCC-9(2.31 ± 0.28)中miR-498 的表达水平显著升高(F= 53.639,P<0.001),且SCC-15 细胞中miR-498 的表达水平最高,因此选择SCC-15 细胞作为后续的研究对象。
2.2 miR-498对SCC-15细胞增殖与凋亡的影响与对照组和miR-NC 组比较,miR-498 mimics 组SCC-15、OD450值(24、48、72 h)显著升高,细胞凋亡率显著降低(P<0.05);与对照组和anti-miR-NC 组比较,anti-miR-498 组SCC-15 细胞OD450值(24、48、72 h)显著降低,细胞凋亡率显著升高(P<0.05),见图1。
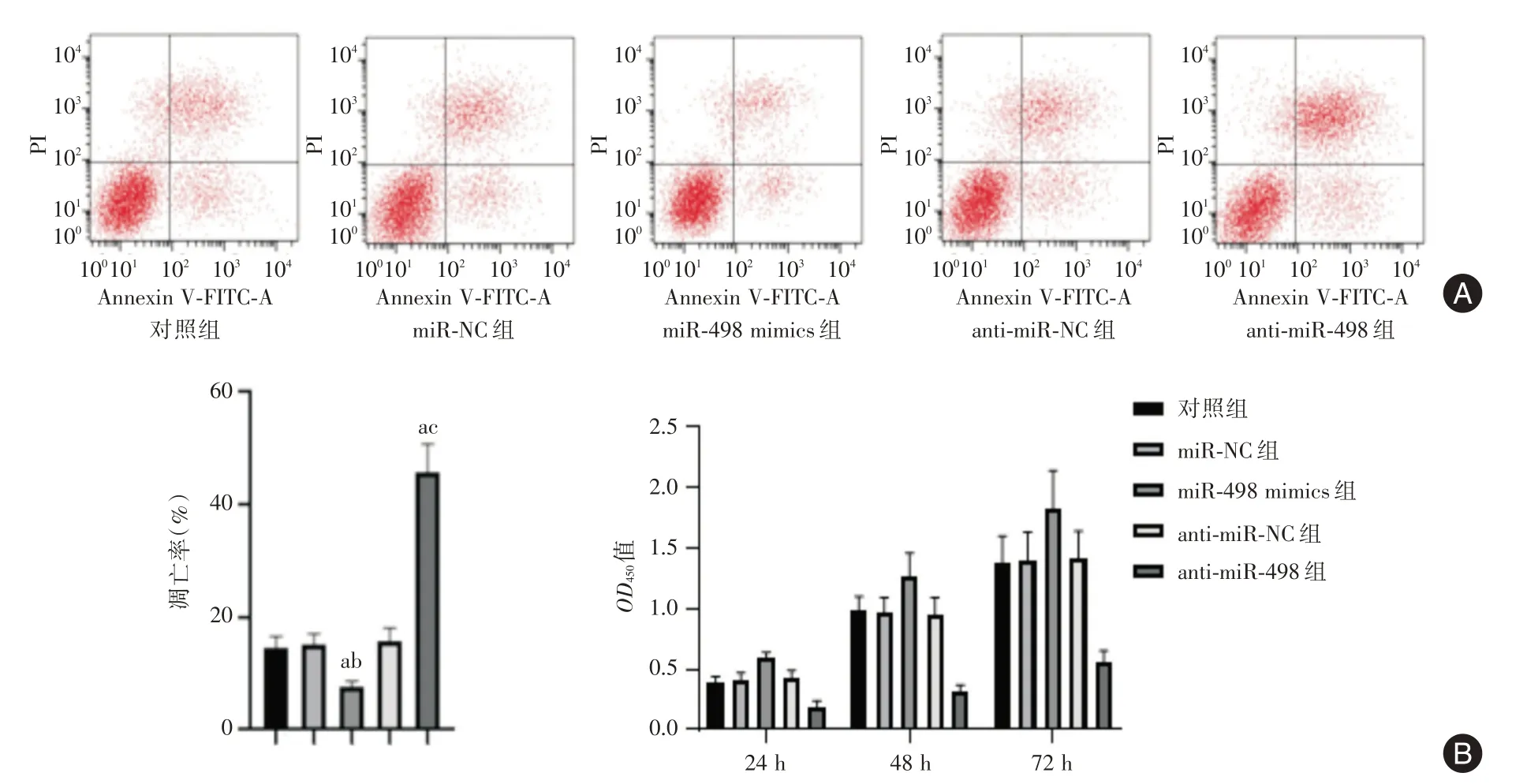
图1 miR-498 对SCC-15 细胞细胞凋亡率及OD450值的影响Fig.1 Effects of miR-498 on apoptosis rate and OD450 value of SCC-15 cells
2.3 miR-498 对SCC-15 细胞迁移与侵袭的影响 miR-498 mimics 组SCC-15 细胞迁移与侵袭数目显著高于对照组和miR-NC 组(P<0.05);antimiR-498 组SCC-15 细胞迁移与侵袭数目显著低于对照组和anti-miR-NC 组(P<0.05),见表1、图2。
表1 miR-498 对SCC-15 细胞迁移数目及侵袭数目的影响Tab.1 Effect of mir-498 on migration number and invasion number of scc-15 cells ±s
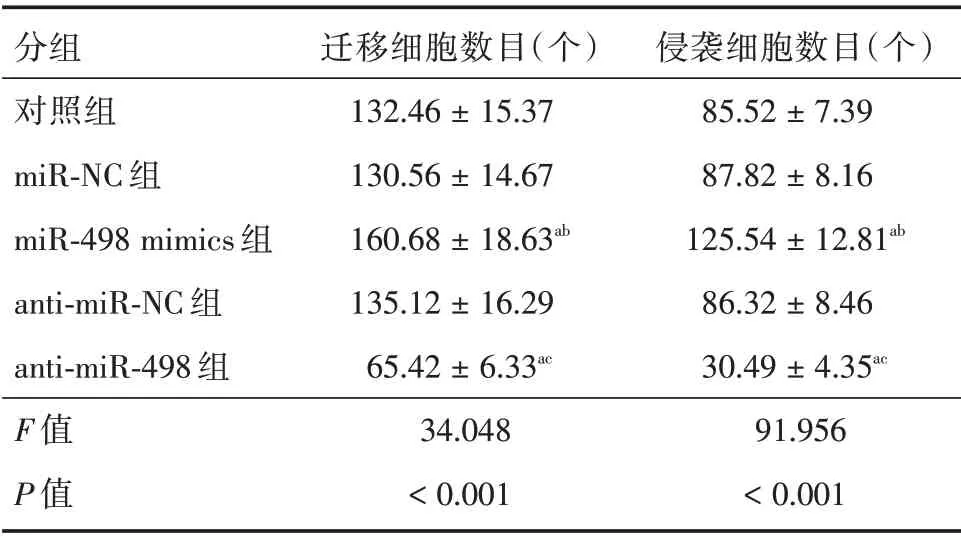
表1 miR-498 对SCC-15 细胞迁移数目及侵袭数目的影响Tab.1 Effect of mir-498 on migration number and invasion number of scc-15 cells ±s
注:与对照组比较,aP <0.05;与miR-NC 组比较,bP <0.05;与anti-miR-NC 组比较,cP <0.05
分组对照组miR-NC 组miR-498 mimics 组anti-miR-NC 组anti-miR-498 组F 值P 值迁移细胞数目(个)132.46±15.37 130.56±14.67 160.68±18.63ab 135.12±16.29 65.42±6.33ac 34.048<0.001侵袭细胞数目(个)85.52±7.39 87.82±8.16 125.54±12.81ab 86.32±8.46 30.49±4.35ac 91.956<0.001
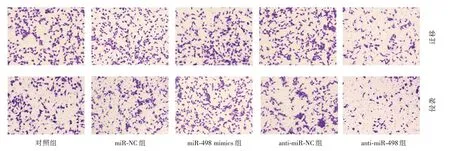
图2 Transwell 实验检测细胞迁移及侵袭Fig.2 Transwell assay for cell migration and invasion
2.4 miR-498 靶向调控PCK1 的表达 使用targetscan 预测miR-498 与PCK1 存在结合位点,见图3。双荧光素酶报告基因实验结果表明,与miR-NC+WT-PCK1 组(1.07 ± 0.13)比较,miR-498 mimics+WT-PCK1 组(0.36±0.08)荧光素酶相对活性显著降低(P<0.05),而miR-498 mimics+MUT-PCK1 组(1.08 ± 0.11)荧光素酶相对活性与miR-NC+MUTPCK1组(1.10±0.14)差异无统计学意义(P>0.05)。Western blot 结果显示,miR-498 mimics 组(0.23 ±0.02)SCC-15 细胞中PCK1 蛋白表达水平显著低于对照组(0.51±0.08)和miR-NC 组(0.49±0.06)(P<0.05);anti-miR-498 组(1.03 ± 0.05)SCC-15 细胞中PCK1 蛋白表达水平显著高于对照组(0.51 ± 0.08)和anti-miR-NC 组(0.48±0.07)(P<0.05),见图4。

图3 使用targetscan 网站预测miR-498 与PCK1 的结合位点Fig.3 Predicted the binding site of mir-498 to PCK1 using targetscan website
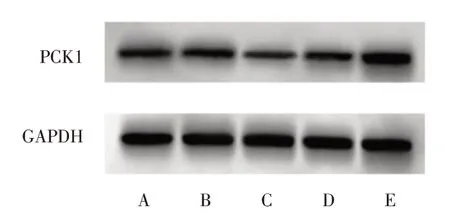
图4 Western blot 检测各组细胞中PCK1 蛋白表达Fig.4 The expression of PCK1 protein in cells of each group was detected by western blot
2.5 共转染miR-498 和PCK1 对SCC-15 细胞增殖、凋亡、迁移及侵袭的影响 PCK1 上调可显著减弱miR-498 mimics 对SCC-15 细胞增殖、迁移和侵袭能力的增强作用,并显著减弱miR-498 mimics对SCC-15 细胞凋亡的抑制作用,见表2、图5-6;PCK1 下调可显著减弱anti-miR-498 对SCC-15 细胞增殖、迁移及侵袭能力的抑制作用,并显著减弱anti-miR-498 对SCC-15 细胞凋亡的促进作用,见表3、图7-8。
表2 miR-498 mimics 和OE-PCK1 共转染对SCC-15 细胞增殖、凋亡、迁移及侵袭的影响Tab.2 Effects of CO transfection of miR-498 mimics and OE-PCK1 onproliferation,apoptosis,migration and invasion of SCC-15 cells ±s
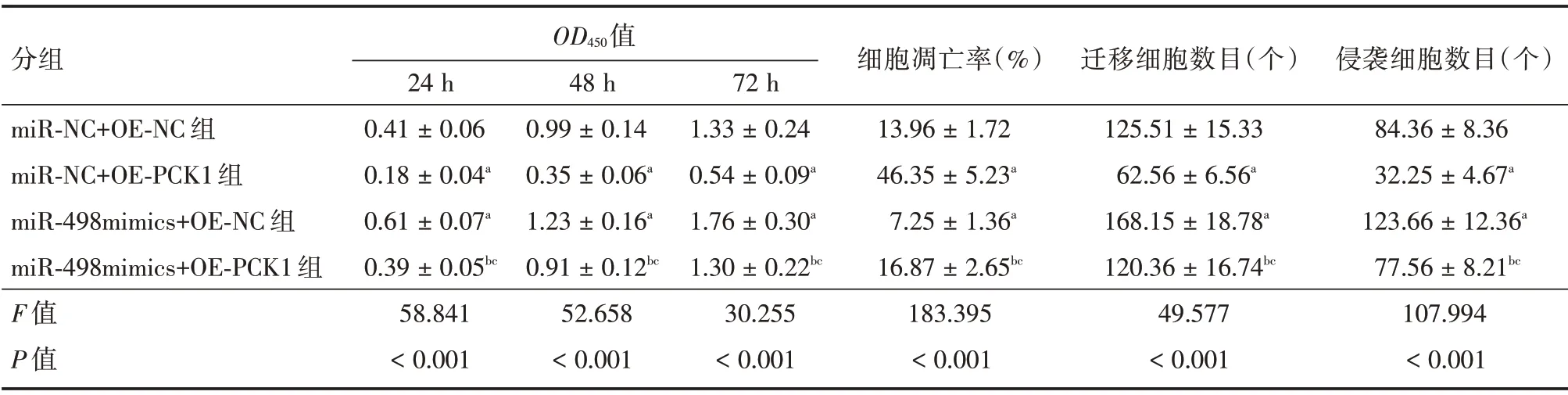
表2 miR-498 mimics 和OE-PCK1 共转染对SCC-15 细胞增殖、凋亡、迁移及侵袭的影响Tab.2 Effects of CO transfection of miR-498 mimics and OE-PCK1 onproliferation,apoptosis,migration and invasion of SCC-15 cells ±s
注:与miR-NC+OE-NC 组比较,aP <0.05;与miR-NC+OE-PCK1 组比较,bP <0.05;与miR-498mimics+OE-NC 组比较,cP <0.05
分组miR-NC+OE-NC 组miR-NC+OE-PCK1 组miR-498mimics+OE-NC 组miR-498mimics+OE-PCK1 组F 值P 值OD450值24 h 0.41±0.06 0.18±0.04a 0.61±0.07a 0.39±0.05bc 58.841<0.001 48 h 0.99±0.14 0.35±0.06a 1.23±0.16a 0.91±0.12bc 52.658<0.001 72 h 1.33±0.24 0.54±0.09a 1.76±0.30a 1.30±0.22bc 30.255<0.001细胞凋亡率(%)13.96±1.72 46.35±5.23a 7.25±1.36a 16.87±2.65bc 183.395<0.001迁移细胞数目(个)125.51±15.33 62.56±6.56a 168.15±18.78a 120.36±16.74bc 49.577<0.001侵袭细胞数目(个)84.36±8.36 32.25±4.67a 123.66±12.36a 77.56±8.21bc 107.994<0.001

表3 anti-miR-498 和si-PCK1 共转染对SCC-15 细胞增殖、凋亡、迁移及侵袭的影响Tab.3 Effects of anti-miR-498 and si-PCK1 co transfection on proliferation,apoptosis,migration and invasion of SCC-15 cells x±s
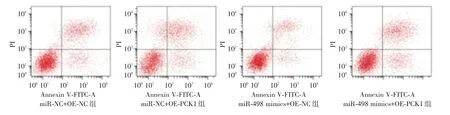
图5 miR-498 mimics 和OE-PCK1 共转染对SCC-15 细胞凋亡的影响Fig.5 Effect of CO transfection of miR-498 mimics and OE-PCK1 on the apoptosis of SCC-15 cells
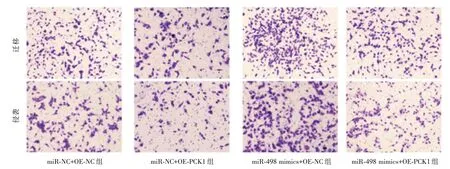
图6 miR-498 mimics 和OE-PCK1 共转染对SCC-15 细胞迁移及侵袭的影响Fig.6 Effect of CO transfection of miR-498 mimics and OE-PCK1 on migration and invasion of SCC-15 cells
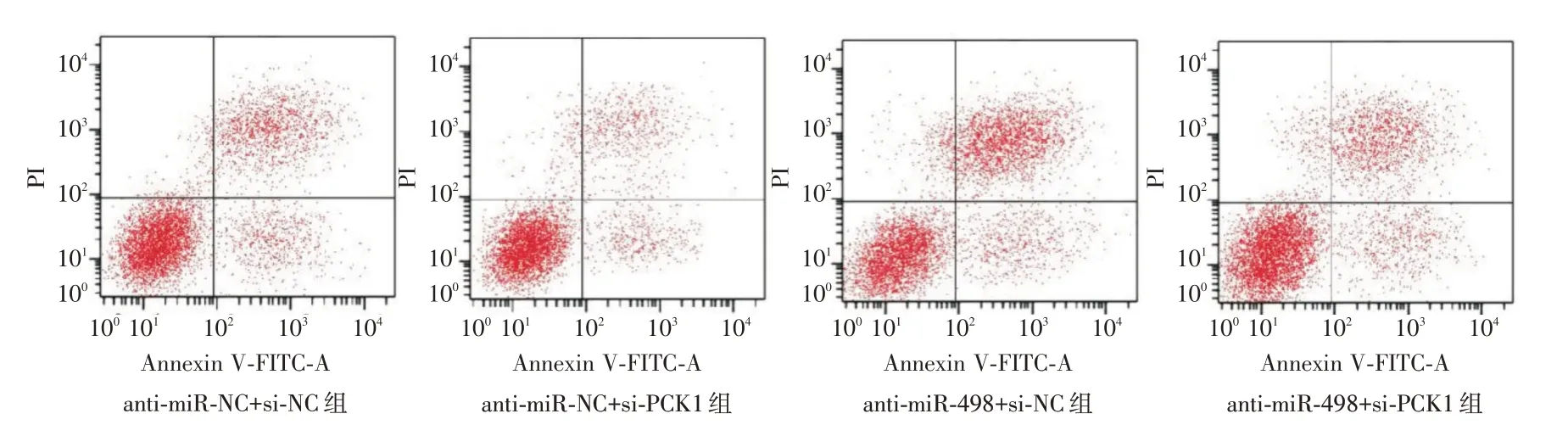
图7 anti-miR-498 和si-PCK1 共转染对SCC-15 细胞凋亡的影响Fig.7 Effects of anti-miR-498 and si-PCK1 co transfection on apoptosis of SCC-15 cells
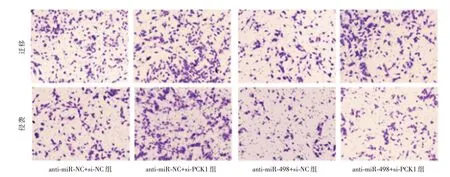
图8 anti-miR-498 和si-PCK1 共转染对SCC-15 细胞迁移及侵袭的影响Fig.8 Effects of anti-miR-498 and si-PCK1 co transfection on migration and invasion of SCC-15 cells
3 讨论
OSCC 的特点是局部侵袭性强、颈部淋巴结转移,其发生发展是一个复杂的过程,受多种因素影响,多种基因参与并协同作用,不同基因发挥不同作用[7]。尽管近年来在OSCC 的诊断和治疗方面已经取得了较大的进步,但OSCC 患者的5年生存率仍然低于50%[8]。因此,确定OSCC 的发病机制对于开发新的治疗策略具有重要的意义。
miRNAs 是一类没有蛋白质编码能力的内源性单链RNAs,且miRNA 可以通过互补作用与其靶mRNA 的3′非翻译区结合,从而在转录后水平的基因表达中发挥调节作用[9-10]。miR-498 是一种在肿瘤细胞的生长、侵袭与转移过程中发挥重要调节作用的miRNA[11]。据报道,miR-498 可促进肾上腺皮质癌细胞的增殖,下调miR-498 表达后,肾上腺皮质细胞增殖明显下降[12];下调miR-498 在OSCC 细胞SCC-15 中的表达可显著降低细胞侵袭和迁移[13];miR-498 在乳腺癌细胞中高表达,其通过抑制PTEN 促进乳腺癌细胞的增殖和迁移[14];miR-498 在转移性甲状腺髓样癌中的表达水平显著高于原发性甲状腺髓样癌[15]。以上研究表明miR-498 在多种肿瘤中发挥着癌基因的作用。本研究结果与其是一致的,本研究结果显示,miR-498 在OSCC 组织和细胞HSC-3、SCC-15、SCC-9 中高表达,且SCC-15 细胞中miR-498 的表达水平最高,因此,选择SCC-15 细胞进行转染实验;本研究还发现,过表达miR-498 可促进SCC-15 细胞的增殖、迁移及侵袭,抑制细胞凋亡,而下调miR-498 可抑制SCC-15 细胞的增殖、迁移及侵袭,促进细胞凋亡,提示miR-498 在SCC-15 细胞中具有促癌的作用。
为了进一步探究miR-498 在SCC-15 细胞中促进细胞增殖、迁移及侵袭,抑制细胞凋亡的内部机制,本研究通过双荧光素酶报告基因证实了PCK1为miR-498 的靶基因,且miR-498 可靶向负调控PCK1 的表达。PCK1 是调节糖异生过程中的限速酶,其能够广泛参与糖代谢、脂代谢、衰老、糖尿病以及肿瘤细胞增殖和凋亡等代谢和生物学进
程[16]。相关研究表明,PCK1 在肾透明细胞癌组织中的表达水平显著低于癌旁组织,PCK1 高表达组患者的总体生存率明显高于低表达组[17];PCK1 过表达后可明显抑制肝癌细胞的迁移能力,而敲除后促进其迁移,说明PCK1 作为抑癌基因参与肝癌的发生和发展[18];沉默PCK1 通过诱导氧化应激和转录因子Nrf2 的激活促进肝癌细胞的增殖[19];过表达PCK1 通过激活糖异生和抑制糖酵解途径来降低肝癌细胞的活力,诱导细胞凋亡,并抑制细胞迁移[20];circC3P1 通过海绵miR-4641 在肝癌细胞中促进PCK1 表达,进而抑制细胞的增殖、迁移与侵袭[21]。上述研究成果揭示了PCK1 在肿瘤中发挥着抑癌基因的作用,本研究结果与上述研究也是一致的,本研究结果显示,过表达或敲低miR-498 可引起PCK1 蛋白表达水平的显著下调或上调;PCK1 上调可显著减弱miR-498 mimics 对SCC-15 细胞增殖、迁移和侵袭能力的增强作用及对细胞凋亡的抑制作用;PCK1 下调可显著减弱antimiR-498 对SCC-15 细胞增殖、迁移及侵袭能力的抑制作用及对细胞凋亡的促进作用。提示miR-498 通过靶向抑制PCK1 的表达促进SCC-15 细胞增殖、迁移及侵袭,并抑制细胞凋亡。然而本研究仅仅在体外细胞水平上进行了探究,miR-498 对PCK1 的调控作用在体内水平上是否还具有类似的趋势,有待进一步探究。
综上所述,miR-498 通过靶向抑制PCK1 的表达促进SCC-15 细胞增殖、迁移及侵袭,并抑制细胞凋亡。但关于miR-498 调控PCK1 涉及的作用机制较为复杂,这将是本研究后续研究的重点。
