新型大豆苷元-8-胺甲基化衍生物的合成研究
2015-04-23尹秋月袁金伟肖咏梅屈凌波
尹秋月,袁金伟,薛 颖,肖咏梅,毛 璞,屈凌波
(河南工业大学 化学化工学院,河南 郑州 450001)
0 引言
大豆苷元(7,4′ -二羟基异黄酮,daidzein)的相对分子质量为254,白色粉末状固体,在水中溶解度极小(5.445 μg/mL),化学结构见图1.大豆苷元主要存在于豆科植物如大豆中,是一种重要的异黄酮化合物,具有抗氧化[1]、保护心血管[2-3]、抗癌[4]、调节雌激素[5]和治疗骨质疏松[6]等广泛的药理活性,在食品、保健品、药品和化妆品等领域得到广泛的应用.但是,大豆苷元由苯环A 和B 通过中间的环C 连接而成的一个共轭体系,空间结构几乎成为一个平面,刚性结构强,即使大豆苷元结构中含有2 个羟基,由于分子间形成氢键等因素的影响,其亲水性和亲脂性都较差,从而导致其生物利用度低,限制了其在临床上的使用[7].因此,通过对大豆苷元的结构进行修饰,改变其物化性质或引入活性基团,提高其生物利用度已成为当前研究的热点.
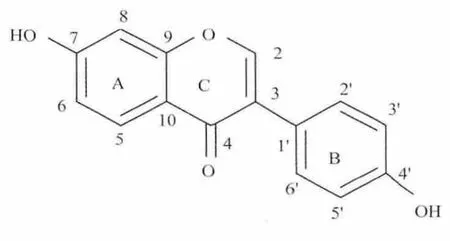
图1 大豆苷元的化学结构Fig.1 Chemical structure of daidzein
近年来,为了改善大豆苷元的溶解性,进一步提高大豆苷元的生物活性,一系列的大豆苷元衍生物已经被合成.如张尊听等[8-9]利用磺化反应合成出系列的大豆苷元的磺酸盐,提高了其在水中的溶解度,抗氧化和缺血活性也有明显的提高.陈晓岚等[10-11]利用磷酰化反应合成出一系列的大豆苷元磷酰化衍生物,并对其与蛋白的弱相互作用及Cease 和AChE 抑制作用进行了研究.屈凌波等[12-13]以大豆苷元、甲醛为原料,在脂肪胺催化下合成出大豆苷元双黄酮衍生物,并对反应条件进行了优化.Strong 等[14]设计并合成系列烷基化等大豆苷元衍生物,对成骨细胞的成长具有较好的作用.但是,对于大豆苷元的胺甲基化衍生物的合成,还未见文献报道.N—烷基官能团插入分子中往往比母体化合物的溶解度有显著的提高,且提高了药物的活性,降低了毒副作用[15].Mannich 胺甲基化反应是形成C—N 键,在化合物中引入N—烷基官能团的一个有效的反应.因此,作者以大豆苷元为原料,分别与甲醛和不同的一级胺或二级胺发生Mannich 反应,设计并合成了6 个大豆苷元胺甲基化衍生物,见图2,其结构通过IR、1H NMR、13C NMR和HR MS 进行了确认,并对反应溶剂、温度、时间和反应物的物质的量比等影响因素进行了考察.
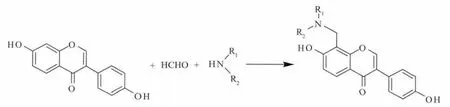
图2 大豆苷元-8-胺甲基化衍生物的合成Fig.2 Synthesis of daidzein-8-aminomethylated derivatives
1 材料与方法
1.1 材料与试剂
大豆苷元(98%):陕西慧科植物开发有限公司;37%甲醛水溶液、异丙胺、正丙胺、正丁胺、二甲胺、二乙胺和二正丙基胺均为分析纯:阿拉丁试剂公司;甲醇、乙醇、异丙醇、N,N-二甲基甲酰胺(DMF)、氯仿等溶剂均为分析纯:国药集团试剂有限公司.
1.2 仪器与设备
Bruker 400 MHz 超导核磁共振仪(DMSO-d6为溶剂,TMS 为内标):瑞士Bruker 公司;Agilent LCMSD-Trap-XCT 高分辨质谱仪(CH3OH 为溶剂):美国Agilent 公司;Shimadazuir-408 型红外光谱仪(KBr 压片):日本岛津公司;XT-4 型显微熔点仪(温度未校正):北京泰克仪器有限公司.
1.3 大豆苷元-8-胺甲基化衍生物的合成
称取1.0 g(3.9 mmol)大豆苷元于50 mL 圆底烧瓶中,加入10 mL N,N-二甲基甲酰胺(DMF)溶解,在室温下搅拌至溶液澄清.然后向溶液中加入0.5 mL 37 %的甲醛水溶液,搅拌均匀后再加入1.2 g(3.9 mmol)正丙胺.65 ℃通过TLC 跟 踪监测,反应进行4~6 h 后停止.减压蒸除溶剂后,反应液静置后析出固体.用无水乙醇重结晶或通过快速柱层析(=8∶1)分离,得到纯品7,4′-二羟基-8-异丙胺甲基-异黄酮.
其他目标化合物的合成同上.
1.4 目标化合物的表征
7,4′ -二羟基-8-异丙胺甲基-异黄酮:白色粉末,熔点:131~132 ℃.IR (KBr) ν(cm-1):3 438(—NH,—OH),3 084,2 963,2 851(—CH3,—CH2),1 681 (C=O),1 280 (C—N);1H NMR(DMSO-d6)δ:1.16 (d,J=6.4 Hz,6H,—NHCH (CH3)2),3.03 (m,1H,—NHCH(CH3)2),4.17 (s,2H,C8—CH2),6.63(d,J=8.9 Hz,1H),6.80 (d,J=8.6 Hz,2H),7.36(d,J=8.6 Hz,2H),7.78(d,J=8.9 Hz,1H),8.21(s,1H);13C NMR (DMSO -d6)δ:24.0,43.8,53.0,109.8,110.2,112.2,116.2,122.7,125.0,127.6,130.1,153.0,155.4,157.5,161.4,175.2 (C=O);HR MS m/z:326.139 1[M+H]+(calculated for C19H20NO4+326.138 7).
7,4′ -二羟基-8-正丙胺甲基-异黄酮:白色粉末,熔点:137~138 ℃.IR (KBr) ν(cm-1):3 445(—NH,—OH),3 088,2 965,2 854(—CH3,—CH2),1 683 (C =O),1281 (C—N);1H NMR(DMSO-d6) δ:0.95 (t,J=7.4 Hz,3H,—NHCH2CH2CH3),1.57 (m,2H),2.71 (m,2H),4.05 (s,2H,C8—CH2),6.67 (d,J=8.8 Hz,1H),6.80(d,J=8.6 Hz,2H),7.37(d,J=8.6 Hz,2H),7.80(d,J=8.8 Hz,1H),8.19(s,1H);13C NMR (DMSO-d6)δ:11.7(—NHCH2CH2CH3),20.8,48.6,56.4,109.8,115.3,116.2,117.8,122.9,123.7,126.3,130.5,152.7,155.6,157.4,169.6,175.2(C =O);HR MS m/z:326.138 8 [M+H]+(calculated for C19H20NO4+326.138 7).
7,4′ -二羟基-8-正丁胺甲基-异黄酮:白色粉 末,熔 点:140~141 ℃.IR (KBr) ν(cm-1):3 485(—NH,—OH),3 020,2 833(—CH3,—CH2),1687(C=O),1274(C—N);1H NMR (DMSO-d6) δ:0.88 (t,J=7.2 Hz,3H,—NHCH2CH2CH2CH3),1.34(m,2H),1.51 (m,2H),2.70(t,J=7.2 Hz,2H),4.15(s,2H),6.67 (d,J=8.8 Hz,1H),6.80(d,J=8.6 Hz,2H),7.37 (d,J=8.6 Hz,2H),7.81 (d,J=8.8 Hz,1H),8.21 (s,1H);13C NMR (DMSO -d6) δ:13.9 (—NHCH2CH2CH2CH3),21.9,32.8,48.7,55.2,109.7,115.3,116.2,117.7,122.9,123.7,126.3,130.5,152.7,155.6,157.4,169.5,175.2(C=O);HR MS m/z:340.154 6[M+H]+(calculated for C20H22NO4+340.154 3).
7,4′ -二羟基-8-二甲胺甲基-异黄酮:白色粉末,熔点:124~125 ℃.IR (KBr) ν(cm-1):3 440(—OH),2 955,2 853(—CH3,—CH2),1 624(C=O),1 265 (C—N);1H NMR (DMSO-d6)δ:2.80(s,6H),4.42 (s,2H),6.84 (d,J=8.7 Hz,2H),7.24 (d,J=8.9 Hz,1H),7.38 (d,J=8.7 Hz,2H),8.08 (d,J=8.9 Hz,1H),8.32 (s,1H),9.66 (s,1H),11.94 (bs,1H);13C NMR (DMSO-d6) δ:43.0,49.0,104.5,114.9,115.5,117.0,122.6,124.1,129.0,130.5,153.0,156.6,157.8,162.4,175.2(C=O);HR MS m/z:312.123 2[M+H]+(calculated for C18H18NO4+312.123 0).
7,4′ -二羟基-8-二乙胺甲基-异黄酮:白色粉末,熔点:135~136 ℃.IR (KBr) ν(cm-1):3 439(—OH),3 085,2 962,2 852 (—CH3,—CH2),1 680(C=O),1 280 (C—N);1H NMR (DMSO-d6) δ:1.34(t,J=6.9 Hz,6H,—N (CH2CH3)2),3.16 (q,J=6.9 Hz,4H),4.39(s,2H),6.89(d,J=8.6 Hz,2H),7.28(d,J=8.9 Hz,1H),7.39 (d,J=8.6 Hz,2H),8.06 (d,J=8.9 Hz,1H),9.70(s,1H),8.38(s,1H),12.02(s,1H);13C NMR (DMSO -d6)δ:9.02,44.0,47.7,104.7,114.9,115.4,115.5,117.0,122.6,124.0,128.8,130.4,153.1,156.6,157.8,162.4,175.2 (C=O);HR MS m/z:340.154 5[M+H]+(calculated for C20H22NO4+340.154 3).
7,4′ -二羟基-8-二正丙胺甲基-异黄酮:白色粉末,熔点:145~146 ℃.IR (KBr) ν(cm-1):3 445(—OH),3 085,2 962,2 852 (—CH3,—CH2),1 675(C=O),1 270(C—N);1H NMR(DMSO-d6),δ:0.86(t,J=7.3 Hz,6H,—N(CH2CH2CH3)2),1.55(m,4H),2.54(m,4H),4.07 (s,2H),6.82 (m,3H),7.39 (d,J=8.6 Hz,2H),7.89 (d,J=8.8 Hz,1H),8.29 (s,1H);13C NMR (DMSO-d6)δ:12.0 (—N(CH2CH2CH3)2),19.3,50.4,55.4,108.7,115.4,115.7,116.4,123.0,123.7,126.0,130.5,152.8,155.3,157.6,164.5,175.2 (C=O);HR MS m/z:368.185 4 [M+H]+(calculated for C22H26NO4+368.185 6).
2 结果与分析
2.1 反应位点的确证
大豆苷元-8-胺甲基化衍生物的IR 图谱上,3 440 cm-1左右是—OH 的吸收峰,3 085~2 833 cm-1的吸收峰为—CH3和—CH2中的C—H 振动吸收峰,1 650 cm-1左右是C=O 的吸收峰,1 265~1 280 cm-1的吸收峰为C—N 振动吸收峰,证实了大豆苷元-8-胺甲基化衍生物的形成.当以大豆苷元为原料发生Mannich 反应时,大豆苷元的芳环上有多个反应位点,但是通过控制反应条件,该反应区域选择性的在大豆苷元的8 位发生反应,形成了一系列大豆苷元-8-胺甲基化衍生物.如目标化合物8-二正丙胺甲基大豆苷元衍生物(7,4′ -二羟基-8-二正丙胺甲基-异黄酮),根据其质谱数据可知,有368 [M+H]+的分子离子峰,说明生成的是单胺甲基大豆苷元衍生物.在大豆苷元的1H NMR 谱上,δ 6.88 (s,1H)是A 环上H-8 的化学位移,而在8-二正丙胺甲基大豆苷元衍生物的1H NMR 谱上H-8 的峰消失,且在δ 4.07 (s,2H)处出现了一个亚甲基的峰.在13C NMR 谱中,大豆苷元A 环上C-8 的化学位移是δ 102.5,而8-二正丙胺甲基大豆苷元衍生物上C-8 的化学位向低场移动6.2 ppm 至δ 108.7,而其相邻碳的化学位移变化不大.通过1H NMR,13C NMR 和质谱数据综合分析,虽然大豆苷元发生胺甲基化反应的位点有多处,但在此反应中的反应位点是8 位,该反应具有明显的区域选择性.
2.2 大豆苷元-8-胺甲基化衍生物合成的影响因素研究
为了提高目标化合物的产率,以大豆苷元、甲醛和二正丙基胺为反应底物,对溶剂、时间、温度和反应物的物质的量比等因素进行了考察.
2.2.1 反应溶剂的影响
由于大豆苷元溶解度较差,反应溶剂的选择将对于产物的产率有较大的影响.根据黄酮类化合物的溶解性能,分别选择甲醇、乙醇、异丙醇、THF和DMF 等为溶剂,反应物大豆苷元与二正丙基胺的物质的量比为1∶1,反应时间为6 h,反应温度为65 ℃,结果如图3 所示.结果表明:以甲醇、乙醇和四氢呋喃为溶剂时,由于大豆苷元在其中的溶解性差,因此产率较低(<30.0%);改用异丙醇为溶剂时,产率有所提高(42.0%);当以DMF 为溶剂时,产率明显提高(58.0%),且副产物较少,易于分离,因此选用DMF 为反应溶剂.

图3 反应溶剂对产率的影响Fig.3 The influence of the solvent on the yield
2.2.2 反应温度的影响
以DMF 为反应溶剂,选择0、20、40、65、80、100 ℃不同的反应温度,反应物的物质的量比为1∶1,反应时间为6 h,结果如图4 所示.结果表明:反应温度对该反应具有明显的影响.随着温度的升高反应产率逐步增加,当温度为65 ℃时产率达到最高值84%;继续升高温度,目标产物的产率反而下降.分析其中的原因,可能是在65 ℃以下,该反应受到热力学规律控制,升高温度,增加了分子的动能,反应的速度增加,产物的产率随之提高;当温度超过65 ℃以后,由于大豆苷元结构中的酚羟基容易氧化,或有双胺甲基化产物等副产物生成,因而会导致产物的产率降低.因此,该反应选择65 ℃为最佳的反应温度.
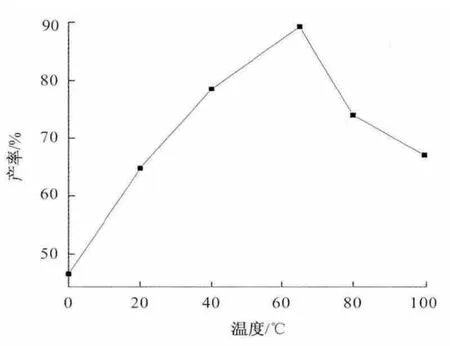
图4 反应温度对产率的影响Fig.4 The influence of the temperature on the yield
2.2.3 反应时间的影响
以大豆苷元与二正丙基胺(物质的量比为1∶1)为原料,DMF 为反应溶剂,选择0.5、2.0、4.0、6.0、8.0 h 不同的时间在65 ℃温度下反应,结果如图5所示.结果显示:在2.0 h 之前,反应产率增加明显;在2.0 h 后,随反应时间延长反应产率缓慢增加;反应6.0 h 时,产率达到最高(84.0%);如果继续延长反应时间,目标产物的产率开始下降,原因可能是部分单取代的胺甲基化产物转化为双取代的大豆苷元衍生物,从而使目标产物的产率降低.因此选择6.0 h 为最佳的反应时间.
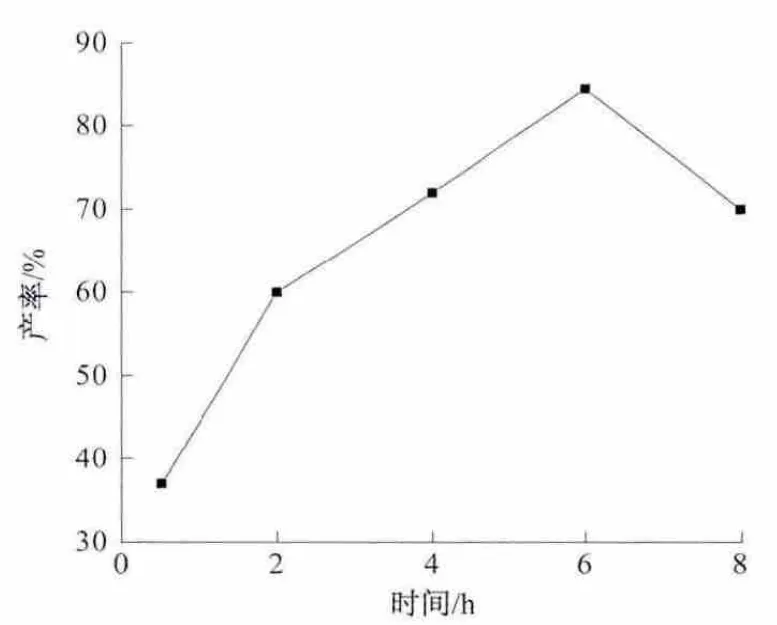
图5 反应时间对产率的影响Fig.5 The influence of the time on the yield
2.2.4 反应物的物质的量比对反应的影响
以DMF 为溶剂,大豆苷元与二正丙胺的物质的量比 分别选 择为2.5∶1,2∶1,1.5∶1,1∶1 和0.5∶1,在65 ℃下反应6.0 h.由于甲醛采用的是37%的甲醛水溶液,在反应过程中部分会挥发,因此反应中甲醛的量都是过量的(是大豆苷元的3 倍),结果如图6 所示.结果表明:反应原料的物质的量的比对产率有明显的影响,随着二正丙胺量的增加,产物的产率逐渐升高;当其物质的量比为1∶1 时,反应产率达到84.0%;继续增加二正丙胺的量,产物的产率反而下降,原因可能是由于反应液中胺过量,随着时间的延长,生成的大豆苷元的单胺甲基化取代产物部分转化成双取代的产物,从而导致单取代产物的产率降低.因此,大豆苷元与二正丙胺最佳的物质的量比为1∶1.
以大豆苷元、甲醛和二正丙胺为原料,通过对反应的考察,筛选出最佳的反应条件,即大豆苷元与胺的物质的量比为1∶1,在65 ℃DMF 溶剂中反应6 h,最高产率可达84.0%.
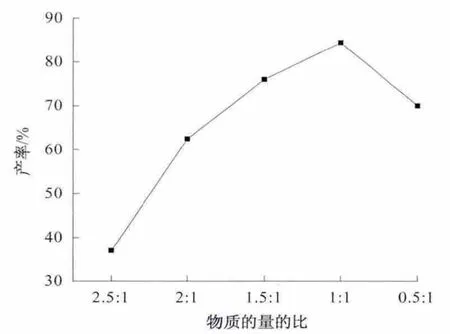
图6 反应物的物质的量的比对产率的影响Fig.6 The influence of the molar ratio of reactants on the yield
3 结论
以大豆苷元、甲醛和一级胺或二级胺为原料,通过Mannich 反应成功合成了一系列大豆苷元-8-胺甲基化衍生物,该反应具有明显的区域选择性,通过IR、1H NMR、13C NMR 和HR MS 对产物的结构进行了确认.对反应物的比例、溶剂、温度和时间等影响因素进行了优化,得到最佳的反应条件,该方法为大豆苷元的选择性胺甲基化衍生物的合成提供了一条方便可行的路线.
[1]曾靖,黄志华,邱峰,等.大豆苷元耐缺氧的实验研究[J].中国现代应用药学杂志,2004,21(6):454-456.
[2]范礼理,赵德化,赵敏崎,等.葛根黄酮抗心率失常作用[J].药学学报,1985,20(9):647-665.
[3]Wu S Y,Brewer M S.Soy protein isolate antioxidant effect on lipid peroxidation of grouond beef and microsomal lipids[J].J Food Sci,1994,59(4):702-706.
[4]Colditz G A,Stampfer M J,Willett W C,et al.Type of postmenopausal hormone use and risk of breast cancer:12-year follow-up from the nurses' health study[J].Cancer Causes Control,1992,3(5):433-439.
[5]李潮,薛晓鸥,师莉莉.大豆苷元对去卵巢大鼠子宫雌激素受体亚型表达的影响[J].中国妇产科临床杂志,2005,6(4):269-271.
[6]Yadav D K,Gautam A K,Kureel J,et al.Synthetic analogs of daidzein,having more potent osteoblast stimulating effect[J].Bioorg Med Chem Lett,2011,21(2):677-681.
[7]彭游,邓泽元,叶志刚.大豆苷元的前药修饰研究进展[J].化学通报,2011,74(6):508-512.
[8]刘谦光,张尊听,薛东.大豆苷元磺化物的合成、晶体结构及活性研究[J].高等学校化学学报,2003,24(5):820-825.
[9]王秋亚,张尊听.单甲基化及双乙基化大豆苷元磺酸锰的合成及晶体结构[J].光谱实验室,2009,26(2):395-402.
[10]Chen X L,Shi X N,Qu L B,et al.Synthesis of novel phosphorylated daidzein derivatives and ESI investigation on their non -covalent complexes with lysozyme[J].Chin J Chem,2007,25(7):1008-1013.
[11]Wei Y L,Peng A Y,Wang B,et al.Synthesis and biological evaluation of phosphorylated flavonoids as potent and selective inhibitors of cholesterol esterase[J].Eur J Med Chem,2014,74:751-758.
[12]朱晓亮,袁金伟,肖咏梅,等.大豆苷元双黄酮的合成研究[J].河南工业大学学报:自然科学版,2013,34(2):67-71.
[13]Xiao Y M,Zhu X L,Yuan J W,et al.Synthesis and characterization of novel unnatural di(8-daidzeinyl)methane [J].Chem Nut Compd,2014,50(1):76-79.
[14]Strong A L,Jiang Q,Zhang Q,et al.Design,synthesis,and osteogenic actibity of daidzein analogs on human mesenchymal stem cells[J].ACS Med Chem Lett,2014(5):143-148.
[15]Hari Babu T,Rama Subba Rao V,Tiwari A K,et al.Synthesis and biological evaluation of novel 8-aminomethylated oroxylin A analogues as α -glucosidase inhibitors[J].Bioorg Med Chem Lett,2008,18(5):1659-1662.
