鸡胰脏中胰酶提取工艺技术研究
2015-04-23周雅丹张国治
周雅丹,张国治,范 璐
(河南工业大学1.粮油食品学院;2.分析测试中心,河南 郑州 450001)
0 引言
胰酶是从动物胰脏中提取的一种混合酶制剂,含有胰蛋白酶、胰脂肪酶和胰淀粉酶3 种主要消化酶和其他生物活性物质.胰酶在食品工业、皮革工业、医药工业,以及科研等领域都有广泛的用途.在食品加工业中应用胰酶生产氨基酸以及干酪素等;皮革工业中应用胰酶脱脂、软化,不仅能提高产品质量和等级,而且可以节约成本;在医药上可以作为助消化药物,用于治疗消化不良,食欲不振,慢性胰腺炎等疾病;在科研领域,胰酶主要应用于细胞培养技术研究等[1-5].生产胰酶的方法有碱溶液提取法、酸溶液提取法、盐溶液提取法、水洗提取法、有机溶剂提取法和超声波辅助碱提法等,目前国内从猪胰脏中提取胰酶的报道有很多[6-8],且大都使用有机溶剂提取方法.作者以鸡胰脏为原料,采用有机溶剂提取法,通过单因素试验研究提取胰酶条件的pH、温度、时间,以及提取溶剂异丙醇浓度对胰酶活力及相关品质的影响,并通过正交试验确定鸡胰酶制备最佳工艺条件.
1 材料与方法
1.1 材料与试剂
鸡胰脏购于郑州菜市场;氯化钙、三氯醋酸、阿拉伯胶粉:天津市科密欧化学试剂有限公司;麦芽糖、马铃薯淀粉、牛胆盐:北京奥博星生物技术有限责任公司;氢氧化钠、硫代硫酸钠:北京化工厂;硼酸:北京朝阳区金盏化工厂;异丙醇:天津市天力化学试剂有限公司;丙酮:洛阳市化学试剂厂.所有试剂均为分析纯.
1.2 主要仪器与设备
pHB-5 便携式pH 计:上海伟业仪器厂;UV-2600 紫外分光光度计、AY-120 电子分析天平:日本岛津;J-26XP 台式高速冷冻离心机:美国贝克曼库尔特;HHS 型电热恒温水浴锅:金坛市华峰仪器有限公司;LGJ-18C 冷冻干燥机:北京四环科学仪器厂;冰箱:青岛海尔股份有限公司.
1.3 试验方法
1.3.1 工艺流程
新鲜/冷冻鸡胰脏→胰浆→激活提取→过滤→胰乳滤液→高浓度异丙醇沉淀→离心→脱脂→冷冻真空干燥→胰酶粉.
1.3.2 单因素试验设计
胰蛋白酶、胰脂肪酶、胰淀粉酶活力、脂肪残留和干燥失重为胰酶鉴定指标,在工业化生产中胰酶提取率也是重要考察指标.在制备过程中,沉淀剂异丙醇浓度60%、沉淀温度4 ℃、脱脂剂为预冷丙酮不变,通过改变提取激活条件的pH、温度、提取剂浓度和时间,分别做3 次重复试验,考察这些因素对鸡胰酶活力、提取率和其他品质指标的影响.
1.3.3 正交试验设计
根据单因素试验结果,在提取激活pH、温度、提取剂浓度和时间4 个因素中,每个因素选择三水平,选用正交表L9(34)进行试验,从中选出最佳水平组合.
1.3.4 胰酶活力测定及相关品质测定的方法
胰蛋白酶、胰脂肪酶和胰淀粉酶活力及相关品质(脂肪残留、干燥失重)的测定参照《中华人民共和国药典》[9].
2 结果与分析
2.1 单因素试验结果分析
2.1.1 提取激活pH 值对胰酶活力的影响
考察提取激活pH 为4、5、6、7、8 对胰酶活性的影响,其他工艺参数为:提取剂浓度为10%、激活时间为6 h、提取激活温度为5 ℃、保护剂为麦芽糖0.5%,马铃薯淀粉0.5%、激活剂为氯化钙0.2%、沉淀剂浓度为60%,在不同pH 条件下制备胰酶,试验重复3 次,取平均值,胰酶活力及其他品质指标结果见表1,pH 为6 时,三酶活力及提取率均最高,因此单从pH 来考虑,pH 在5~7 之间,酶活力较高.
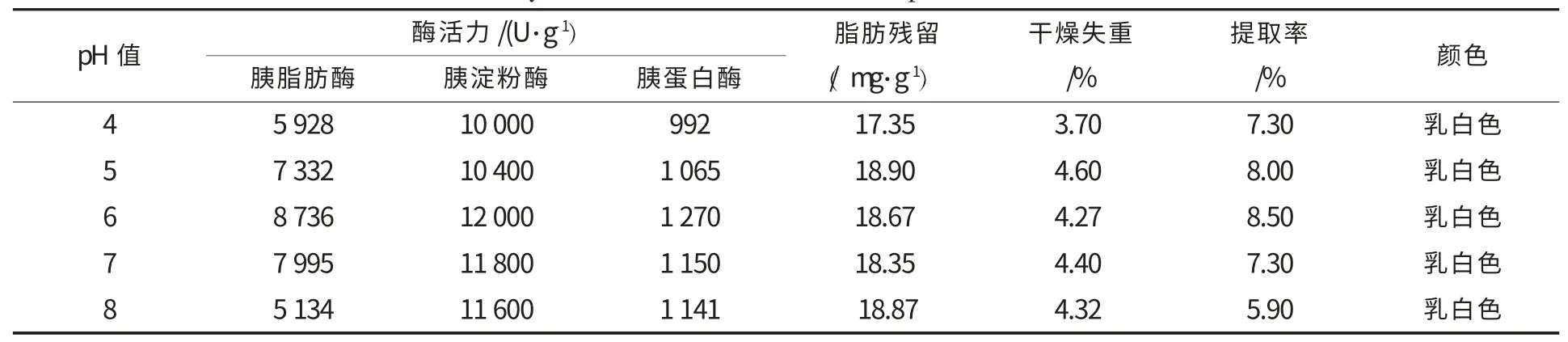
表1 不同提取激活pH值对胰酶的三酶活力、提取率及其他品质的影响Table 1 Effects of different pH value of extracting and activating on the three enzyme activity,yield and other indicators of pancreatin
2.1.2 提取激活温度对胰酶活力的影响
其他提取条件不变,提取激活温度设定为5℃、10 ℃、15 ℃、20 ℃、25 ℃,试验重复3 次,取平均值,胰酶活力及其他指标结果见表2.温度过高,导致胰酶失活,当温度高于或低于15 ℃,三酶活力及质量收率都降低,温度在(15±5)℃范围内,胰酶活力和提取率较高.
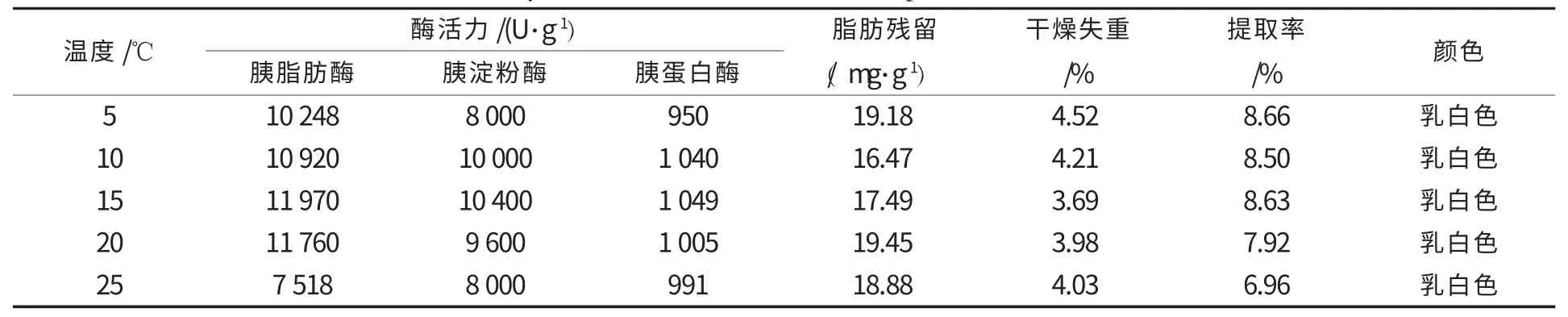
表2 不同提取激活温度对胰酶的三酶活力、提取率及其他品质的影响Table 2 Effects of different temperature of extracting and activating on the three enzyme activity,yield and other indicators of pancreatin
2.1.3 提取剂浓度对胰酶活力的影响
其他提取条件不变,提取剂浓度设为5%、10%、15%、20%、25%,试验重复3 次,取平均值,胰酶活力及其他指标结果见表3.随着异丙醇浓度增加,三酶活力均是先增加后降低,要保证较高的酶活力和提取率,同时节省异丙醇用量,激活提取过程中应选择提取剂浓度在5%~10%之间.
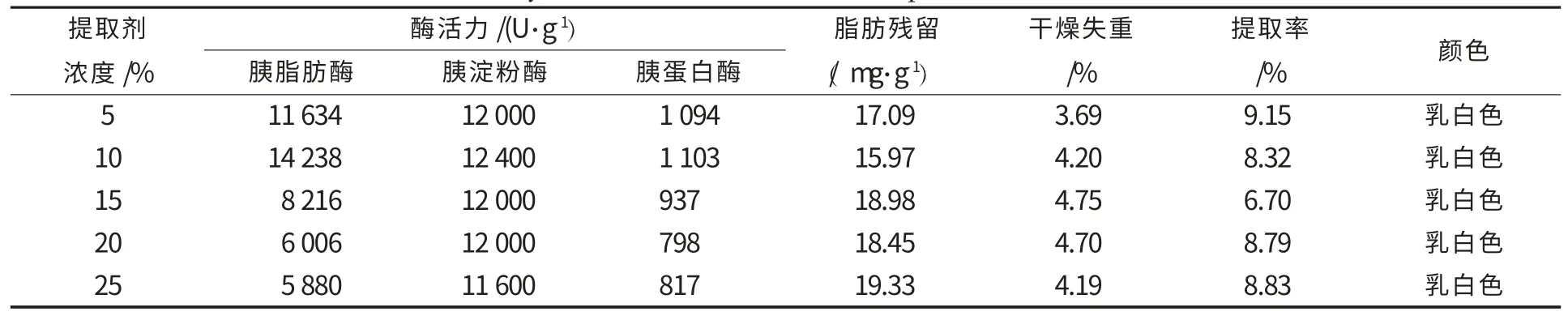
表3 不同提取剂浓度对胰酶的三酶活力、提取率及其他品质的影响Table 3 Effects of isopropyl alcohol concentration of extracting and activating on the three enzyme activity,yield and other indicators of pancreatin
2.1.4 提取激活时间对胰酶活力的影响
考察激活提取时间为2、4、6、8、10 h 对提取效果的影响,试验重复3 次,取平均值,结果见表4.提取激活时间为6 h 时,三酶活力达到最高.时间过短,胰蛋白酶、胰淀粉酶和胰脂肪酶未被完全溶出,活力较低;时间过长,酶自身降解,酶活力降低.随着提取时间延长,三酶活力均是先增加后降低,要保证较高的酶活力和提取率,激活提取时间选择在5~7 h 之间.
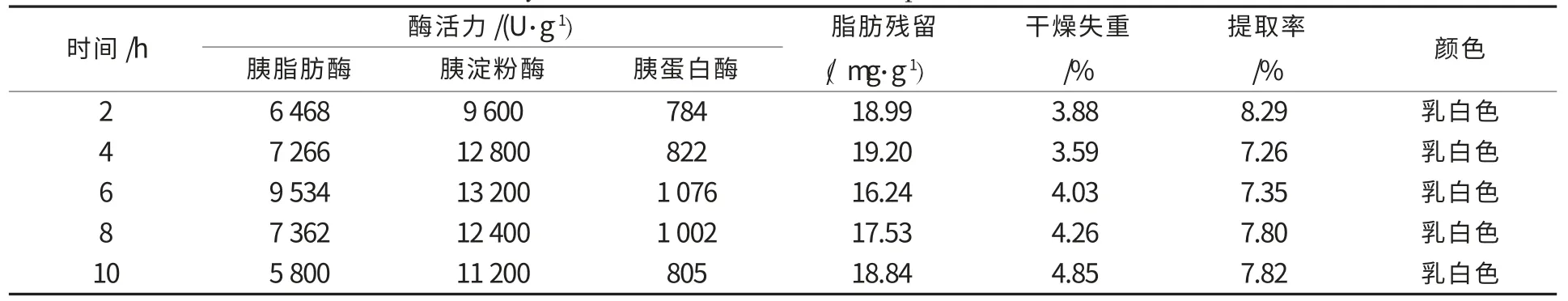
表4 不同提取激活时间对胰酶的三酶活力、提取率及其他品质的影响Table 4 Effects of different time of extracting and activating on the three enzyme activity,yield and other indicators of pancreatin
2.2 正交试验结果与分析(表5—表8)
根据单因素试验结果确定激活提取pH 5~7,温度(15±5)℃,提取剂浓度5%~10%,时间5~7 h,通过L9(34)正交试验确定提取鸡胰酶最佳工艺参数.从表7 可确定最优组合为A3B1C2D1,由表8可知,胰酶制备在该工艺条件下是可行的,胰脂肪酶、胰淀粉酶、胰蛋白酶活力均符合国家药典标准(胰脂肪酶、胰淀粉酶、胰蛋白酶活力分别为4 000 U/g、7 000 U/g、600 U/g,脂肪残留量为20 mg·g-1,干燥失重5%).

表5 L9(34)正交试验因素与水平Table 5 The factors levels of orthogonal test L9(34)
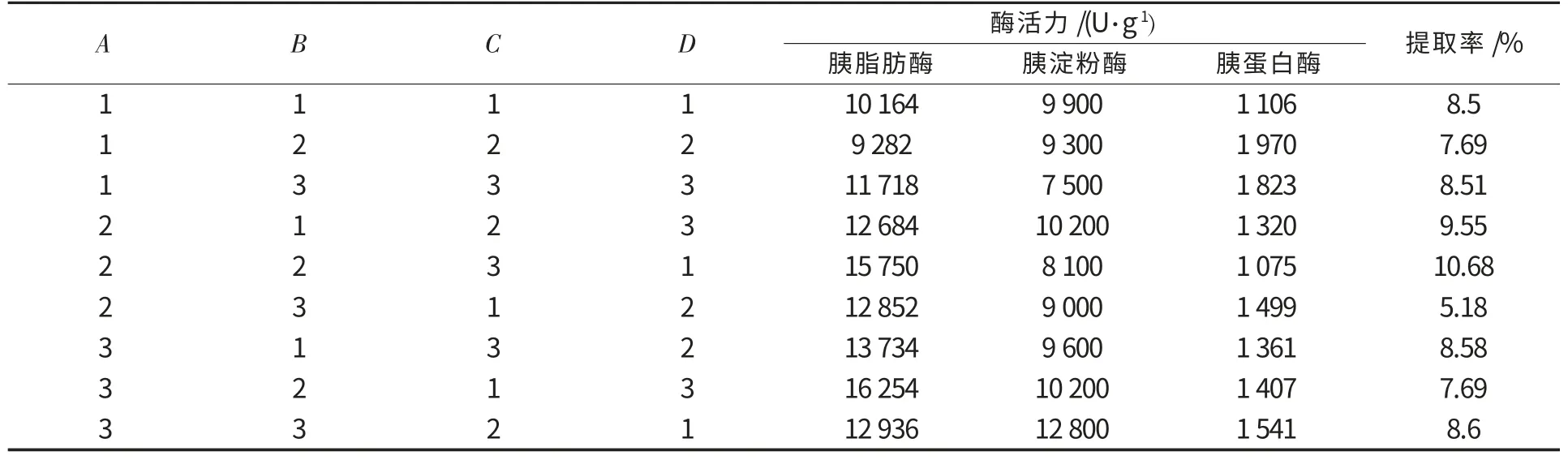
表6 正交试验L9(34)结果Table 6 The results of the orthogonal test L9(34)
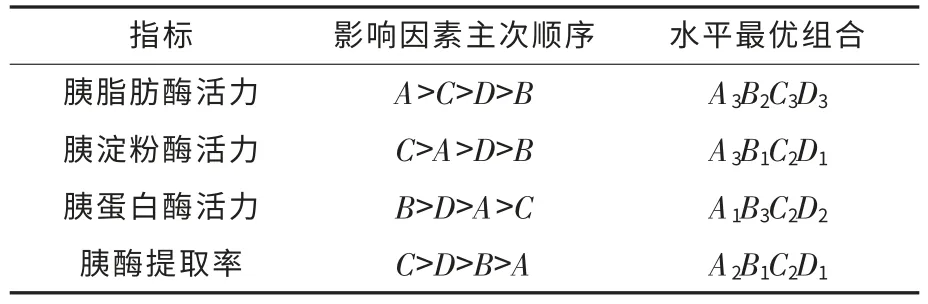
表7 正交试验的直观分析结果Table 7 The visual analysis results of the orthogonal test L9(34)
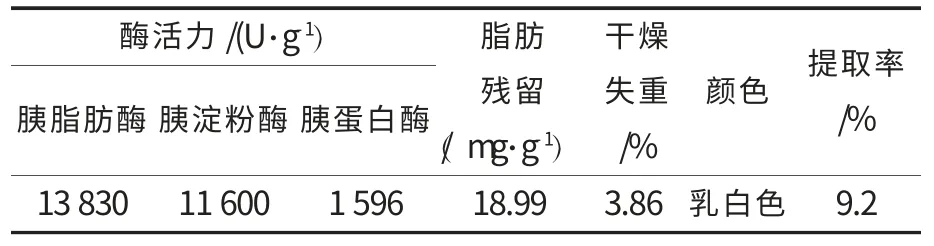
表8 验证试验所得到胰酶的三酶活力、提取率和其他指标Table 8 The three enzyme activity,yield and other indicators of pancreatin of verification experiments
3 结论
通过对鸡胰脏中提取胰酶的工艺条件的探讨,确定最佳优化工艺条件为:以新鲜或冷冻鸡胰脏为原料,使用浓度为7.5%异丙醇为提取剂(原料量的1.5 倍),同时加入激活剂(氯化钙0.2%),保护剂(麦芽糖0.5%,马铃薯淀粉0.5%),在温度为(10±1) ℃,pH 为7 条件下提取激活5 h 后过滤,将预冷至4 ℃99.7%的异丙醇加入滤液中,使异丙醇浓度达到60%,冷冻离心沉淀,用预冷丙酮进行脱脂,冷冻真空干燥,粉碎得到胰酶粉.在该工艺条件下制备的胰酶中胰脂肪酶、胰淀粉酶、胰蛋白酶活力分别为13 830 U/g、11 600 U/g、1 596 U/g,提取率为9.2%,脂肪残留量为18.99 mg·g-1,干燥失重3.86%,均符合国家药典标准(胰脂肪酶、胰淀粉酶、胰蛋白酶活力、脂肪残留量、干燥失重分别为4 000 U/g、7 000 U/g、600 U/g、20 mg·g-1、5%).
[1]吴晓英,张聚宝,林影,等.胰酶制备新工艺的研究[J].广东药学院学报,2005,21(1):64-67.
[2]Andriamihaja M,Guillot A,Svendsen A,et al.Comparative efficiency of microbial enzyme preparations versus pancreatin for in vitro alimentary protein digestion [J].Amino Acid,2013,44(2):563-572.
[3]Nakamura T,Tandoh Y,Terada A,et al.Effects of high-lipase pancreatin on fecal fat,neutral sterol,bile acid,and short-chain fatty acid excretion in patients with pancreatic insufficiency resulting from chronic pancreatitis[J].International Journal of Pancreatology,1998,23(1):63-70.
[4]赵小兰.胰酶制备工艺研究[J].青海医药杂志,2000,30(4):56-57.
[5]郭兆斌,韩玲,刘亮亮,等.猪胰脏中胰酶的提取工艺优化研究[J].食品科学,2009,30(22):162-164.
[6]王伟林,郑树森.慢性胰腺炎的胰酶替代治疗[J].中国实用外科杂志,2011,31(9):823-825.
[7]魏文毅,张丽萍,王琴,等.猪胰脏中胰酶的制备新工艺技术研究[J].黑龙江八一农垦大学学报,2011,23(1):72-78.
[8]安正仑,高学军,孙福忠.猪胰酶制备工艺研究[J].黑龙江畜牧兽医,2006(11):74-75.
[9]中华人民共和国药典委员会.中华人民共和国药典:二部[S].北京:化学工业出版社,2005:625-627.
