酶技术制取植物油脂的研究进展
2015-04-23陈复生郝莉花江连州殷丽君
陈复生,郝莉花,江连州,殷丽君
(1.河南工业大学 粮油食品学院,河南 郑州 450001;2.东北农业大学 食品学院,黑龙江 哈尔滨 150030)
0 引言
植物油料作为油脂和蛋白质的重要来源,既是人们日常生活的必需品,也是重要的工业原料.我国作为油料消费大国,油料供给短缺的状态一直存在,甚至日趋紧张.近年我国油料、植物油供需情况见表1,2014/2015 年度我国油料总产量5 755.7 万t,较2010/2011 年度(5 805.7 万t)降低0.009%;2014/2015 年度我国进口油料7 833.0 万t,较2010/2011 年度(5 366.0 万t)急增46.0%;国产油料产量的降低,导致油料进口持续增加.2014/2015 年度植物油产量2 434 万t,较2010/2011 年度(1 922 万t)增加26.6%;2014/2015 年度植物油消费量3 311.0 万t,较2010/2011 年度(2 779.1 万t)增加19.1%;虽然植物油产量增加迅速,但产量依然不能满足需求,仍有1 000 万t 左右需进口.近年,国产油料植物油产量基本维持稳定(1 000万t 左右)[1],油料和植物油大量进口,导致我国油料和植物油自给率逐年下降,油料已成为我国对国际市场依存度最大的大宗农产品之一.
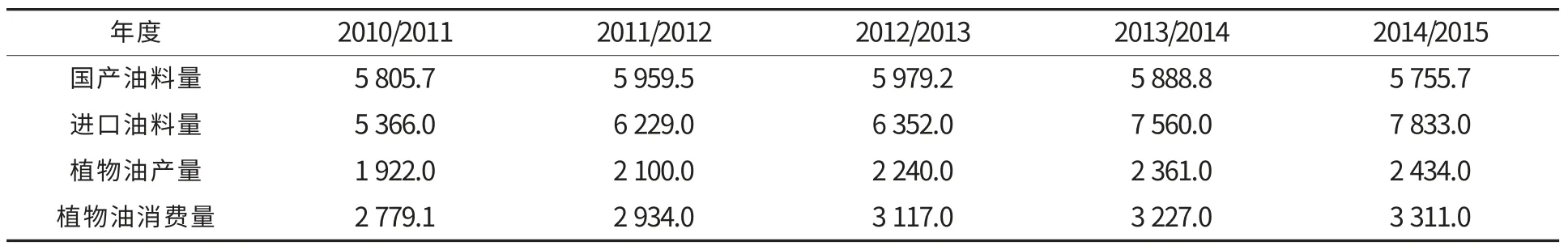
表1 我国油料、植物油供需情况[1]Table 1 China oilseeds and vegetable oil supply and distribution[1] 104t
目前,我国油脂工业不仅面临着油料进口的严重冲击,而且也面临着现行油脂加工技术的创新和提升以保障产品安全性和生产效率提高等严峻挑战.因此,我国食品工业“ 十二五”发展规划指出,要稳定传统大豆油生产,着力增加以国产油料为原料的油脂生产,大力推进以粮食加工副产物为原料的油脂加工,积极发展木本植物油生产,促进油脂品种多元化,提升食用植物油自给水平.
酶技术作为一种新兴的油脂和蛋白质提取方法,产品的营养价值保存良好、能满足人们的消费需求;产品不具有化学溶剂残留,满足人们的食品安全需求;产品加工过程中不使用化学类加工试剂、助剂,满足国家和人民的环境保护要求;产品加工对油料的利用程度高,既可得到高回收率的油脂,也可得到营养价值较高的蛋白质产品,提高了油料加工企业的经济效益和产品附加值.
1 现行植物油脂制取技术及其特点
目前,我国油脂制取主要采用浸出法和压榨法.浸出法是利用有机溶剂将油脂从原料中萃取出来.压榨法不借助化学试剂,而是采用物理机械挤压的方式将油脂从原料中提取出来,分为冷榨与热榨两种工艺,两者的差别在于热榨是将物料在榨油前进行烘炒等热处理,而冷榨没有这些前处理过程,是将温度控制在一定范围内进行的物理压榨.近年来,为提高油脂品质和产率并获得高质量蛋白副产物,水酶法制油成为了新的研究热点,其原理是利用酶破坏油料细胞的细胞结构、改变胞内大分子结构,从而使油脂以自由态的形式提取出来.
1.1 浸出法
凡是利用某些有机溶剂“ 溶解”油脂的特性,将料坯或者预榨油饼中的油脂提取出来的方法,都称之为浸出法[2].浸出法提油是现行工业化产油的方法之一,应用较为广泛,提油效率较高,但缺点是油的风味物质损失,浸出的油脂色泽较深,需要进一步精炼,增加了工艺的繁琐性,产品溶剂残留不能满足当前消费者对健康的需求,且其三废排放会对环境造成污染,油料蛋白质变性严重、综合利用价值低,这些都限制了浸出法的进一步发展应用.
1.2 压榨法
压榨法是利用机械力将油料中的油脂挤压出来的一种制油方法,分为热榨法和冷榨法[2].热榨法是现代工业化生产中除溶剂浸出法外的主要制油方法,使用烘炒等办法,最大限度地促使蛋白质变性,而后对料坯进行物理挤压,提取其中的油脂.在资源日趋短缺的今天,该法不利于资源的综合利用,浪费了大量的优质蛋白质,且出油率不及浸出法高,但其产品没有溶剂残留的优点得到广泛认可.
冷榨法是在温度低于60 ℃下,借助机械力挤压制油,与浸出法和热榨法进行比较,它不仅可以避免浸出法油脂产品的食品安全问题(与溶剂、碱液、脱色白土等有害物质接触),并且在一定程度上克服了热榨法油脂有效成分遭到部分破坏的缺点,最大限度地保持了产品中的脂溶性营养成分,但制得的油脂风味较差.冷榨法降低了蛋白质的变性程度,增加了油料蛋白的附加值,利于资源的综合利用.
2 酶技术制取植物油脂的国内外研究进展
2.1 酶技术制取植物油脂
水酶法是酶技术制取植物油脂研究的主要代表.水酶法是指采用能降解油料植物细胞壁,或对脂蛋白、脂多糖等大分子复合物具有水解作用的酶来处理油料,破坏其组织结构、水解大分子复合体,并利用非油成分对水和油亲和力不同以及水油的密度差将油脂提取出来[3].影响水酶法提油效果的关键因素主要有油料的破碎粒径、酶的种类、酶浓度、料液比、酶解时间、温度、pH 等,具体酶解工艺参数的选择与油料组织结构特点密切相关.
2.1.1 油料的破碎粒径
初期的研究并没有充分重视到油料破碎粒径是油脂提取效率的重要影响因素之一[4-5].理论上,对于给定的提取条件,粒径越小出油率越高,这是由于严重的细胞壁破坏缩短了酶和细胞内各成分的扩散路径.对于大豆来说,大豆粉比大豆片出油率提高了24%[6].大豆、葵花籽的粒径<0.2 mm[7],葡萄籽粒径<0.5 mm[4],提油率较高.Gros 等[8]研究在亚麻籽油提取过程中,亚麻籽仁粉碎到不同的粒径甚至超微级别,提油率增加.Nyam 等[9]报道高含油量的喀拉哈里沙漠瓜子粉碎粒径过小,有可能导致破碎颗粒之间粘连更紧密,不利于提取.因而,在工业上不推荐油料破碎粒径太低,存在最佳粒径.
2.1.2 酶的种类
酶种类的选择取决于油料的结构及其细胞内的组分[4].Rosenthal 等[5]报道,与纤维素酶、半纤维素酶、果胶酶相比,蛋白酶(Alcalase 2.4 L)能有效提高加热过的大豆蛋白粉的出油率.Santos 等[10]报道,碱性蛋白酶、中性蛋白酶也可提高大豆粉的出油率,且碱性蛋白酶的出油率更高.Jung 等[6]报道,蛋白酶、磷脂酶对大豆饼粕的出油率分别为96.0%、73.4%.此外,Lamsal 等[11]报道,单独使用纤维素酶或纤维素、果胶复合酶都不能有效提高大豆饼粕的出油率(68%),而单独使用蛋白酶出油率可提高到88%.这些研究说明单一酶、复合酶对油料均有特异性.蛋白质作为大豆种子细胞壁的主要组成成分,蛋白酶加入后通过降解细胞质中的蛋白质,有利于油脂的释放.果胶是油菜籽细胞壁的主要成分,果胶酶比其他糖化酶可以有效提高出油率,果胶酶、纤维素酶、β-葡聚糖(4∶1∶1)复合酶,使出油率达到91.6%,这种酶的使用排除了出油率提高的障碍[12].
要获得较好的提油效果,一般使用复合酶,因为酶之间存在协同效应[4].但有的油料,使用单一酶或复合酶没有太大区别,如用碱性蛋白酶、戊聚糖复合酶与碱性蛋白酶、纤维素复合酶对大豆进行水酶法制油,油脂得率无明显区别[13].Tabtabaei等[14]研究黄芥末粉制油时,单独使用纤维素酶、果胶酶、戊聚糖酶,油脂得率无明显区别.Latif 等[15-17]进行了一系列的研究发现,碱性蛋白酶、中性蛋白酶作用于芝麻和麻木油种子有较高的提取率,戊聚糖复合酶作用于葵花籽有较好的提油效果.使用Neutrase 0.8 L 和复合酶提取柿子油,油脂得率几乎无差异[18].Long 等[19]研究发现,在亚麻籽油提取中单独使用纤维素酶、果胶酶、半纤维素酶比β-葡糖苷酶和蛋白酶使用有更高的油脂得率61.7%~66.1%.
Jiang 等[20]研究5 种不同的蛋白酶对花生油出油率的影响,结果为Alcalase(73.45%),As1398(66.36%),Nutrase(60.08%),Protizyme(55.02%)和Protamex(48.89%),使用单一碱性蛋白酶可使油脂得率最高达到79.32%,降低了酶的使用生产成本.王章存等[21]以低变性花生饼为原料,研究了细胞破壁酶和蛋白酶对花生油和蛋白提取率的影响.结果表明,Viscozyme、酸性蛋白酶和碱性蛋白酶的水解效果较好,且先用酸性蛋白酶后用碱性蛋白酶水解效果优于单一酶,花生油和蛋白提取率分别为70.23%和76.06%,比单独用Viscozyme、酸性蛋白酶和碱性蛋白酶水解时,花生油提取率分别提高42.11%、21.46%和37.13%;花生蛋白提取率分别提高39.58%、32.46%和9.36%.
以上研究表明,尽管已有许多研究说明复合酶之间存在协同效应,但在油脂提取中使用单一酶或复合酶没有统一的结论.酶的选择取决于油脂在油料细胞架构中的位置、细胞中存在于油脂周围的化学成分的物理化学性质及油脂与油料细胞内各类化学物质之间的作用力.因而,不仅要看油料细胞的主要化学组成成分,而且要研究油料细胞结构的构架和某些阻碍油脂释放的特定成分及特定的分子间作用力[22].油料细胞结构的细化研究是酶技术制取油脂的基础,选择合适的酶制剂种类是酶技术高效制取油脂的关键影响因素之一.确定合适的酶制剂之后,影响酶有效作用的各类因素应综合考虑.
2.1.3 酶的浓度、料液比
酶浓度高有利于酶与底物之间反应更彻底,因而提高了细胞壁的降解和肽键的断裂[20,23-24],但是酶浓度太高易导致不良气味产生[20],还有可能导致提取物中产生不期望得到的组分.当酶浓度增加到一定程度,油脂提取率随酶浓度增加保持不变或下降.或产生可溶性的焦糖类阻止油脂的释放[25].通常实际酶的浓度还取决于生产过程中的经济成本要求和油脂的质量要求,酶的浓度越高,需要的酶制剂越多,生产成本增加,且酶浓度过高会影响油脂本身的风味.
在水酶法提取植物油中,水作为提取介质,可以进入油料细胞内部,改变油料的水分活度[22].油料内水分含量的增加有助于酶和油料组分的迁移、扩散和水解反应的发生[7,12,23,26].油料内低水分活度易导致油脂提取过程中厚的悬浮液的形成,阻止酶进入油料内部发生水解反应[12].尽管较高的水分活度能提高提取效率[27],但水分浓度太高时,将降低酶、底物浓度,起到相反的作用[12,23,26],因而选择合适的加水量对水酶法提油很重要.
2.1.4 酶解pH
pH 直接影响酶与底物的结合与催化作用,合适的pH 影响油料中油脂和其他成分的提取,每种酶达到其最大效力所需的pH 各不相同[28].在早期的研究认为,无论是浸泡预处理或提取本身,pH 值一般设置在酶最大活力处[5,6,15,29-31].然而,很多酶pH 的选择还依赖于油料蛋白质的等电点,因为在蛋白质的等电点,油脂不受蛋白质的抑制而释放出来[22].因而pH 值的设置不仅受酶作用最适pH的影响也取决于油料蛋白质的等电点[14,30-32].在工业生产中,调节pH 值会增加加工工艺的繁琐性.一些学者考虑用复合酶实现在远离蛋白质等电点时也能获得较高的油脂提取效率.林莉等[33]α-淀粉酶和中性蛋白酶的复合酶,根据所选的酶种类确定最适酶解pH,使酶和底物反应充分,淀粉酶最适pH 为5.5~7.5,中性蛋白酶最适pH 为7.0~8.0,通过试验得出在料液比1∶6、酶解时间3 h、酶解温度50 ℃、酶用量1%条件下,选择pH 6 为体系的最适酶解pH.
2.1.5 酶解温度
酶的作用除了要求合适的pH 范围外,对温度也有最适作用区间要求.酶的水解温度一般在40~55 ℃[34].温度对油脂提取有显著的影响,花生油产量在40 ℃时明显高于37 ℃[35].温度高于45 ℃,酶失活导致酶的水解能力下降,油脂得率降低,由于油料细胞内可溶性糖的存在,在干燥时可能发生焦糖化反应,影响油脂的释放[22,25].一些酶的作用范围低于此区间,满足人们较低温度产生出最佳的效力的愿望[4].以橄榄为例,30 ℃较低的温度能使其保持良好的品质[36-39].
2.1.6 酶解时间
随着酶作用时间的延长,酶有效作用油料细胞结构和组分,底物降解程度加深[10,18,20,23].纤维素酶、蛋白酶、木聚糖酶、果胶酶的复合酶作用时间120 h 比24 h 油脂提取率增加3.8%,但120 h 的浸润时间在实际生产中很难被接收[4],且时间的延长可能导致油脂品质的下降[20].与溶剂浸出提油相比,酶的作用时间长是水酶法的缺点之一[34].总之,油脂产量会随着浸润时间的延长而增加,但过长时间的增加相对与油脂得率增加是不值的,且油脂质量也会受到影响.
2.1.7 搅拌速率
合适的搅拌速率可以提高油脂产量,但也要同时考虑乳状液的形成会对油脂得率造成负面影响.搅拌有助于细胞壁的破坏、酶与底物的有效接触[7,40].搅拌速率为50、80 r/min 时,不能将辣木油很好地分离出来;当搅拌速率增加120 r/min,更大的油滴积累在表面易于分离[18].在花生油提取中,搅拌速率为80 r/min 时,具有较好的提取效果[35],在卡拉哈里柠檬籽油脂提取中,搅拌速率为100 r/min时,可获得较高的油脂得率[9].然而,高搅拌速率会增加能量消耗和经济成本[40],并导致难于分离的油水乳状液的形成[9,18,35,41].
2.1.8 水酶法提取过程中各参数的相关性
许多学者运用统计方法表明了水酶法提取过程中各参数的相关性[5,22].大豆油提取受酶种类、油料粒径、水料比和油料粒径、水料比的相互作用的影响.Hanmoungjai 等[42]指出酶的浓度对米糠油的提取有显著影响,浸润时间和温度对油脂产量无显著影响.水酶法参数对不同油料的显著性影响不同,如杨梅核[43]、卡拉哈里柠檬籽[9]、棕榈果[24]、花生[20]、松子[26].这些研究表明,对于给定的油脂原料,水酶法工艺参数对其显著性影响各不相同.
2.2 酶技术脱胶纯化植物油脂
脱胶(脱磷)是植物油精炼的一个重要工序,效果的好坏直接影响油脂品质.工业上传统的方法多为水化脱胶和酸法脱胶,需多次反复操作方可实现有效脱磷,操作繁琐,且后续需加入大量的碱进行脱酸;加工过程能耗较高,同时会产生大量废水、废液.酶法脱胶是一种新型脱胶方法,其原理是利用磷脂酶将非水合磷脂水解掉一个脂肪酸生成溶血性磷脂,溶血性磷脂亲水性好,可以方便地利用其溶于水的性质除去.
植物油脂酶法脱胶主要利用的是磷脂酶,根据磷脂酶与磷脂的作用位点的差异可以将其分为磷脂酶A1、磷脂酶A2、磷脂酶C 和磷脂酶D.段书平[44]以大豆毛油为原料,添加磷脂酶进行酶法脱胶,确定酶法脱胶工艺参数为:磷脂酶A1和磷脂酶C 混合酶用量45 mg/kg,pH 5,加水量2%,反应温度52 ℃,反应时间2 h.在此条件下,脱胶油磷含量可降至5 mg/kg,精炼成品油总磷含量可降至1.4 mg/kg,非水化磷脂去除率达到99.3%以上,精炼成品油得率可达97.3%.余榛榛等[45]对金黄色葡萄球菌磷脂酶C(PLC)基因在大肠杆菌(E.coil-BL21(DE3))中进行重组表达,利用发酵优化后的PLC 对大豆毛油进行脱胶处理,最终使大豆毛油中磷含量从266 mg/kg 降低至3.5 mg/kg.Jiang[46]等将磷脂酶A1和磷脂酶C 应用于8 种不同毛油脱胶,柠檬酸-PLC-PLA1 脱胶可有效地降低磷脂含量,并保持毛油的最大出油率,且特定酶促脱胶过程可根据不同的原油磷脂含量进行选择.对于非水合磷脂(NHPS)和初始磷脂含量低的油样品,无酸预处理磷脂酶A1脱胶是最有效的方法.对于NHPS 的含量低和初始磷脂含量高的油样品,用酸预处理、磷脂酶C 脱胶可满足物理精炼的要求.对于NHPS 含量高和初始磷脂含量低的油样品,用酸预处理、磷脂酶A1脱胶是最好的选择.
2.3 酶技术脱除油脂的黄曲霉毒素B1
黄曲霉毒素(aflatoxin,AF) 是由黄曲霉和寄生曲霉所产生的一种次生代谢物,具有急慢性毒性、致突变性、致癌性和致畸性,其中黄曲霉毒素B1(AFB1)毒性是氰化钾的10 倍,是砒霜的68 倍,被世界卫生组织(WHO)列为一级致癌物[47].AFB1污染常发生于花生、玉米、大米和饲料等储藏过程中,用这些原料制取的油脂,对人类健康造成极大危害.GB 2761—2011 标准规定:植物油脂(花生油、玉米油除外)10 μg/kg;花生油、玉米油20 μg/kg.如何对植物油料和油脂的黄曲霉毒素进行脱毒处理已逐渐成为食品安全学家所关注的重点.
酶解去毒技术是降低黄曲霉毒素的新技术.某些酶可将黄曲霉毒素转化为低毒或无毒物质,新产生的物质能随代谢排出体外,并有效降低对肝脏的损伤.胡常英等[48]研究发现用5‰ 25 U/g(25 U/mL)葡萄糖氧化酶完全可以解除饲料中体积分数5×10-7黄曲霉毒素B1的毒性.漆酶是一种含铜的多酚氧化酶,王会娟等[49]研究发现,790 μL 平菇粗酶液可以将1 000 ng 黄曲霉毒素B1降解到222.62 ng,降解率为77.74%,且平菇粗酶液降解黄曲霉毒素B1的能力与其中漆酶的含量呈一定的正相关.Arijit 等[50]研究得出,在平菇菌株酶降解黄曲霉毒素B1污染的稻草过程中,适当地添加某些金属盐和表面活性剂可以提高对真菌毒素的降解效果.
3 结语
我国植物油料资源持续短缺,自给率连年下降.油料产品的稳定生产和有效供给不仅满足人们对油脂消费增加的需要,同时也可增加植物蛋白质的供给量,促进植物油脂和植物蛋白质的供需平衡、保持社会经济健康发展、满足人们的营养需求.进而显著提升我国的油料和植物油的自给率.为了应对挑战,提高我国油脂工业的国际竞争力,我国油脂加工要注重科技创新,在生产加工中实现“ 规模化、集成化、自动化”水平的不断提升;同时,油脂加工应重点发展绿色安全、高效、优质、附加值高的产业,鼓励生产规模大、效益好的油脂加工企业在原料主产区建立生产基地,率先进行油脂加工技术革新,开发优质油料精深加工新技术,提高油料加工企业的经济效益和产品附加值,巩固国产油料消费市场,逐步打破跨国企业对我国食用油市场的垄断,从而扩大我国油料作物生产规模.对促进油料生产、保障植物油供给、维护国家粮食安全具有重要意义.
酶技术制油因为酶的高效专一性、反应条件温和、油脂提取效率高,安全、环保,可同时获得营养价值较高的蛋白质等特点,受到广泛关注.尽管目前酶技术提取植物油还存在一些技术瓶颈,如酶解时间较长、酶解后蛋白质的干燥成本较高[51]、酶解中酶的需要量较大(一般占油料质量的1%)、酶制剂的价格较高[34,51],但随着生物工程、固定化酶技术、食品加工设备制造业的不断发展,相信这些问题将会得到解决.
今后需要进一步研究的内容包括:详细研究油料结构组分,以有效指导酶技术制取植物油脂的生产实践;研究酶技术在油脂精炼和黄曲霉毒素脱除的理论,指导实际生产应用;研究开发高效廉价的酶制剂,增加工业化酶制剂的种类,降低酶制剂价格.通过这些系列研究使酶技术在植物油脂制取中实现高效制取油脂和蛋白质、绿色环保地进行油脂精炼,最终得到安全营养的油脂产品.
[1]FAS-USDA.Data[EB/OL].(2015-07-21).http://www.fas.usda.gov/data.asp.
[2]朱大沛,石铁铮.油脂制取工艺学[M].郑州:科学技术出版社,1991.
[3]吴祥庭.酶法提油技术的研究进展[J].粮油食品科技,2006,14(6):41-42.
[4]Passos C P,Yilmaz S,Silva C M,et al.Enhancement of grape seed oil extraction using a cell wall degrading enzyme cocktail [J].Food Chemistry,2009,115(1):48-53.
[5]Rosenthal A,Pyle D L,Niranjan K,et al.Combined effect of operational variables and enzyme activity on aqueous enzymatic extraction of oil and protein from soybean[J].Enzyme and Microbial Technology,2001,28(6):499-509.
[6]Jung S,Maurer D,Johnson L A.Factors affecting emulsion stability and quality of oil recovered from enzyme assisted aqueous extraction of soybeans [J].Bioresource Technology,2009,100(21):5340-5347.
[7]Sineiro J,Dominguez H,Nunez M J,et al.Microstructural features of enzymatically treated oilseeds [J].Journal of the Science of Food and Agriculture,1998,78(4):491-497.
[8]Gros C,Lanoiselle J L,Vorobiev E.Towards an alternative extraction process for linseed oil[J].Transactions of the Institution of Chemical Engineers,2003,81(A9):1059-1065.
[9]Nyam K L,Tan C P,Lai O M,et al.Enzymeassisted aqueous extraction of Kalahari melon seed oil:optimization using response surface methodology [J].Journal of the American Oil Chemists’ Society,2009,86(12):1235-1240.
[10]Santos R D,Ferrari R A.Extracao aquosa enzimatica deoleo de soja[J].Cienciay Tecnologia Alimentaria,2005,25(1):132-138.
[11]Lamsal B P,Murphy P A,Johnson L A.Flaking and extrusion as mechanical treatments for enzyme-assisted aqueous extraction of oil from soybeans [J].Journal of the American Oil Chemists’ Society,2006,83(11):973-979.
[12]Zhang S B,Wang Z,Xu S Y.Optimization of the aqueous enzymatic extraction of rapeseed oil and protein hydrolysates[J].Journal of the American Oil Chemists′Society,2007,84(1):97-105.
[13]Rovaris A A,Dias C O,da Cunha I P,et al.Chemical composition of solid waste and effect of enzymatic oil extraction on the microstru -cture of soybean(Glycine max)[J].Industrial Crops and Products,2012,36(1):405-414.
[14]Tabtabaei S,Diosady L L.Aqueous and enzymatic extraction processes for the production of food -grade proteins and industrial oil from dehulled yellow mustard flour [J].Food Research International,2013,52(2):547-556.
[15]Latif S,Anwar F.Aqueous enzymatic sesame oil and protein extraction [J].Food Chemistry,2011,125(2):679-684.
[16]Latif S,Anwar F,Hussain A I,et al.Aqueous enzymatic process for oil and protein extraction from Moringa oleifera seed [J].European Journal of Lipid Science and Technology,2011,113(8):1012-1018.
[17]Latif S,Anwar F.Effect of aqueous enzymatic processes on sunflower oil quality[J].Journal of the American Oil Chemists′Society,2009,86(4):1663-1667.
[18]Abdulkarim S M,Lai O M,Muhammad S K S,et al.Use of enzymes to enhance oil recovery during aqueous extraction of Moringa oleifera seed oil[J].Journal of Food Lipids,2006,13(2):113-130.
[19]Long J J,Fu Y J,Zu Y G,et al.Ultrasoundassisted extraction of flaxseed oil using immobilized enzymes[J].Bioresource Technology,2011,102(21):9991-9996.
[20]Jiang L,Hua D,Wang Z,et al.Aqueous enzymatic extraction of peanut oil and protein hydrolysates [J].Foods and Bioproducts Processing,2010,88(2-3):233-238.
[21]王章存,康艳玲,刘改英,等.低温预榨-水酶法制取花生油和蛋白的研究[J].食品工业科技,2008,29(1):216-218.
[22]Masni M Y,Michael H G,Keshavan N.Aqueous enzyme assisted oil extraction from oilseeds and emulsion de-emulsifying methods:A review[J].Trends in Food Science &Technology,2015,41(1):61-82.
[23]Dominguez H,Sineiro J,Nunez M J,et al.Enzymatic treatment of sunflower kernels before oil extraction [J].Food Research International,1996,28(6):537-545.
[24]Teixeira C B,Macedo G A,Macedo J A,et al.Simultaneous extraction of oil and antioxidant compounds from oil palm fruit(Elaeis guineensis)by an aqueous enzymatic process[J].Bioresource Technology,2013,129:575-581.
[25]Zuniga M E,Soto C,Mora A,et al.Enzymic pretreatment of Guevina avellana mol oil extraction by pressing[J].Process Biochemistry,2003,39(1):51-57.
[26]Yang L,Jiang L,Sui X,et al.Optimization of the aqueous enzymatic extraction of pine kernel oil by response surface methodology[J].Procedia Engineering,2011,15:4641-4652.
[27]Soto C,Chamy R,Z_uniga M E.Enzymatic hydrolysis and pressing conditions effect on borage oil extraction by cold pressing[J].Food Chemistry,2007,102(3):834-840.
[28]刘春雷,李丹,王腾宇,等.响应面优化水酶法提取米糠油工艺的研究[J].食品工业,2011,12:46-49.
[29]Abdulkarim S M,Long K,Lai O M,et al.Some physico-chemical properties of Moringa oleifera seed oil extracted using solvent and aqueous enzymatic methods [J].Food Chemistry,2005,93(2):253-263.
[30]Sineiro J,Dominguez H,Nunez M J,et al.Optimization of the enzymatic treatment during aqueous oil extraction from sunflower seeds[J].Food Chemistry,1998,61(4):467-474.
[31]Wu J,Johnson L A,Jung S.Demulsification of oil -rich emulsion from enzyme -assisted aqueous extraction of extruded soybean flakes[J].Bioresource Technology,2009,100(2):527-533.
[32]Rosenthal A,Pyle D L,Niranjan K.Aqueous and enzymatic processes for edible oil extraction[J].Enzyme and Microbial Technology,1996,19(6):402-420.
[33]林莉,秦礼康,刘荣林,等.响应面法优化水酶法提取薏米糠油工艺研究[J].中国油脂,2015,40(4):1-5.
[34]Rui H,Zhang L,Li Z,et al.Extraction and characteristics of seed kernel oil from white pitaya[J].Journal of Food Engineering,2009,93(4):482-486.
[35]Sharma A,Khare S K,Gupta M N.Enzymeassisted aqueous extraction of peanut oil[J].Journal of the American Oil Chemists′Society,2002,79(3):215-218.
[36]Aliakbarian B,Faveri D D,Converti A,et al.Optimisation of olive oil extraction by means of enzyme processing aids using response surface methodology [J].Biochemical Engineering Journal,2008,42(1):34-40.
[37]De Faveri D,Aliakbarian B,Avogadro M,et al.Improvement of olive oil phenolics content by means of enzyme formulations:effect of different enzyme activities and levels [J].Biochemical Engineering Journal,2008,41(2):149-156.
[38]Garcıa A,Brenes M,Moyano M J,et al.Improvement of phenolic compound content in virgin olive oils by using enzymes during malaxation[J].Journal of Food Engineering,2001,48(3):189-194.
[39]Ranalli A,Malfatti A,Pollastri L,et al.Analytical quality and genuineness of enzyme -extracted virgin olive oil [J].Journal of Food Quality,2003,26(2):149-164.
[40]Rosenthal A,Pyle D L,Niranjan K.Simultaneous aqueous extraction of oil and protein from soybean:mechanisms for process design[J].Food and Bioproducts Processing,1998,76(4):224-230.
[41]Hanmoungjai P,Pyle D L,Niranjan K.Extraction of rice bran oil using aqueous media[J].Journal of Chemical Technology and Biotechnology,2000,75(5):348-352.
[42]Hanmoungjai P,Pyle D L,Niranjan K.Enzymatic process for extracting oil and protein from rice bran [J].Journal of the American Oil Chemists′Society,2001,78(8):817-821.
[43]Zhang Y L,Li S,Yin C P,et al.Response surface optimisation of aqueous enzymatic oil extraction from bayberry(Myrica rubra)kernels[J].Food Chemistry,2012,135(1):304-308.
[44]段书平.大豆油酶法脱胶的生产应用[J].中国油脂,2013,38(8):11-13.
[45]余榛榛,芮丽莲,梁丽,等.金黄色葡萄球菌磷脂酶C 克隆表达及其脱胶应用[J].粮食与油脂,2014,27(4):10-14.
[46]Jiang Xiaofei,Chang Ming,Jin Qingzhe.Application of phospholipase A1 and phospholipase C in the degumming process of different kinds of crude oils [J].Process Biochemistry,2015,50(3):432-437.
[47]李建辉.花生中黄曲霉毒素的影响因子及脱毒技术研究[D].北京:中国农业科学院,2009.
[48]胡常英,王云鹏,范星,等.葡萄糖氧化酶解除黄曲霉毒素B1 应用研究[J].生物学杂志,2014,31(2):55-57.
[49]王会娟,刘阳,邢福国.高产漆酶平菇的筛选及其在降解黄曲霉毒素B1 中的应用[J].核农学报,2012,26(7):1025-1030.
[50]Arijit Das,Sourav Bhattacharya,Muthusamy Palaniswamy,et al.Biodegradation of aflatoxin B1 in contaminated rice straw by Pleurotus ostreatus MTCC 142 and Pleurotus ostreatus GHBBF10 in the presence of metal salts and surfactants[J].World Journal of Microbiology and Biotechnology,2014,30:2315-2324.
[51]Shah S,Sharma A,Gupta M N.Extraction of oil from Jatropha curcas L.seed kernels by combination of ultrasonication and aqueous enzymatic oil extraction[J].Bioresource Technology,2005,96(1):121-123.
