玉米胚芽油中酯态甾醇和游离态甾醇的分析方法研究
2015-04-23郑淑敏马传国梁少华计晓曼
郑淑敏,马传国,2*,梁少华,计晓曼
(河南工业大学1.粮油食品学院;2.小麦和玉米深加工国家工程实验室,河南 郑州 450001)
0 引言
植物甾醇具有降低血清低密度脂蛋白(LDL)的重要生理功能,还具有抗氧化、抗炎、抗癌和抗菌等功效[1-2],但它更多是以4 种类型的衍生态存在于植物油中:甾醇脂肪酸酯(SE)、对羟基肉桂酸(对香豆酸)甾醇酯(HSE)、甾基糖苷(SG)和酰化甾基糖苷(ASG),其中以SE 居多[3].游离态甾醇和酯态甾醇有不同的生理功能性质和物理性质,但酯态甾醇有更多的优势:连续8 周每天摄入9 g 甾醇酯也不会有副反应;植物甾醇酯对降低心血管疾病效果更显著,有研究表明,每天摄入2.5 g 植物甾醇酯是等量植物甾醇效果的2 倍[4];酯态甾醇更易溶解在油水混合物中,它可以用作乳化剂,显著提高分散特性[5],还可以加入到食物中,尤其是基于润湿性和易于融化的饮料和牛奶产品,使其有更好的感官品质并提高食品的稳定性[6].所以将植物甾醇酯更多地保留在植物油中是现代精炼工艺的需求,随之而来的甾醇酯的检测方法也在发展之中.
国外对于甾醇酯分离分析方法有很多,最常用的有气相色谱和高效液相法.早在1984 年,Worthington 等[7]采用薄层色谱(TLC)、气-液色谱(GLC)联合分析测定植物油中的甾醇酯、游离甾醇:先用制备液相色谱分离碳氢化合物、甾醇酯、游离甾醇,此时碳氢化合物与甾醇酯一起被溶剂洗脱下来,然后利用薄层色谱把甾醇酯与碳氢化合物分开,甾醇酯进行甲酯化,最后用气-液色谱检测.Ferrari 等[8]用柱层析法进行甾醇酯与游离甾醇的分离,最后用高效液相(HPLC)分析.Vasile 等[3]用固液萃取方法分离游离甾醇和甾醇酯,并加入一定的内标,气相色谱进行定量分析.
作者通过柱层析的方法来分离玉米胚芽毛油中游离甾醇和甾醇酯,并采用内标法分别计算样品中酯态甾醇和游离态甾醇的含量,且二者的含量分别为几种单一去甲基甾醇含量之和.主要包含3个步骤:(1)硅胶柱的制备;(2)酯态甾醇和游离态甾醇的分离;(3)通过气相色谱方法对酯态甾醇和游离态甾醇分别进行定量测定.
1 材料和方法
1.1 试剂与设备
玉米胚芽毛油:山东三星集团;柱层析硅胶200~300 目、胆甾烷醇(纯度≥95%):美国sigma 公司;胆固醇硬脂酸酯(纯度≥97%):日本梯希爱公司;β-谷甾醇亚油酸酯(纯度≥80%):实验室合成;β-谷甾醇标准品(纯度≥80%):西安蓝天生物工程有限责任公司;N,O-双三甲基硅基三氟乙酰胺(BSTFA)+1%三甲基氯硅烷(TMCS):Fluka 公司;亚油酸(≥95%):阿拉丁化学试剂有限公司.
玻璃柱层析(内径1.9 cm,长30 cm,配有聚四氟乙烯旋塞);GC-7890A 气相色谱仪、HPLC-1260 infinity 高效液相色谱仪:美国安捷伦科技有限公司;RE52AA 旋转蒸发仪:上海亚荣生化仪器厂.
1.2 标准品β-谷甾醇亚油酸酯的制备
1.2.1 β-谷甾醇亚油酸酯合成与分离纯化
由于植物甾醇酯的标准品较难买到,且玉米胚芽毛油中甾醇酯的主要类型是β-谷甾醇亚油酸酯[9-10],参照孟祥河等[11]的研究,采用化学法制备甾醇酯,此反应是无溶剂体系,亚油酸同时作为反应原料和反应溶剂:在装有油水分离器、温度计、磁力搅拌子的三口烧瓶中,加入事先干燥过夜的β-谷甾醇与亚油酸(其摩尔比为2∶1),加热到适当温度形成熔融体系后再加入混合催化剂(氧化钙、氧化镁、氧化镧摩尔比为3∶2∶5),冲入N2,油浴加热并搅拌,170 ℃下恒温反应8 h,得到β-谷甾醇亚油酸酯粗产品.
粗产品的分离纯化采用硅胶柱层析分离[12]:称取反应混合物约5 g,溶解在5 mL 的石油醚中,装入高度为25 cm 硅胶柱中,立即加入流动相:V石油醚∶V乙醚∶V乙酸=90∶10∶1,收集洗脱液,用TLC 检测产物,收集含有甾醇酯的试管溶液,旋转蒸发,得到澄清、透明淡黄色的半流动的β-谷甾醇亚油酸酯纯品.
1.2.2 高效液相法测定β-谷甾醇亚油酸酯的纯度
参照张丽霞等[13]的色谱条件:色谱柱ZORAX RX-SIL 4.6 mm×250 mm,5 μm,流动相:V正己烷∶V乙酸乙酯∶V甲酸=90∶10∶0.5,进样量10 μL,流速:1.0 mL/min,柱温:25 ℃,蒸发光散射检测器(ELSD),漂移管温度65 ℃,气体流速是1.6 SLPM.配制浓度为1 mg/mL 的β-谷甾醇亚油酸酯溶液,经0.45 μm 微孔滤膜过滤后直接进行高效液相色谱测定.根据面积归一化法得到的产品纯度是89.68%.
1.3 试验方法
1.3.1 玉米胚芽油中酯态甾醇和游离态甾醇的分析方法的前处理
玉米胚芽油中酯态甾醇和游离态甾醇的分离:参照Verleyen 等[14]的研究,利用游离甾醇和甾醇酯的极性不同将它们分离,总共分为两步:(1)柱层析的制备:称取15 g 硅胶溶解在50 mL 的正己烷中,进行装柱.(2)称取玉米胚芽毛油1.5 g(精确至0.000 1 g)于小烧杯中,用5 mL 正己烷转移,并加入一定量的胆固醇硬脂酸酯和胆甾烷醇标准品,装入硅胶柱.采用梯度洗脱:加入85 mL正己烷/乙酸乙酯(体积比为90∶10),用TLC 检测产物,收集酯态甾醇部分,之后立即加入85 mL 正己烷/乙醚/无水乙醇(体 积比为25∶25∶50),用TLC检测产物,收集游离态甾醇,最后利用旋蒸去除溶剂,分别得到了两种组分,即酯态甾醇和游离态甾醇.
两种组分的皂化、提纯、衍生化:酯态甾醇和游离态甾醇分别加入2 mol/L 氢氧化钾乙醇溶液进行皂化,用乙醚提取不皂化物,水洗至中性,旋蒸溶剂;0.4 mL 氯仿复溶点板,展开剂为正己烷∶乙醚(体积比为65∶35 ),刮出甾醇带,并用乙醚萃取;加入100 μL 99% BSTFA+1%TMCS 硅烷化试剂水浴70 ℃衍生化40 min,氮气吹干;1 mL 正己烷定容并用无水硫酸钠干燥,吸取上清液进气相(GC)分析.
1.3.2 玉米胚芽油中酯态甾醇和游离态甾醇的气相分析
按照魏佳丽等[15]的测总甾醇含量的气相色谱条件:色谱柱:HP-5(30.0 m×250 μm×0.25 μm),进样口温度300 ℃;载气:高纯氮气;分流比:20∶1;柱流速:1.0 mL/min;柱温:285 ℃(20 min);检测器温度360 ℃;进样量1 μL.
采用内标法计算每种甾醇的含量,即加入的内标定量两部分的单个甾醇含量,其中胆固醇硬脂酸酯作为酯态甾醇的内标,且酯态甾醇总含量为单个酯态甾醇(皂化之后变成游离态)含量之和;胆甾烷醇作为游离甾醇的内标,游离态甾醇总含量为单个游离态甾醇之和,总甾醇含量是两态甾醇之和.各个单个甾醇组分的标准曲线方程见表1.同时对检测方法的重复性、加标回收率、精密度、稳定性进行分析.

表1 单个甾醇组分的标准曲线方程Table 1 The standard curve of individual sterol components
2 结果与讨论
2.1 玉米胚芽油中酯态甾醇和游离态甾醇的分离
分析方法是基于游离甾醇和甾醇酯的极性不同.游离甾醇用非极性溶剂洗脱时在硅胶柱上保留较长时间,因为游离甾醇比酯态甾醇有更强的极性.最重要的是一个适当的溶剂比是为能把所有的甾醇酯洗脱出来而把游离甾醇继续保留在硅胶柱中.第一步,用不同的非极性溶剂进行洗脱,非极性溶剂主要为正己烷,通过添加少量的乙酸乙酯调节极性.只有当正己烷/乙酸乙酯的体积比是90∶10 时所有的酯态甾醇在第一组分中分离下来并能和第二组分的游离态甾醇很好地分开.第二步,硅胶柱用极性溶剂保留游离甾醇,游离态甾醇在第二步洗脱时用正己烷/乙醚/无水乙醇(体积比为25∶25∶50)极性溶剂洗脱.以玉米胚芽毛油为例,所收集的二者的组分与β-谷甾醇和胆固醇硬脂酸酯标准品对照,薄层板对照如图1 所示.
由图1 可知,第一组分D 主要含有甾醇酯和甘三酯,且不含游离甾醇.第二组分E 主要含有游离甾醇和少量甘三酯,且不含甾醇酯,为了验证游离甾醇和甾醇酯分离完全,将D 组分和E 组分分别处理后进气相分析,二者的气相色谱如图2 所示.

图1 玉米胚芽毛油中游离甾醇和甾醇酯分离效果Fig.1 The separation effect of esterified and free sterols in the crude corn germ oil

图2 酯态甾醇A 和游离态甾醇B 经过皂化、提取不皂化物、衍生化后所得的GC 色谱图Fig.2 The GC analysis of esterified sterols A and free sterols B after saponified,extracted,and derivatized
由图2 可知:胆固醇硬脂酸酯经过皂化处理后变成胆固醇,出峰时间在9.1 min 左右(比对胆固醇标准品),且完全在A 图出峰,在B 图没有出峰;同样,胆甾烷醇只在B 图中完全出峰,没有在A 图出峰,因此,认为两态甾醇分离完全.这些数据表明了用最小溶剂在硅胶柱上用正己烷/乙酸乙酯(体积比为90∶10)和正己烷/乙醚/无水乙醇(体积比为25∶25∶50)能够分开酯态甾醇和游离态甾醇.而且,洗脱第一组分溶剂的极性是很重要的.所以采用正己烷/乙酸乙酯体积比是90∶10 时,正己烷/乙醚/无水乙醇体积比是25∶25∶50,能实现玉米胚芽毛油中酯态甾醇和游离态甾醇的分离.
2.2 检测方法的分析
2.2.1 重复率的测定
以玉米水化脱胶油作为油样,取7 组进行重复性测定,酯态甾醇和游离态甾醇重复性试验如表2和表3 所示.
从表2 和表3 可以看出,总酯态甾醇和总游离态甾醇以及单一去甲基甾醇含量的相对标准偏差(RSD)在1.28%~2.25%之间.相对标准偏差总体不大,重复性较好.

表2 玉米水化脱胶油中酯态甾醇重复性试验结果Table 2 The repeatability results of esterified sterols in the degumming corn oil mg·(100 g)-1

表3 玉米水化脱胶油中游离态甾醇重复性试验结果Table 3 The repeatability results of free sterols in the degumming corn oil mg·(100 g)-1
2.2.2 加标回收率的测定
加标回收率的测定采用1.2.2 的气相色谱法,并添加一定量的实验室自制β-谷甾醇亚油酸酯标准品和β-谷甾醇标准品,结果见表4 和表5.

表4 酯态甾醇的加标回收率Table 4 The recovery rate of esterified sterols with internal standard

表5 游离态甾醇的加标回收率Table 5 The recovery rate of free sterols in the degumming corn oil
由表4 和表5 可知,利用柱层析方法分离玉米胚芽毛油中的酯态甾醇和游离态甾醇并用气相色谱法测得二者的回收率分别是90.71%、94.73%,回收率较高,该方法可行.
2.2.3 精密度的测定
以玉米水化脱胶油作为油样,测定采用1.2.2的气相色谱法,连续测定7 次,其中单一去甲基甾醇(包含酯态和游离态)和两态甾醇总含量的RSD见表6 和表7.

表6 玉米水化脱胶油中酯态甾醇精密度试验结果Table 6 The precision results of esterified sterols in the degumming corn oil mg·(100 g)-1

表7 玉米水化脱胶油中游离态甾醇精密度试验结果Table 7 The precision results of free sterols in the degumming corn oil mg·(100 g)-1
从表6 和表7 可以看出,单一去甲基甾醇(包含酯态和游离态)以及两态甾醇总含量的RSD 在0.72%~2.25%之间,表明该试验所用气相色谱仪精密度良好.
2.2.4 稳定性的测定
以玉米胚芽毛油为油样,测定采用1.2.2 的气相色谱法,连续3 d 每天重复测定3 次,来评价其日间稳定性,其中单一去甲基甾醇(包含酯态和游离态)和两态甾醇总含量的RSD 见表8 和表9.
从表8 和表9 可知,样品在等待进样期间,浓度变化不是特别大,单一去甲基甾醇和两态甾醇总含量的RSD 在0.63%~3.22%之间,表明该方法稳定性良好.
3 结论
利用柱层析法能实现玉米胚芽毛油中酯态甾醇与游离态甾醇的分离,酯态甾醇和游离态甾醇分别用正己烷/乙酸乙酯(体积比为90∶10)和正己烷/乙醚/无水乙醇(体积比为25∶25∶50)洗脱,之后将这两种组分分别进行皂化、提纯、衍生化并利用气相色谱法定量,该方法中酯态甾醇和游离态甾醇的相对标准偏差分别为1.32%、1.46%;并加入实验室自制β-谷甾醇亚油酸酯作为酯态甾醇标准品,回收率分别为90.71%、94.73%;精密度试验中样品连续测定7 次得到单一去甲基甾醇(包含酯态和游离态)以及两态甾醇总含量的RSD 在0.72%~2.25%之间;稳定性试验中连续3 d 每天重复测定3 次,得到样品在等待进样期间,浓度变化不是特别大,单一去甲基甾醇(包含酯态和游离态)和两态甾醇总含量的RSD 在0.63%~3.22%之间,总之该方法精密度高、稳定性好,能用于玉米胚芽油中酯态甾醇和游离态甾醇的分离以及含量的测定.

表8 玉米胚芽毛油中酯态甾醇稳定性试验结果Table 8 The stability results of the esterified sterols in the crude corn germ oil mg·(100 g)-1
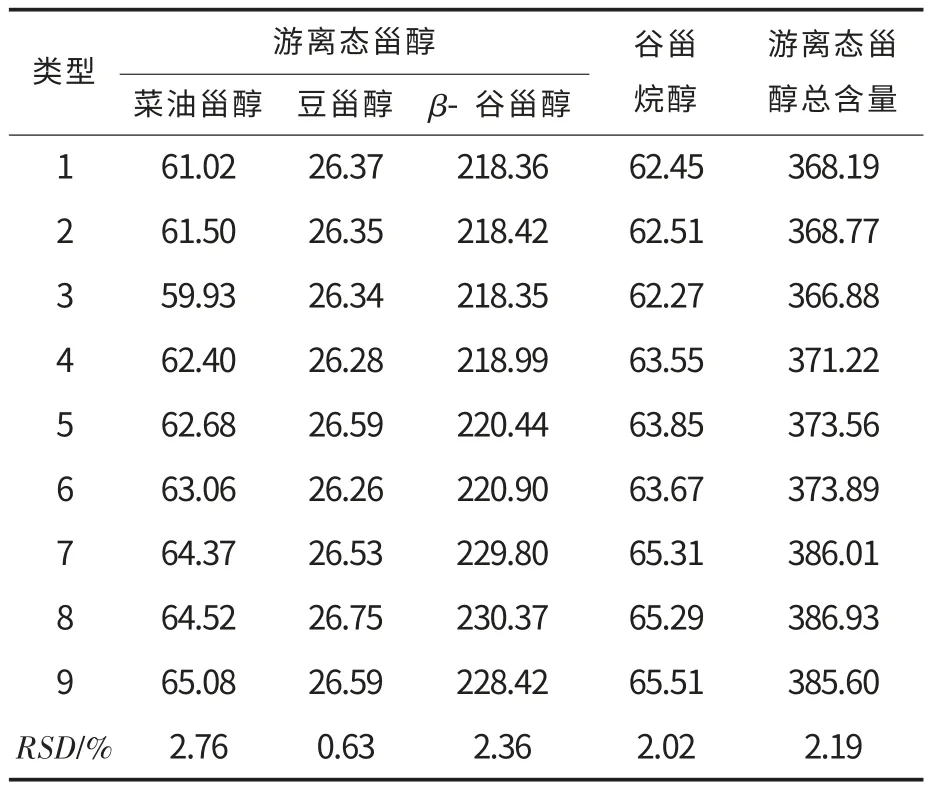
表9 玉米胚芽毛油中游离态甾醇稳定性试验结果Table 9 The stability results of the free sterols in the crude corn germ oil mg·(100 g)-1
[1]韩军花.植物甾醇的性质、功能及应用[J].国外医学:卫生学分册,2001,28(5):285-291.
[2]Ntanios F Y,Van De Kooij A J,De Deckere E A,et al.Effects of various amounts of dietary plant sterol esters on plasma and hepatic sterol concentration and aortic foam cell formation of cholesterolfed hamsters[J].Atherosclerosis,2003,169(1):41-50.
[3]Dulf F V,Unguresan M L,Vodnar D C,et al.Free and esterified sterol distribution in four Romanian vegetable oil[J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2010,38(2):91-97.
[4]Moreau R A,Whitaker B D,Hicks K B.Phytosterols,phytostanols,and their conjugates in foods:structural diversity,quantitative analysis,and health -promoting uses[J].Progress in Lipid Research,2002,41(6):457-500.
[5]Phillips K M,Ruggio D M,Toivo J I,et al.Free and esterified sterol composition of edible oils and fats[J].Journal of Food Composition and Analysis,2002,15(2):123-142.
[6]Peter Horlacher,Dieter Hietsch,Wolfgang,et al.Sterol esters having short-chained fatty acids:DE,WO2007101580 A2[P].2007-09-13.
[7]Worthington R,Hitchcock H.A method for the separation of seed oil steryl esters and free sterols:application to peanut and corn oils[J].Journal of the American Oil Chemists Society,1984,61(6):1085-1088.
[8]Ferrari R A,Esteves W,Mukherjee K D,et al.Alteration of sterols and steryl esters in vegetable oils during industrial refining[J].Journal of Agricultural and Food Chemistry,1997,45(12):4753-4757.
[9]Esche R,Scholz B,Engel K H.Analysis of free phytosterols/stanols and their intact fatty acid and phenolic acid esters in various corn cultivars [J].Journal of Cereal Science,2013,58(2):333-340.
[10]Esche R,Barnsteiner A,Scholz B,et al.Simultaneous analysis of free phytosterols/phytostanols and intact phytosteryl/phytostanyl fatty acid and phenolic acid esters in cereals[J].Journal of Agricultural and Food Chemistry,2012,60(21):5330-5339.
[11]孟祥河,潘秋月,邵平,等.一种植物甾醇酯的制备方法:中国,101235067A[P].2008-08-06.
[12]Qianchun D,Pin Z,Qingde H,et al.Chemical synthesis of phytosterol esters of polyunsaturated fatty acids with ideal oxidative stability[J].European Journal of Lipid Science and Technology,2011,113(4):441-449.
[13]张丽霞,毕艳兰,张康逸.植物甾醇与甾醇酯的分离分析方法研究[J].粮油加工与食品机械,2006(2):53-55.
[14]Verleyen T,Sosinska U,Ioannidou S,et al.Influence of the vegetable oil refining process on free and esterified sterols[J].Journal of the American Oil Chemists’Society,2002,79(10):947-953.
[15]魏佳丽,马传国,柴小超,等.米糠毛油中去甲基甾醇检测方法的对比研究[J].中国油脂,2014,39(1):61-64.
