长效硝酸酯对心力衰竭大鼠肺α1、β肾上腺素受体各亚型表达水平的影响
2015-04-21陈萌萌李艳芳彭余波蒋志丽宋俊迎
陈萌萌,李艳芳*,彭余波,蒋志丽,宋俊迎
长效硝酸酯对心力衰竭大鼠肺α1、β肾上腺素受体各亚型表达水平的影响
陈萌萌1,2,李艳芳1,2*,彭余波1,2,蒋志丽1,2,宋俊迎1,2
(1首都医科大学附属北京安贞医院:急诊35病房,北京 100029;2北京市心肺血管疾病研究所,北京 100029)
探讨长效硝酸酯对心肌梗死后心力衰竭大鼠心功能和肺α1、β肾上腺素受体(AR)各亚型表达水平的影响。选用雄性Wistar大鼠90只,分为正常对照组(N组,=9)、假手术组(SH组,=8),其余73只大鼠结扎左冠状动脉前降支制作心肌梗死后心力衰竭模型,成功44只,分为心力衰竭模型组(HF组,=9)、硝酸酯小剂量组(LN组,=9)、硝酸酯大剂量组(HN组,=9)、阳性药物对照组(奥美沙坦酯,OL组,=9)及硝酸酯大剂量联合阳性药物组(HN+OL组,=8),灌胃法给药6周。超声心动图检测用药前后心功能,逆转录−聚合酶链反应(RT-PCR)和免疫印迹法(Western blot)检测各组肺β1-AR、β2-AR、β3-AR、α1A-AR、α1B-AR及α1D-AR的表达水平。用药后,与HF组比较,HN组、OL组及HN+OL组左室射血分数(LVEF)显著升高(<0.05)。与SH组相比,HF组β1-AR和β3-AR表达水平明显下降(<0.05),α1A-AR、α1B-AR和β2-AR表达水平明显升高(<0.05);与HF组相比,HN组、OL组和HN+OL组β1-AR、β3-AR表达水平明显升高(<0.05),α1A-AR、α1B-AR及β2-AR表达水平明显降低(<0.05)。与OL组相比,HN+OL组各受体表达水平差异更显著(<0.05)。各组大鼠α1D-AR表达水平间差异无统计学意义(>0.05)。应用长效硝酸酯药物可显著提高心肌梗死后心力衰竭大鼠LVEF,使心力衰竭大鼠肺α1、β-AR各亚型表达水平反向调节趋于正常,对保护肺功能起到了有益的治疗作用。
大鼠;硝酸酯;心力衰竭;肺;肾上腺素能受体;亚型
慢性心力衰竭(chronic heart failure,CHF)是各类心血管疾病的临床终末阶段,严重影响患者的生活质量和生存率。CHF时神经体液系统被激活,主要包括交感神经系统(sympathetic nervous system,SNS)和肾素−血管紧张素−醛固酮系统(renin- angiotensin-aldosterone system,RAAS)的激活。除血循环中神经体液系统的活性升高外,心力衰竭肺局部SNS和RAAS也被激活,严重损害肺功能。硝酸酯类主要是通过扩张外周血管以改善血流动力学、扩张冠状动脉以增加缺血心肌氧供来增加心排出量,改善CHF心功能,并减轻肺循环淤血,但其是否还能影响SNS激活以及肺α1−、β−肾上腺素受体(adrenergic receptor, AR)各亚型的表达报道甚少。为此,本研究选用心肌梗死后心力衰竭大鼠模型和5−单硝酸异山梨酯(ISMN)缓释制剂,观察长效硝酸酯类对CHF心功能和肺α1、β−AR各亚型表达水平的影响。
1 材料与方法
1.1 实验动物
清洁级近交系Wistar大鼠,雄性,10周龄,体质量250~280g(北京维通利华实验动物技术有限公司,许可证号:SCXK-2012-0001),由首都医科大学附属北京安贞医院清洁级动物房提供饲养和观察场地。实验期间以标准鼠饲料喂养,自由摄食、饮水,动物房温度维持在(22±3)℃,相对湿度为(50±20)%,12h光照/12h无光照。
1.2 药物、试剂及主要仪器
单硝酸异山梨酯缓释胶囊(isosorbide mononitrate sustained-release capsules,异乐定,ISMN,50mg/胶囊剂,珠海许瓦兹制药有限公司);奥美沙坦酯片(olmesartan medoxomil tablets,傲坦,20mg/片,日本第一三共制药上海有限公司);兔抗大鼠β1-AR、β2-AR、β3-AR、α1A-AR、α1B-AR、α1D-AR及3−磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(美国Santa Cruz Biotechnology公司);荧光二抗羊抗兔IgG,Odyssey双色红外激光成像系统(美国Licor公司);β1-AR、β2-AR、β3-AR、α1A-AR、α1B-AR、α1D-AR引物(由北京三博远志生物技术有限公司合成);逆转录试剂盒A3500(美国Promega公司);PCR仪(美国Bio-Rad公司)。
1.3 大鼠心肌梗死后心力衰竭模型制作及分组
90只Wistar大鼠,分为正常对照组(N组,9只)、假手术组(SH组,8只,开胸后在左冠状动脉前降支下方只穿线不结扎),其余73只大鼠通过结扎左冠状动脉前降支造成心肌梗死,4周后行超声心动图检测示左室射血分数(left ventricular ejection fraction,LVEF)≤45%为心力衰竭模型制作成功[1]。心力衰竭模型成功44只(成功率60.3%),随机分为5组:心力衰竭模型组(heart failure,HF组,9只,0.9%氯化钠溶液2ml灌胃)、ISMN小剂量组(low-dose nitrate,LN组,9只,ISMN3.6mg/kg溶于2ml 0.9%氯化钠溶液灌胃)、ISMN大剂量组(high-dose nitrate,HN组,9只,ISMN7.2mg/kg溶于2ml 0.9%氯化钠溶液灌胃),阳性药物对照组(olmesartan,OL组,9只,奥美沙坦3mg/kg溶于2ml 0.9%氯化钠溶液灌胃),ISMN大剂量联合奥美沙坦组(high-dose nitrate+olmesartan,HN+OL组,8只,ISMN按7.2mg/kg、奥美沙坦按3mg/kg溶于2ml 0.9%氯化钠溶液灌胃),ISMN的给药剂量按动物与人体表面积换算成等效剂量,3.6mg/kg为小剂量,7.2mg/kg为大剂量。每组均为1次/d灌胃,持续6周。
1.4 超声心动评价左心室心功能
用药前(术后4周)及用药6周后分别进行超声心动图检测大鼠左室心功能。取胸骨旁左室长轴及短轴切面进行测量,测量参数包括左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD),左室收缩末期内径(left ventricular end-systolic dimension,LVESD),LVEF,每项指标均测量3个连续完整心动周期,结果取平均值。
1.5 肺组织提取
大鼠以1%戊巴比妥钠30mg/kg腹腔注射麻醉,剖开胸腔暴露肺,剪取数块肺组织,迅速置液氮中冻存,后转移至-80℃冰箱保存待测。
1.6 半定量逆转录−聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)测定
Trizol试剂提取肺组织总RNA,取5μg总RNA行逆转录,RT-PCR扩增,扩增条件为94℃5min,94℃45s,53℃~62℃45s,72℃45s,共28~35个循环,最后72℃延伸10min(各受体引物序列及退火温度详见表1),每个样本重复3遍,分别检测肺组织α1、β-AR各亚型在mRNA水平的表达,选用管家基因GAPDH作为内参照。PCR产物经1.5%琼脂糖凝胶电泳分离,紫外灯下照相,结果用Quantity one软件分析,得出与内参GAPDH的比值,进行分析。
1.7 Western印迹法检测
常规提取肺组织蛋白,BCA蛋白浓度测定试剂盒进行蛋白定量。经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜,5%脱脂奶粉封闭,加入一抗抗体,4℃过夜;PBST冲洗3次,再加入荧光二抗,室温孵育2h,PBST冲洗3次。Odyssey双色红外激光成像系统对膜进行扫描成像,计算各个条带的灰度值。用Quantity one软件对图像进行吸光度分析,以目的条带与内参照条带信号强度的比值代表组织中目的受体的表达水平。
1.8 统计学处理
采用SPSS17.0统计软件进行统计学分析。计量资料以均数±标准差表示,多组间均数比较采用单因素方差分析,两两比较采用检验(Newman-Keuls test)。以<0.05为差异有统计学意义。
2 结 果
2.1 用药前后超声心动图结果
用药前,N组和SH组LVEF、LVEDD及LVESD组间差异无统计学意义(>0.05);与SH组相比,HF组、LN组、HN组、OL组及HN+OL组大鼠LVEF明显降低(<0.01),LVEDD和LVESD均明显增加(<0.01),但5组之间差异无统计学意义(>0.05)。用药后,与HF组相比,LN组LVEF有所增加,LVEDD、LVESD有所降低,但两者之间差异无统计学意义(>0.05),HN组、OL组和HN+OL组LVEF显著升高(<0.05),LVESD显著降低(<0.05),HN+OL组LVEDD显著降低(<0.05);OL组LVEF较HN组进一步升高,但差异无统计学意义(>0.05);与LN组比较,HN+OL组LVEF显著升高,LVESD显著降低(<0.05);与HN组、OL组相比,HN+OL组LVEF显著升高(<0.05;表2)。
2.2 肺α1、β-AR各亚型mRNA表达水平比较
用药6周后检测各组大鼠肺组织α1、β-AR各亚型的mRNA表达水平。与N组相比,SH组α1、β-AR各亚型表达水平无显著性变化(>0.05);与SH组相比,HF组大鼠β1-AR和β3-AR表达水平明显下调,α1A-AR、α1B-AR和β2-AR表达水平明显上调(<0.01);与HF组相比,HN、OL、HN+OL 3组β1-AR和β3-AR表达水平均显著上调,α1A-AR、α1B-AR和β2-AR表达水平均显著下调(<0.05);与LN组相比,HN、OL、HN+OL 3组β1-AR和β3-AR表达水平均上调,α1A-AR、α1B-AR和β2-AR表达水平均下调(<0.05);与HN组相比,OL组β1-AR和β3-AR表达水平有上调趋势,α1A-AR、α1B-AR和β2-AR表达水平有下调趋势(>0.05);与HN、OL组相比,HN+OL组β1-AR和β3-AR表达水平进一步上调,α1A-AR、α1B-AR和β2-AR表达水平进一步下调(<0.05)。各组大鼠α1D-AR表达水平差异无统计学意义(>0.05;图1)。

表1 α1、β肾上腺素能受体各亚型引物序列及退火时间
AR: adrenergic receptor; GAPDH: glyceraldehyde-3-phosphate dehydrogenase

表2 用药前后各组大鼠超声心动图检测结果
N: normal control group; SH: sham-operation group; HF: heart failure group; LN: low-dose nitrate group; HN: high-dose nitrate; OL: olmesartan group; HN+OL: high-dose nitrate+olmesartan group. LVEF: left ventricular ejection fraction; LVEDD: left ventricular end-diastolic dimension; LVESD: left ventricular end-systolic dimension. Compared with SH group,**<0.01; compared with HF group,#<0.05; compared with LN group,△<0.05; compared with HN group,▲<0.05; compared with OL group,☆<0.05
2.3 肺α1、β-AR各亚型蛋白表达水平比较
用药6周后检测各组大鼠肺组织α1、β-AR各亚型蛋白表达水平。与N组相比,SH组α1、β-AR各亚型表达水平无显著性变化(>0.05);与SH组相比,HF组大鼠β1-AR和β3-AR表达水平明显下调,α1A-AR、α1B-AR和β2-AR表达水平明显上调(<0.01);与HF组相比,HN、OL、HN+OL 3组β1-AR和β3-AR表达水平均显著上调,α1A-AR、α1B-AR和β2-AR表达水平均显著下调(<0.05);与LN组相比,HN、OL、HN+OL 3组β1-AR和β3-AR表达水平均上调,α1A-AR、α1B-AR和β2-AR表达水平均下调(<0.05);与HN组相比,OL组β1-AR和β3-AR表达水平有上调趋势,α1A-AR、α1B-AR和β2-AR表达水平有下调趋势(>0.05);与HN、OL组相比,HN+OL组β1-AR和β3-AR表达水平进一步上调,α1A-AR、α1B-AR和β2-AR表达水平进一步下调(<0.05)。各组大鼠α1D-AR表达水平差异无统计学意义(>0.05;图2)。
3 讨 论
CHF时左心房、肺静脉压升高,肺毛细血管扩张,肺循环淤血,毛细血管内液体进入肺间充质、肺泡,产生肺淤血、肺水肿。当CHF持续存在,长时间的肺静脉高压,超过肺毛细血管网的缓冲能力,则可影响肺动脉压,出现肺动脉高压和右心功能不全[2,3]。
长效ISMN在临床上主要用于治疗冠心病和CHF[4]。硝酸酯类对CHF的治疗作用主要通过扩张静脉和外周小动脉,减轻心脏前、后负荷,以及扩张冠状动脉改善心肌血供来实现[5]。本研究结果显示,CHF组大鼠LVEF明显降低,硝酸酯治疗后LVEF显著升高,提示硝酸酯通过上述作用改善CHF心功能,增加心排出量。其中,大剂量硝酸酯作用明显优于小剂量,与小剂量扩张静脉降低心脏前负荷、大剂量扩张冠状动脉和外周小动脉、进一步改善心功能有关。
肺组织的肾上腺素受体包括α1-AR和β-AR各3种亚型。研究显示,人和大鼠肺组织均表达α1A-AR、α1B-AR及α1D-AR 3种亚型,但以α1A-AR和α1B-AR为主,α1D-AR表达水平较低[6],这3种亚型主要存在于肺小动脉、肺小静脉的平滑肌细胞和内皮细胞[7]。肺的β-AR包括β1-AR、β2-AR、β3-AR 3种亚型[8],以β2-AR为主。β2-AR分布于肺各部位,如气道、肺实质、肺淋巴组织等[9]。
本研究结果显示,CHF大鼠肺α1A-AR、α1B-AR表达水平明显上调,α1D-AR表达水平无显著变化;与国内学者[10]对低氧性肺动脉高压大鼠外周肺组织的研究结果相一致,即肺α1A-AR、α1B-AR mRNA表达水平升高,而α1D-AR无显著变化。α1-AR主要介导肺血管平滑肌收缩,其中α1A-AR介导肺动脉平滑肌细胞收缩和增殖,进而引起肺动脉收缩、血管壁增厚,导致肺血管重建[11]。CHF时,肺α1A-AR表达上调,一方面是机体的代偿反应,因低氧部位α1A-AR上调可诱发肺阻力血管收缩,使血液向通气好的肺区分流,改善通气/血流比例[12];另一方面,α1A-AR上调引起的肺血管重建可促进肺动脉高压和右心功能不全形成,使心功能进一步恶化。有研究认为,低氧使低氧诱生因子表达增加,并与α1B-AR基因上游启动子区域结合增加,促进α1B-AR的基因转录增强[13],使α1B-AR受体表达上调,与α1A-AR受体共同诱导低氧肺组织的血管收缩,使肺通气/血流比例升高。

图1 各组大鼠肺组织α1-、β-AR各亚型mRNA表达水平
Figure 1 Expression of α- and β-AR subtypes on mRNA level in lungs
N: normal control group; SH: sham-operation group; HF: heart failure group; LN: low-dose nitrate group; HN: high-dose nitrate group; OL: olmesartan group; HN+OL: high-dose nitrate+olmesartan group. Compared with SH group,**<0.01; compared with HF group,#<0.05; compared with LN group,△<0.05; compared with HN group,▲<0.05; compared with OL group,☆<0.05
本研究发现,CHF大鼠肺β2-AR表达水平显著上调,β1-AR、β3-AR表达水平显著下调,与国内学者[11]所观察到的低氧后大鼠肺动脉平滑肌细胞β2-AR mRNA表达增多、以及Miao等[14]发现老年心力衰竭大鼠肺β3-AR mRNA表达下调的结果相一致。肺β2-AR在β-AR中占主导地位,是调节肺生理功能的主要受体亚型。激动β2-AR可舒张支气管平滑肌,抑制炎症反应,改善肺微血管通透性并促进肺泡液体的清除等[15],β1-AR和β2-AR还可介导大鼠肺动脉舒张[16]。CHF大鼠存在肺循环淤血和肺水肿,β2-AR表达上调有利于肺水肿液的清除和舒张肺血管,进而减轻肺淤血、扩张支气管、增加肺通气,最终改善CHF状态下的肺功能。心力衰竭时肺β1-AR表达下调可能与其拮抗β2-AR的血管舒张作用以维持相对稳定的肺血管张力有关。此外,有研究表明激动CHF的肺β3-AR可增加肺泡液体清除率、减轻肺水肿[14],而促使CHF大鼠β3-AR表达下调,将延缓肺泡液体的清除,加重肺水肿。
本研究应用硝酸酯药物治疗后,心力衰竭大鼠肺α1A-AR、α1B-AR及β2-AR表达水平较模型组下调,β1-AR、β3-AR表达水平上调,α1D-AR表达水平无显著变化,可能与硝酸酯扩张血管、改善血流动力学和心肌灌注、减轻肺循环淤血、使病理状态下受体表达水平趋于正常有关。而α1-AR表达下调可延缓肺动脉高压进程,β3-AR表达上调可促进肺泡液体清除,抑制心、肺功能的进一步恶化。
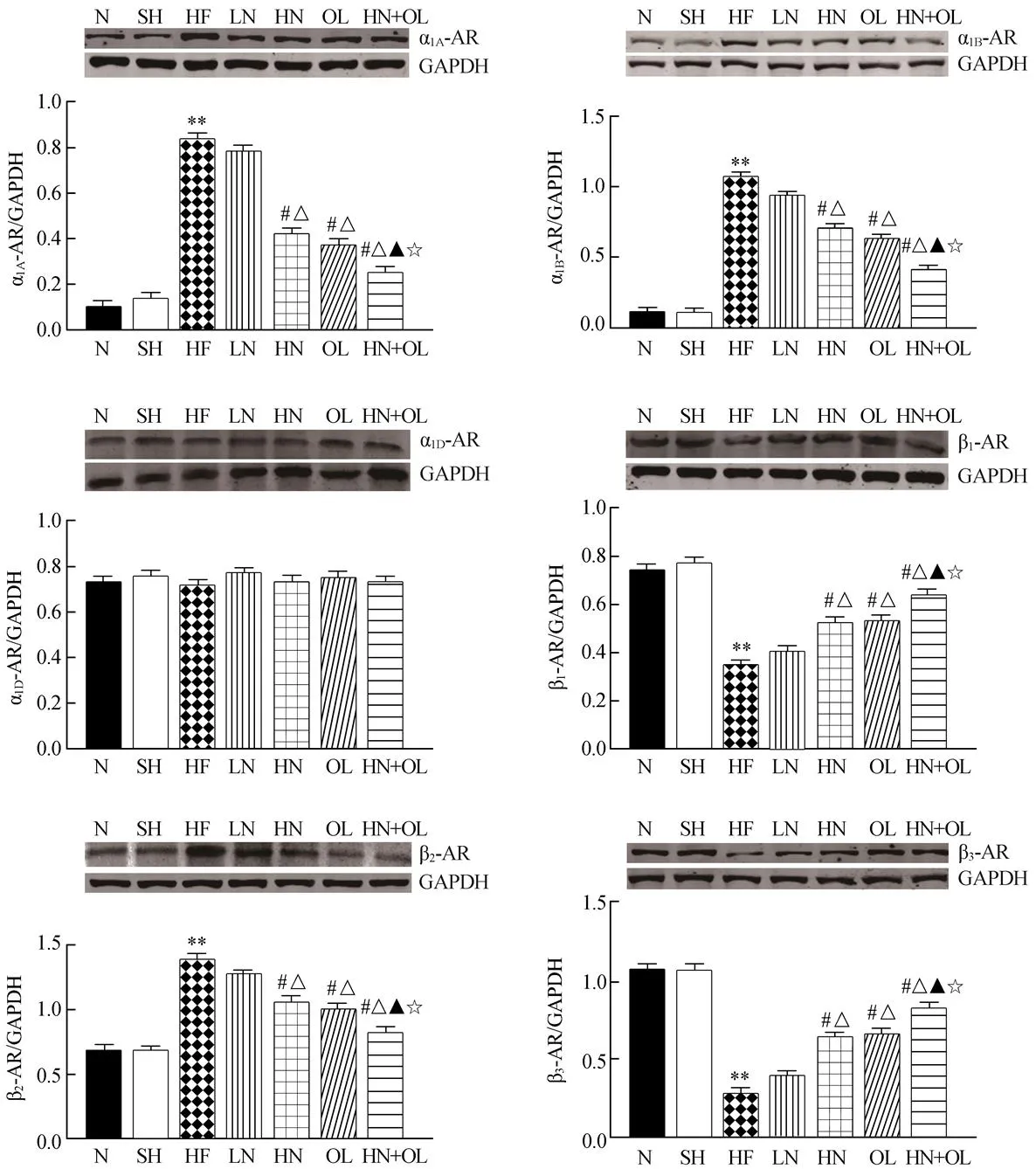
图2 各组大鼠肺组织α1、β-AR各亚型蛋白质表达水平
Figure 2 Expression of α1- and β-AR subtypes on protein level in lungs
N: normal control group; SH: sham-operation group; HF: heart failure group; LN: low-dose nitrate group; HN: high-dose nitrate group; OL: olmesartan group; HN+OL: high-dose nitrate+olmesartan group. Compared with SH group,**<0.01; compared with HF group,#<0.05; compared with LN group,△<0.05; compared with HN group,▲<0.05; compared with OL group,☆<0.05
奥美沙坦是高度选择性AT1R拮抗剂,能阻断AngⅡ和ATR的结合。与其他血管紧张素受体拮抗剂有所不同,奥美沙坦还具有血管紧张素转换酶抑制剂的作用,可抑制AngⅡ的生成,增加CHF时Ang1~7的表达水平,起到扩张血管的作用[17]。本研究中,奥美沙坦组心功能明显改善,反向调节CHF时肺α1、β-AR各亚型表达的效应略优于大剂量硝酸酯,可能与其RAAS抑制作用有关。本研究结果表明,奥美沙坦及大剂量硝酸酯联合用药较单独用药疗效更为显著,可能与两者优势互补、协同发挥治疗心力衰竭的作用有关。
综上所述,长效硝酸酯、奥美沙坦单用均可改善CHF大鼠心功能,反向调节心力衰竭时肺α1、β-AR的表达(使其趋于正常),二者联合效果更优,对心力衰竭时肺功能起到更为有益的保护作用。
[1] Zhu WH, Zhang XH, Xiao YM. Evaluation of heart function in heart failure rat model by echocardiography[J]. J Cent S Univ (Med Sci), 2009, 34(5): 453−456. [朱文晖, 张晓红, 肖渊茗. 超声心动图评价心力衰竭大鼠模型心功能改变[J]. 中南大学报(医学版), 2009, 34(5): 453−456.]
[2] Moraes DL, Colucci WS, Givertz MM. Secondary pulmonary hypertension in chronic heart failure: the role of the endothelium in pathophysiology and management[J]. Circulation, 2000, 102(14): 1718−1723.
[3] Ryan JJ, Archer SL. The right ventricle in pulmonary arterial hypertension: disorders of metabolism, angiogenesis and adrenergic signaling in right ventricular failure[J]. Circ Res, 2014, 115(1): 176−188.
[4] Tan Z, Shang X, Li L,. Clinical study of isosorbide mononitrate treatment for angina pectoris in coronary heart disease[J]. Exp Ther Med, 2013, 5(4): 1133−1136.
[5] Vizzardi E, Bonadei I, Rovetta R,. When should we use nitrates in congestive heart failure[J]? Cardiovasc Ther, 2013, 31(1): 27−31.
[6] Xu KM, Tang F, Han C. Alterations of mRNA levels of alpha1-adrenoceptor subtypes with maturation and ageing in different rat blood vessels[J]. Clin Exp Pharmacol Physiol, 1997, 24(6): 415−417.
[7] Görnemann T, Villalón CM, Centurión D,. Phenylephrine contracts porcine pulmonary veinsα1B-, α1D-,and α2-adrenoceptors[J]. Eur J Pharmacol, 2009, 613(1−3): 86−92.
[8] Mahajan P, Tabrizchi R. Influence of endothelium on beta-adrenoceptor-mediated mechanical and electrical functions in rat pulmonary artery[J]. Vasc Pharmacol, 2010, 53(3−4): 144−150.
[9] Johnson MW, Taylor BJ, Hulsebus ML,. Hypoxia induced change in lung fluid balance in humans is associated with beta-2 adrenergic receptor density on lymphocytes[J]. Respir Physiol Neurobiol, 2012, 183(2): 159−165.
[10] Xiao YY, Han L. The mRNA expression of alpha1-adrenergic receptor subtypes in the outer lung tissues of hypoxia pulmonary hypertension rats[J]. Chin J Pediatr, 2004, 42(7):502−506. [肖燕燕, 韩 玲. 缺氧性肺动脉高压大鼠肺组织α1肾上腺素受体亚型mRNA表达的研究[J]. 中华儿科杂志, 2004, 42(7): 502−506.]
[11] Yao XL, Xue QF, Zhao QP. Role of α1adrenoceptor in proliferation of hypoxic pulmonary artery smooth muscle cells[J]. Chin J Pathophysiol, 2011, 27(6): 1187−1192. [姚香兰, 薛全福, 赵琪平. α1肾上腺素受体在缺氧性肺动脉平滑肌细胞增殖中的作用[J]. 中国病理生理杂志, 2011, 27(6): 1187−1192.]
[12] Agostoni P, Bussotti M, Cattadori G,Gas diffusion and alveolar-capillary unit in chronic heart failure[J]. Eur Heart J, 2006, 27(21): 2538−2543.
[13] Eckhart AD, Yang N, Xin X,. Characterization of the α1B-adrenergic receptor gene promoter region and hypoxia regulatory elements in vascular smooth muscle[J]. Proc Natl Acad Sci USA, 1997, 94(17): 9487−9492.
[14] Miao G, Chen Z, Fang X,. Relationship between the autoantibody and expression of β3-adrenoceptor in lung and heart[J]. PLoS One, 2013, 8(7): e68747.
[15] Bernstein D1, Fajardo G, Zhao M.The role of β-adrenergic receptors in heart failure: differential regulation of cardiotoxicity and cardioprotection[J]. Prog Pediatr Cardiol, 2011, 31(1): 35−38.
[16] Bieger D, Parai K, Ford CA,. beta-adrenoceptor mediated responses in rat pulmonary artery: putative role of TASK-1 related K channels[J]. Naunyn Schmiedebergs Arch Pharmacol, 2006, 373(3): 186−196.
[17] Sukumaran V, Veeraveedu PT, Gurusamy N,. Olmesartan attenuates the development of heart failure after experimental autoimmune myocarditis in rats through the modulation of ANG 1−7 mas receptor[J]. Mol Cell Endocrinol, 2012, 351(2): 208−219.
(编辑: 周宇红)
Effect of long-acting nitrate on expression of α1- and β-adrenoceptor subtypes in lung of rats with heart failure
CHEN Meng-Meng1,2, LI Yan-Fang1,2*, PENG Yu-Bo1,2, JIANG Zhi-Li1,2, SONG Jun-Ying1,2
(1The 35thWard, Department of Emergency, Beijing Anzhen Hospital Affiliated to Capital Medical University, Beijing 100029, China;2Beijing Institute of Heart, Lung and Blood Vessel Diseases, Beijing 100029, China)
To investigate the effect of long-acting nitrate on the left ventricular function and the expression of α1- and β-adrenergic receptors subtypes in the lung tissue of rats with myocardial infarction-induced chronic heart failure (CHF).Ninety inbred male Wistar rats were divided into normal control group (N group,=9), sham-operation group (SH group,=8) and heart failure (HF) model group (=73). The HF model was successfully induced by ligating left anterior descending (LAD) artery in 44 rats. In 4 weeks after operation, the rats from the model group were divided into 5 groups, HF group (HF group,=9), low-dose nitrate group (LN group,=9), high-dose nitrate group (HN group,=9), positive medicine (olmesartan) control group (OL group,=9) and high dose nitrate combined with positive medicine group (HN+OL group,=8). The medication was given by gastric gavage for 6 weeks. Cardiac function was examined by echocardiography before and after the treatment, and the expression of β1-AR, β2-AR, β3-AR, α1A-AR, α1B-AR, and α1D-AR at mRNA and protein levels in the lung parenchyma was determined by reverse transcription-polymerase chain reaction (RT-PCR) and Western blotting.After the treatment, left ventricular ejection fraction (LVEF) was markedly higher in HN, OL and HN+OL groups than in HF group (<0.05). Compared with SH group, the expression of α1A-AR, α1B-AR, and β2-AR was significantly up-regulated (<0.05), and that of β1-AR and β3-AR was down-regulated in HF group (<0.05). Compared with HF group, the expression of α1A-AR, α1B-AR, and β2-AR was significantly down-regulated, and the expression of β1-AR and β3-AR was significantly up-regulated in HN, OL, and HN+OL groups (<0.05). Furthermore, there was significant difference in the expression of above subtypes between the OL group and HN+OL group (<0.05). No obvious difference was seen in the expression level of α1D-AR among all groups.Long-acting nitrate therapy remarkably improves LVEF in CHF rats induced by myocardial infarction, reverses the lung expression levels of α1- and β-AR subtypes to normal, and exerts abeneficial effect on the protection of lungfunction.
rats; nitrate; heart failure; lung; adrenergic receptor; subtypes
(DFCMDA201203).
R541.6
A
10.11915/j.issn.1671-5403.2015.06.107
2015−02−03;
2015−03−27
中国医师协会探索心血管研究基金项目(DFCMDA201203)
李艳芳, E-mail: liyf101@sohu.com
