慢性间歇性低氧状态mTOR信号通路变化对大鼠胰岛β细胞数量的影响*
2015-01-08焦成张敏娟严降雨李静殷敏程雷
焦成张敏娟严降雨李静殷敏程雷
·实验研究·
慢性间歇性低氧状态mTOR信号通路变化对大鼠胰岛β细胞数量的影响*
焦成1张敏娟1严降雨1李静1殷敏1程雷1
目的通过慢性间歇性低氧 (chronic intermittent hypoxia,CIH)大鼠模型,来探讨哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路变化对大鼠胰岛β细胞数量的影响。方法18只成年雄性SD大鼠随机均分为常氧组(A组)、CIH组(B组)、药物CIH组(C组),BC组予CIH处理,C组给予腹腔注射雷帕霉素0.2mg/kg/day。5周后检测胰岛mTOR及通路相关蛋白指标eIF4E、p-S6的表达、每个胰岛胰岛素阳性区域的面积及胰岛β细胞数量,以及血清胰岛素含量。结果与A组相比,B组除eIF4E外各指标均升高,C组p-S6、每个胰岛内β细胞的个数及胰岛素阳性区域的面积减少。相对于B组,C组各指标均降低。结论CIH状态下,mTOR信号通路激活诱导胰岛β细胞数量增多,雷帕霉素能抑制CIH引起的mTOR信号通路激活效应,降低mTOR通路相关蛋白指标表达水平和胰岛β细胞数量。
阻塞性睡眠呼吸暂停;胰岛素分泌细胞;哺乳动物雷帕霉素靶蛋白
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)可以引发神经调节异常、内分泌功能紊乱等一系列并发症,尤其是越来越多的研究关注OSAS导致的糖尿病。已经有研究发现,与普通成年人群相比,成年OSAS患者伴发糖尿病的比率更高[1]。也有研究提示,OSAS伴发代谢综合征[2],和胰岛素抵抗之间存在着相互影响、相互促进的恶性关系[3]。但OSAS继发糖尿病的具体病理生理机制目前尚不清楚。
研究表明,慢性间歇性低氧(chronic intermittent hypoxia,CIH)能通过影响胰岛素的分泌及其敏感性引起代谢功能异常[4,5],还能激发机体的氧化应激反应,引起炎症反应、线粒体损伤和β细胞凋亡[6-8]。此外,CIH能够诱发小鼠胰岛β细胞的凋亡和增殖[9,10],提示CIH环境下小鼠胰岛内同时存在着损伤和保护性机制。然而有关CIH影响胰岛β细胞的具体机制尚未研究清楚[5,11,12]。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)属于磷脂酰肌醇激酶相关激酶,以mTORC1和mTORC2两种复合体形式存在。mTOR参与多种信号通路的调节,在调节细胞的增殖、调控细胞周期方面起到重要作用[13],HIF-1就是mTOR通路下游的一个重要指标。雷帕霉素是特异性的mTOR抑制剂,通过抑制mTORC1的活性来控制下游的真核翻译起始因子结合蛋白1(eukaryotic initiation factor 4E-binding protein 1,eIF4EBP1)和核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase 1,P70S6K1),从而影响mRNA的翻译和体细胞的分裂。目前,雷帕霉素在免疫抑制和抗肿瘤方面已经得到运用。近年来有研究显示mTOR信号通路参与调控了胰岛β细胞的功能、生长和增殖,对缺氧下胰岛β细胞的生长和增殖也有重要影响[14-16]。Mori等在TSC1(mTOR上游的抑制剂)缺乏的小鼠中发现mTOR信号通路激活,而胰岛面积和β细胞大小也同时增加[17]。而Briaud等发现,mTOR的抑制剂雷帕霉素能够减少实验动物的胰岛素分泌和糖耐量[18]。
本研究拟进一步探讨CIH条件下大鼠胰岛β细胞数量和mTOR通路相关蛋白的表达情况,以及CHI下雷帕霉素对大鼠胰岛β细胞数量和mTOR通路的影响。
材料与方法
1 材料
胰岛素抗体、eIF4E抗体、山羊抗豚鼠IgG抗体(Abcam公司,英国),mTOR抗体、P-S6抗体(CST公司,美国),浓缩型SABC-Cy3(兔IgG)试剂盒(武汉博士德),大鼠胰岛素ELISA试剂盒(ALPCO公司,美国)。XF-YCO6-T型低氧舱(南京新飞仪器制造有限公司),酶标仪(Bio-Rad,美国),荧光倒置显微镜(CarlZeiss公司,德国)
2 方法
2.1 动物模型
由江苏省实验动物中心购买18只8周龄清洁级雄性SD大鼠,体重200~230g。按随机数字法将大鼠平均分成3组,分别是常氧组(A组)、CIH组(B组)、药物CIH组(C组)。A组在常压、空气环境培养舱中饲养;B组和C组在低氧舱中饲养,低氧条件(60s/N2,60s/空气,交替充入,保证舱内氧气浓度在5%-21%之间波动,每天8:30~16:30,共35天),各组均能自由进水、食。C组分别给予雷帕霉素0.2mg/ kg/day,雷帕霉素事先按50mg/ml溶于二甲基亚砜(DMSO)中,再以1:200的比例稀释到磷酸盐缓冲液(PBS)中进行腹腔注射。A组给予同等体积和稀释比例的DMSO和PBS混合液。实验过程中保证饲养房恒温恒湿。本实验方案已经过南京医科大学实验动物伦理委员会批准。
2.2 实验取材和标本保存
造模结束后取材前夜大鼠禁食12h,用2%戊巴比妥钠按4mg/100g的剂量进行腹腔麻醉。固定,负压管腹主动脉采血,室温放置2h以后用4℃离心机3000r/min离心15min,取血清放入-20℃冰箱保存备用。用生理盐水进行持续心脏灌流,当流出液澄清时快速打开腹腔取2块同等大小的胰腺尾部组织,放入4%多聚甲醛固定液中浸泡48h后进行石蜡包埋。
2.3 血清胰岛素水平检测
血清胰岛素水平采用酶联免疫分析法(ELISA)检测。取实验前保存的大鼠血清,按照试剂盒说明书进行操作,最后在酶标仪上450波长处检测,计算出血清胰岛素水平。
2.4 各组大鼠胰岛mTOR、eIF4E、p-S6的表达情况以及胰岛β细胞数量的检测
取已经包埋好的胰尾组织石蜡块进行切片,厚度为4μm,放入65℃烘箱2h后进行HE染色,直至看到形态完整的胰岛开始留片做免疫荧光实验。将切片放入65℃烘箱孵育过夜,然后经二甲苯、梯度酒精一步步脱蜡至水化,放在柠檬酸盐缓冲液中浸泡着进行微波抗原修复,待其自然冷却至室温后采用与二抗同源的山羊血清进行封闭30min,PBS漂洗,加入胰岛素抗体和mTOR/eIF4E/p-S6抗体适当比例混合的一抗在4℃冰箱里孵育过夜。次日复温20min后,PBS漂洗3次,加入山羊抗豚鼠二抗室温孵育1h,PBS漂洗3次,加入生物素化抗兔二抗室温孵育30min,PBS漂洗3次,加入SABC-Cy3室温孵育30min,漂洗5次(所有操作均在湿盒中进行,实验中保持样本湿润,避免光照。加入DAPI孵育10min,漂洗2次,采用水溶性抗荧光淬灭封片剂封片。在荧光倒置显微镜下观察,胰岛素染色阳性的为胰岛β细胞,其细胞浆为绿色,mTOR/eIF4E/p-S6染色阳性的细胞胞浆为红色。
3 图像处理
使用Image-Pro Plus软件分别计算胰岛素阳性区域的面积及每个胰岛内胰岛β细胞的个数。为了结果的准确性,实验中每只大鼠相隔50μm做2张切片,分别计算相应数值,图像原始放大倍数为200倍。同样通过Image-Pro Plus软件计算胰岛β细胞mTOR/eIF4E/p-S6的平均积分光密度(the mean integrated optical density,mIOD)来比较这几个指标的表达水平。
4 统计学分析
本实验中各组数据虽然正太分布,但方差不齐,不满足方差分析的条件,故通过SPSS18.0对数据进行秩变换,采用非参数检验中K个独立样本的Kruskal-Wallis检验,并根据结果进行两个样本间的Mann-WhitneyU检验。
结果
各组所测指标结果见表1。在每个指标上各组间均不满足方差齐性,且Kruskal-Wallis检验提示在每个指标上各组间均不全相等(P<0.05),因此行Mann-Whitney U检验进行两两比较(表2)。
与A组相比,B组mTOR、p-S6的表达、每个胰岛内胰岛素阳性区域的面积以及胰岛β细胞的个数增多(图1,2;P<0.01),血清胰岛素含量也增多(P<0.05)。而C组p-S6的表达和每个胰岛内β细胞的个数减少(P<0.01),每个胰岛内胰岛素阳性区域的面积也减少(P<0.05)。
与B组相比,C组血清胰岛素含量减少(P<0.05),其余各指标均减少(P<0.01)。
B和C组 eIF4E与A组比较,P值临界(= 0.055),进一步通过SNK法进行组间比较发现各组间差异有统计学意义。

表1 各组大鼠所测指标结果

表2 利用Mann-Whitney U检验进行组间比较
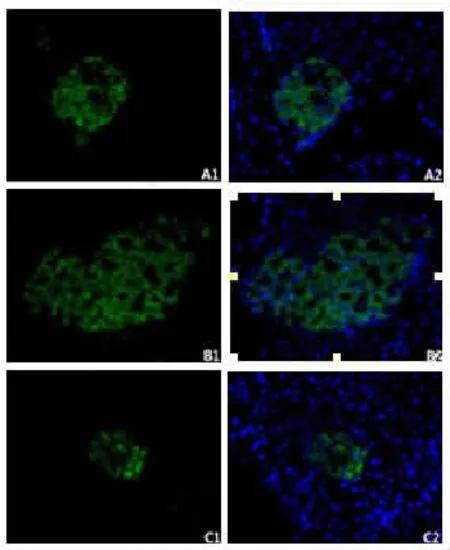
图1 各组大鼠血清胰岛素含量比较
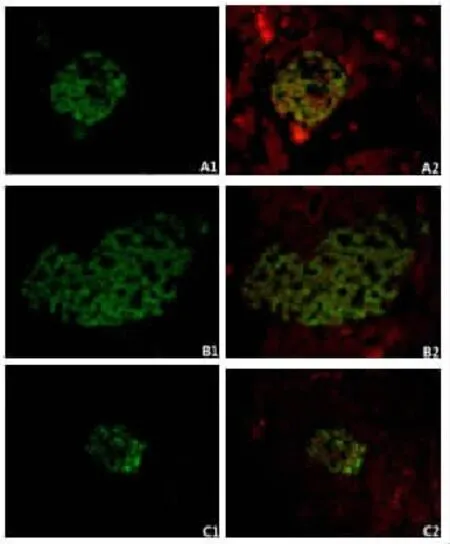
图2 各组大鼠胰岛β细胞数量比较
讨论
通过Mann-Whitney U检验进行A、B两组比较时,发现除eIF4E(P=0.055)外,其余各指标均增高。考虑到秩变换有可能对检验效果有影响,故又通过Snk法对eIF4E的表达进行两两比较,发现三组数值分列三列,两两组间差异都有统计学意义,两种统计学方法结果的差异有可能与秩变换后检验效能降低有关。在A组和C组的比较中,CIH和雷帕霉素共同作用下只有p-S6的表达、每个胰岛内胰岛素阳性区域的面积以及胰岛β细胞的个数三个指标有统计学差异,我们认为这可能与雷帕霉素的负反馈作用[19]和胰岛素的脉冲式分泌[20]有关。
CIH下,mTOR信号通路激活诱导胰岛β细胞数量增多。国内外研究显示OSA是糖尿病的独立危险因素[21],而糖尿病的进展过程根据胰岛β细胞的功能和一些代谢指标可以分为5个阶段[22]。在最初的代偿阶段发生胰岛素抵抗,为了保持正常的血糖水平,胰岛素分泌增加,而胰岛素分泌增加的很大一部分原因是因为胰岛β细胞数量增加。在接下来的适应期和失代偿期,由于胰岛β细胞数量减少、功能受损、糖耐量减低,血糖超过了临界值。本次试验中,CIH暴露后大鼠胰岛β细胞数量增多,血清胰岛素含量水平上升,与糖尿病代偿期相似。这说明经历5周间歇性缺氧,此时大鼠胰岛β细胞数量增多,大鼠胰岛的功能仍处于代偿期。此外,有文献报道短期(4天)或中长期(4周)间歇性缺氧都能够同时刺激胰岛β细胞增殖和凋亡[9,10,16],可以据此推测本次实验中CIH下胰岛β细胞增殖和凋亡也共同增加,而B组胰岛β细胞数量增加应该是增殖凋亡失衡的结果,由此可见CIH下机体同时存在着损伤和保护性机制。然而更长时间的间歇性低氧下,胰岛β细胞的增殖凋亡情况以及数量的变化还需要进一步研究。
mTOR通路下游两个最重要的效应器是eIF4EBP1和P70S6K1。mTOR通过磷酸化4EBP1释放eIF4E并活化,同时mTOR能磷酸化P70S6K1使细胞内40S核糖体蛋白S6磷酸化,eIF4E和p-S6共同调节mRNA的转录与翻译、蛋白质的合成以及细胞增殖[23]。目前有很多证据表明低氧能够使mTOR通路活化,低氧下低氧诱导因子1表达增多也很可能与mTOR通路的活化有关[15]。最近研究发现PI3K/AKT信号通路是mTOR上游的一条重要通路,低氧下胰岛素/胰岛素样生长因子信号通路表达增加,激活PI3K/AKT通路,抑制结节性硬化症复合物(tuberous sclerosis complex,TSC)表达,TSC负向调控的Rheb活性增加并与GTP结合,增强mTORC1、mTORC2信号通路[24]。也有报道指出,那些缺少TSC1的小鼠胰岛β细胞mTOR通路激活,胰岛面积和β细胞大小都增大,胰岛素的产量和分泌量也增加[17,25]。本次试验中CIH下,mTOR、eIF4E、p-S6的表达增加符合试验预期,mTOR通路激活与胰岛素阳性面积增大和胰岛β细胞数量增多有密切关系。
雷帕霉素能抑制CIH引起的mTOR信号通路激活效应,降低mTOR通路相关蛋白指标表达水平和胰岛β细胞数量。雷帕霉素是最早发现的mTOR抑制剂,能与他克莫司结合蛋白-12(FK506-binding protein 12,FKBP12)形成复合物抑制mTORC1的活性从而抑制整个通路[19]。由于过度激活的PI3K/ AKT/mTOR通路与肿瘤发生发展关系密切,雷帕霉素常用于肿瘤治疗和免疫抑制等方面[26]。本实验中使用雷帕霉素是为了进一步验证CIH下胰岛β细胞mTOR信号通路的激活效应以及其在胰岛β细胞数量变化中所起的作用。在雷帕霉素作用下,C组大鼠mTOR、eIF4E、p-S6的表达均明显降低,mTOR信号通路受到抑制,说明雷帕霉素作用已经达到预期。胰岛素阳性区域和每个胰岛内β细胞的个数减少,血清胰岛素含量也有所降低,这些结果说明mTOR信号通路的抑制或者去激活效应能够影响胰岛β细胞的增殖凋亡平衡,引起胰岛β细胞数量减少。
总的来说,本研究中mTOR信号通路的活性与胰岛β细胞的数量的平行变化关系表明,CIH下mTOR信号通路激活很大程度上了诱导了胰岛β细胞增殖凋亡失衡,使其数量增加,胰岛素分泌增多。雷帕霉素能够抑制mTOR信号通路激活,降低与mTOR信号通路密切相关的胰岛β细胞数量。但各类研究显示CIH下仍有HIF-1、VEGF等多种信号通路与胰岛β细胞增殖、凋亡相关,对β细胞的功能、数量产生影响[16],由此可见对CIH下各类信号通路变化的分子机制以及临床意义仍然需要进一步探索。
1 Lam DC,Lui MM,Lam JC,et al.Prevalence and recognition of obstructive sleep apnea in Chinese patients with type 2 diabetes mellitus.Chest,2010,138(5):1101-1107.
2 Vgontzas AN,Bixler EO,Chrousos GP.Sleep apnea is a manifestation of the metabolic syndrome.Sleep Med Rev, 2005,9(3):211-224.
3 Reichmuth KJ,Austin D,Skatrud JB,et al.Association of sleep apnea and type II diabetes:a population-based study.Am J Respir Crit Care Med,2005,172(12):1590-1595.
4 Louis M,Punjabi NM.Effects of acute intermittent hypoxia on glucose metabolism in awake healthy volunteers.J Appl Physiol(1985),2009,106(5):1538-1544.
5 Iiyori N,Alonso LC,Li J,et al.Intermittent hypoxia causes insulin resistance in lean mice independent of autonomic activity.Am J Respir Crit Care Med,2007,175 (8):851-857.
6 裴静,姚蒙,焦成,等.慢性间歇性缺氧条件下大鼠胰岛功能与mTOR通路相关蛋白表达的变化.南京医科大学学报:自然科学版,2014,34(7):915-920.
7 Chang KC,Hsu CC,Liu SH,et al.Cadmium induces apoptosis in pancreatic beta -cells through a mitochondria-dependent pathway:the role of oxidative stress-mediated c-Jun N-terminal kinase activation.PLoS One,2013,8(2):e54374.
8 Pallayova M,Lazurova I,Donic V.Hypoxic damage to pancreatic beta cells—the hidden link between sleep apnea and diabetes.Med Hypotheses,2011,77(5):930-934.
9 Yokoe T,Alonso LC,Romano LC,et al.Intermittent hypoxia reverses the diurnal glucose rhythm and causes pancreatic beta-cell replication in mice.J Physiol,2008, 586(3):899-911.
10 Xu J,Long YS,Gozal D,et al.Beta-cell death and proliferation after intermittent hypoxia:role of oxidative stress.Free Radic Biol Med,2009,46(6):783-790..
11 Chen L,Cao ZL,Han F,et al.Chronic intermittent hypoxia from pedo-stage decreases glucose transporter 4 expression in adipose tissue and causes insulin resistance. Chin Med J(Engl),2010,123(4):463-470.
12 Punjabi NM,Beamer BA.Alterations in Glucose Disposal in Sleep-disordered Breathing.Am J Respir Crit Care Med,2009,179(3):235-240.
13 Schmelzle T,Hall MN.TOR,a central controller of cell growth.Cell,2000,103(2):253-262.
14 Shigeyama Y,Kobayashi T,Kido Y,et al.Biphasic response of pancreatic beta-cell mass to ablation of tuberous sclerosis complex 2 in mice.Mol Cell Biol, 2008,28(9):2971-2979.
15 Yuan G,Nanduri J,Khan S,et al.Induction of HIF-1alpha expression by intermittent hypoxia:involvement of NADPH oxidase,Ca2+signaling,prolyl hydroxylases,and mTOR.J Cell Physiol,2008,217(3):674-685.
16 Gu CJ,Li M,Li QY,et al.Chronic intermittent hypoxia increases beta cell mass and activates the mammalian target of rapamycin/hypoxia inducible factor 1/vascular endothelial growth factor A pathway in mice pancreatic islet.Chin Med J(Engl),2013,126(12):2368-2373.
17 Mori H,Inoki K,Opland D,et al.Critical roles for the TSC-mTOR pathway in beta-cell function.Am J Physiol Endocrinol Metab,2009,297(5):1013-1022.
18 Briaud I,Dickson LM,Lingohr MK,et al.Insulin receptor substrate-2 proteasomaldegradation mediated by a mammalian target of rapamycin(mTOR)-induced negative feedback down-regulates protein kinase B-mediated signaling pathway in beta-cells.J Biol Chem,2005,280 (3):2282-2293.
19 熊伟,程金湘,章翔.哺乳动物雷帕霉素靶蛋白研究进展.中华神经外科疾病研究杂志,2011,10(1):85-88.
20 Monzillo LU,Hamdy O.Evaluation of insulin sensitivity in clinical practice and in research settings.Nutr Rev, 2003,61(12):397-412.
21 Gu C J,Li M,Li QY,et al.Obstructive sleep apnea is associated with impaired glucose metabolism in Han Chinese subjects.Chin Med J(Engl),2013,126(1):5-10.
22 Weir GC,Bonner-Weir S.Five stages of evolving betacell dysfunction during progression to diabetes.Diabetes, 2004,53 Suppl 3:S16-S21.
23 Cornu M,AlbertV,HallMN.mTOR in aging, metabolism,and cancer.Curr Opin Genet Dev,2013,23 (1):53-62.
24 Johnson SC,Rabinovitch PS,Kaeberlein M.mTOR is a key modulator of ageing and age-related disease.Nature, 2013,493(7432):338-345.
25 Shigeyama Y,Kobayashi T,Kido Y,et al.Biphasic response of pancreatic beta-cell mass to ablation of tuberous sclerosis complex 2 in mice.Mol Cell Biol, 2008,28(9):2971-2979.
26 LopiccoloJ,BlumenthalGM,Bernstein WB,etal. Targeting the PI3K/Akt/mTOR pathway: effective combinations and clinical considerations.Drug Resist Updat,2008,11(1-2):32-50.
(收稿:2014-04-25 修回:2014-08-15)
The influence of the mammalian target of rapamycin pathway changes on islet β cell number in the rats under chronic intermittent hypoxia
JIAO Cheng,ZHANG Minjuan,YAN Jiangyu,LI Jing,YIN Min,CHENG Lei
Department of Otorhinolaryngology,The First Affiliated Hospital of Nanjing Medical University,Nanjing,Jiangsu, 210029,China
ObjectiveTo investigate the influence of the mammalian target of rapamycin pathway changes on islet β cell number in the rats under chronic intermittent hypoxia.MethodsEighteen adult male Sprague-Dawley(SD)rats were randomly divided into 3 groups,including the normoxic group(group A),the CIH group(group B)and the CIH group with the rapamycin(group C).The group B and C were fed in low oxygen cabins.The group C received Intraperitoneal injection with rapamycin 0.2 mg/kg/day.After 5 weeks, we detect the expression of mTOR/p-S6/eIF4E,insulin positive area and β cell number per islet,and the serum insulin levels.ResultsIn comparison with group A,all indexes in group B increased except the expression of eIF4E,while the expression of p-S6, insulin positive area and the β cell number per islet decreased in group C.In comparison with group B,all indexes decreased in group C.ConclusionChronic intermittent hypoxia activated the mTOR pathway which induced the increase in the number of pancreatic islet β cells.Rapamycin can inhibit the activation of mTOR pathway and decrease the expression of the mTOR pathway related proteins and the β cell number in rats under CIH.
Obstructive sleep apnea;Insulin-secreting cells;Mammalian target of rapamycin
10.16542/j.cnki.issn.1007-4856.2015.02.002
江苏高校优势学科建设工程(JX10231801);江苏省人民医院创新团队(IRT-016)
1 南京医科大学第一附属医院 江苏省人民医院耳鼻咽喉科(江苏南京,210029)
殷敏,副教授. Email:simisodo@hotmail.com
