猪血多肽对建鲤抗氧化能力和免疫功能的影响
2014-12-21王加豪刘英娟杜金梁曹丽萍殷国俊
王加豪 贾 睿, 刘英娟 杜金梁 曹丽萍 殷国俊,*
(1.南京农业大学无锡渔业学院,无锡 214081;2.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室/鱼类免疫药理学国际联合实验室,无锡 214081)
生物活性肽是一类在生物体内对生物活动具有调节作用的肽类化合物[1],具有易吸收、促进免疫、抗菌、抗病毒等优点,其种类繁多,主要有乳肽、玉米肽、畜产肽等,是当前国际研究最热门以及最有发展前景的功能因子。目前,国内外研究人员已从不同来源的蛋白质中提取到各种具有抗氧化活性的肽类物质[2],Hattori等[3]、Suetsuna等[4]、Suetsuna 等[5]分别从不溶性的弹性蛋白、酪蛋白和沙丁鱼中分离得到了抗氧化肽。猪血在我国是很好的蛋白质源,具有很高的营养价值[6],但由于其自身具有分子质量大、难消化等缺点,严重影响了猪血在我国养殖业的应用[7]。而猪血多肽(peptides from swine blood,PSB)的出现,则弥补了猪血的这些缺点,猪血多肽是利用微生物发酵猪血而分离获得的一类具有多种生物活性的短肽,它具有易吸收、利用率高等优点,是当前研究的热点。方俊等[8]研究发现,猪血多肽对于机体中的自由基具有明显的清除作用,显示其具有较强的抗氧化能力。关于猪血多肽在水产养殖业中的应用未见相关报道。
本研究以建鲤(Cyprinus carpio var.Jian)为试验对象,用猪血多肽和饲料混合喂养健康无伤的建鲤,在不同阶段取血样、头肾,通过检测血清中各种抗氧化酶活性的变化以及蛋白质浓度的变化,并结合体外试验测定的指标变化来评价猪血多肽对建鲤抗氧化能力和免疫功能的影响,为猪血蛋白质源生物活性肽在鱼类饲料中的应用研究提供理论依据。
1 材料与方法
1.1 试验动物
试验用建鲤取自中国水产科学院淡水渔业研究中心渔场,所选建鲤健康无伤、平均体重在100 g左右,饲养于循环水系统中,水温27℃,每天投喂配制的饲料2次。
1.2 药品和试剂
猪血多肽购自北京渔经生物技术有限公司,为分子质量<1 ku的小肽混合物。
细菌脂多糖(LPS)、L-15培养基、杜氏磷酸盐缓冲液(D-PBS)、二甲基亚砜(DMSO)、氯化硝基四氮唑蓝(NBT)、佛波豆寇乙酸酯(PMA)、Hank’s平 衡 盐 溶 液 (HBSS)、链 霉 素/青 霉 素(streptomycin/penicillin,S/P)、肝素(heparin)购于美国Sigma公司;胎牛血清(FCS)和细胞培养板购于GIBCO生物技术有限公司;超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性及总蛋白(TP)、白蛋白(ALB)含量等测定试剂盒购自于南京建成生物工程研究所;白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、补体 3(C3)、补体 4(C4)含量测定试剂盒购自于上海朝瑞生物科技有限公司,WST-1试剂盒购自于碧云天生物技术研究。
1.3 体外试验
1.3.1 建鲤头肾巨噬细胞和外周血白细胞的分离
采用 Bayne[9]和曹丽萍等[10]的方法分离建鲤头肾巨噬细胞和外周血白细胞。将分离的细胞浓度调整为 107个/mL。接种到 96孔板上,每孔100μL,27℃培养2 h后,洗去未贴壁细胞,加入100μL L-15培养基(含1%S/P和5%FCS),27℃培养备用。
将培养备用的白细胞和巨噬细胞在96孔细胞培养板中培养24 h后,吸弃培养基,再加入含有不同浓度 (10、20、40、80 μg/mL)猪血多肽的L-15培养基100μL,同时设空白对照(加入等量L-15培养基)和阳性对照(加入等量含500μg/mL LPS的L-15培养基),作用24 h后,分别检测白细胞增殖能力和巨噬细胞呼吸爆发活性。
1.3.2 外周血白细胞增殖能力的测定
白细胞增殖能力通过WST-1(是一种高度水溶性的四唑盐)试剂盒检测。将细胞以每孔1×104个/mL的量接种于96孔板中,培养24 h后,分别用含不同浓度猪血多肽(10、20、40、80 μg/mL)的L-15培养基进行处理,每孔加入100μL,然后每孔加入10μL WST-1孵育2 h,每孔混合均匀后选择450 nm波长,在酶联免疫检测仪上测定各孔的吸光度值,记录结果。共测定8尾鱼,每尾鱼为1个重复。
1.3.3 头肾巨噬细胞呼吸爆发活性的测定
氧呼吸爆发和氮呼吸爆发活性均根据Yin等[11]的方法进行检测,其结果用吸光度值表示,共测定8尾鱼,每尾鱼为1个重复。
1.4 体内试验
1.4.1 试验设计
将初始体重为(100±2)g的建鲤随机分为5组,即1个对照组和4个试验组,每组20尾。对照组饲喂基础饲料(表1),基础饲料中不添加猪血多肽;4个试验组分别饲喂在基础饲料中添加0.5(PSB0.5 组)、1.0(PSB1 组)、2.0(PSB2 组)和5.0 g/kg(PSB5组)猪血多肽的试验饲料。饲养8周,期间分4次采集血液,采集时间分别在试验第1、2、4、8 周。
1.4.2 血清制备
每组选8尾建鲤,从尾静脉采血,血样在4℃冰箱中静置4 h后,4℃下4 000 r/min离心10 min制备血清,每尾鱼均单独制备血清,-20℃冻存备用。
1.4.3 血清生化指标及抗氧化指标测定
按照试剂盒操作说明,分别测定血清中SOD、CAT、AKP、GSH-Px活性以及TP和ALB含量。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis)%
1.4.4 血清免疫指标测定
参照试剂盒操作说明,分别测定血清中IL-1β、TNF-α、C3、C4 含量。
1.5 数据分析
试验数据采用平均值±标准误(mean±SD)表示,数据分析采用SPSS 16.0软件包中的单因素方差分析(one-way ANOVA)和Duncan氏法多重化比较处理,对样本(空白对照组与试验组之间)进行t检验。P<0.05为差异显著。
2 结果与分析
2.1 猪血多肽对体外培养建鲤细胞性能的影响
由表2可知,LPS能显著提高建鲤外周血白细胞的增殖能力,同时也可以增强头肾巨噬细胞的氮呼吸爆发和氧呼吸爆发活性,说明经检测的离体培养的细胞状态是正常的。当用不同浓度的猪血多肽处理白细胞后,白细胞的增值能力随着浓度的提高出现了不同的变化。与空白对照组相比,各浓度猪血多肽组的细胞增殖能力均有所提高,浓度为20和 40μg/mL的组提高显著(P<0.05),浓度为 80μg/mL的组提高极显著(P<0.01)。与空白对照组相比,添加40和80μg/mL猪血多肽显著增强了建鲤头肾巨噬细胞氮呼吸爆发活性(P<0.05)。与空白对照组相比,添加40μg/mL猪血多肽显著增强了建鲤头肾巨噬细胞氧呼吸爆发活性(P<0.05),添加 80μg/mL猪血多肽极显著增强了建鲤巨噬细胞氧呼吸爆发活性(P<0.01)。
2.2 猪血多肽对建鲤血清生化指标及抗氧化指标的影响
猪血多肽对建鲤血清生化指标的影响结果见表3。与对照组对比,在第1周,PSB2和PSB5组血清中 TP含量显著增加(P<0.05);在第2周,PSB5组血清中TP含量显著增加(P<0.05);在第4和8周,PSB1、PSB2和 PSB5组血清中 TP含量均显著增加(P<0.05)。
与对照组相比,在第1、2和4周,各试验组血清中ALB含量没有显著变化(P>0.05);在第8周,PSB1、PSB2和PSB5组血清中ALB含量均显著增加(P<0.05)。此外,在第 4周,PSB2和 PSB5组血清中 ALB含量显著高于 PSB0.5组(P<0.05)。
与对照组相比,在第1周,PSB5组血清中AKP活性显著升高(P<0.05);在第 2周,PSB1、PSB2和PSB5组血清中AKP活性显著升高(P<0.05);在第4周,各试验组血清中AKP活性均显著升高(P<0.05);在第 8周,PSB2和 PSB5组血清中AKP活性显著升高(P<0.05)。

表2 猪血多肽对体外培养建鲤细胞性能的影响(以OD值计)Table 2 Effects of PSB on properties of Jian carp cells cultured in vitro(as expressed by OD value)
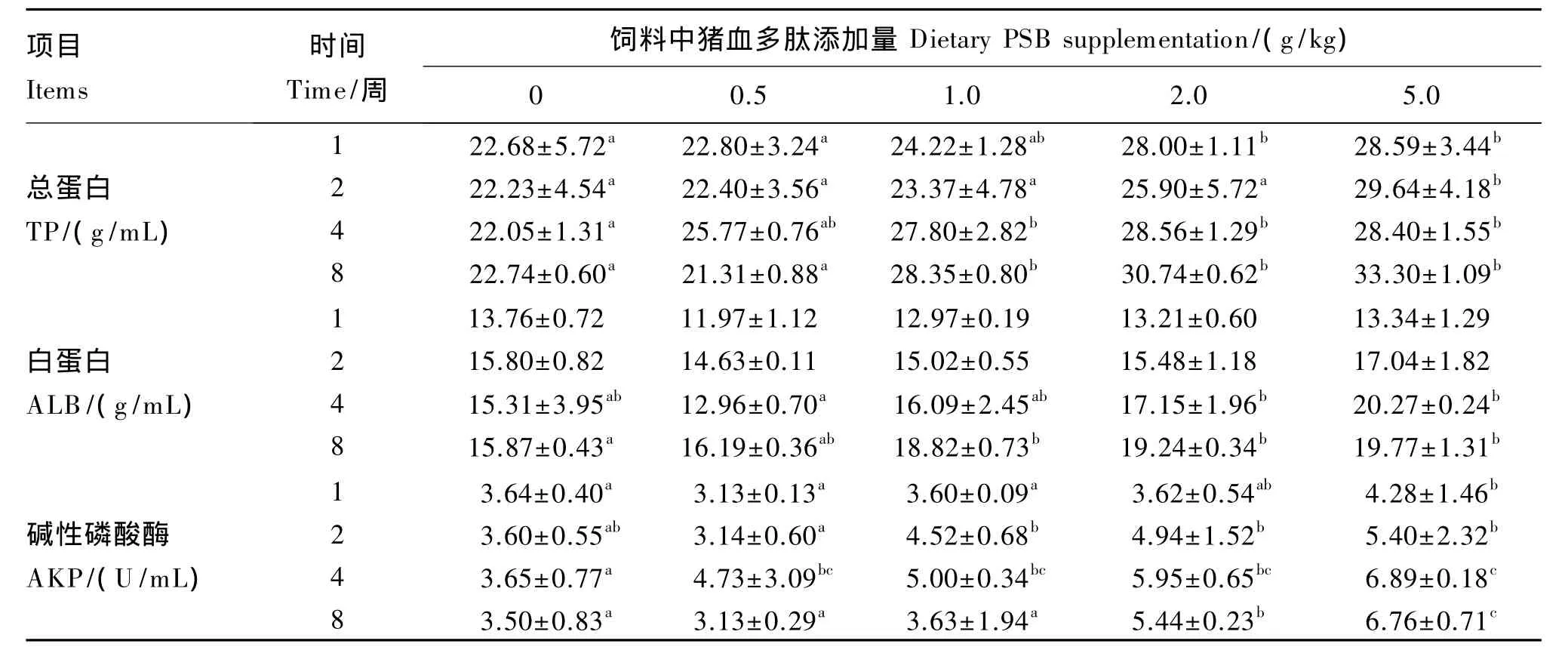
表3 猪血多肽对建鲤血清生化指标的影响Table 3 Effects of PSB on serum biochemical indices of Jian carp
2.3 猪血多肽对建鲤血清抗氧化指标的影响
猪血多肽对建鲤血清抗氧化指标的影响结果见表4。
与对照组相比,在第1和2周,PSB2和PSB5组血清中 CAT活性显著升高(P<0.05);在第4周,PSB5组血清中CAT活性显著升高(P<0.05);在第8周,PSB1、PSB2和PSB5组血清中CAT活性显著升高(P<0.05)。
与对照组相比,在第1周,PSB2和PSB5组血清中SOD活性显著升高(P<0.05);在第2、4和8周,仅 PSB5组血清中SOD活性显著升高(P<0.05),其他试验组没有显著变化(P>0.05)。
与对照组相比,在第1和2周,各试验组血清中GSH-Px活性没有显著变化(P>0.05);在第4和8周,仅PSB5组血清中GSH-Px活性显著升高(P<0.05),其他试验组没有显著变化(P>0.05)。
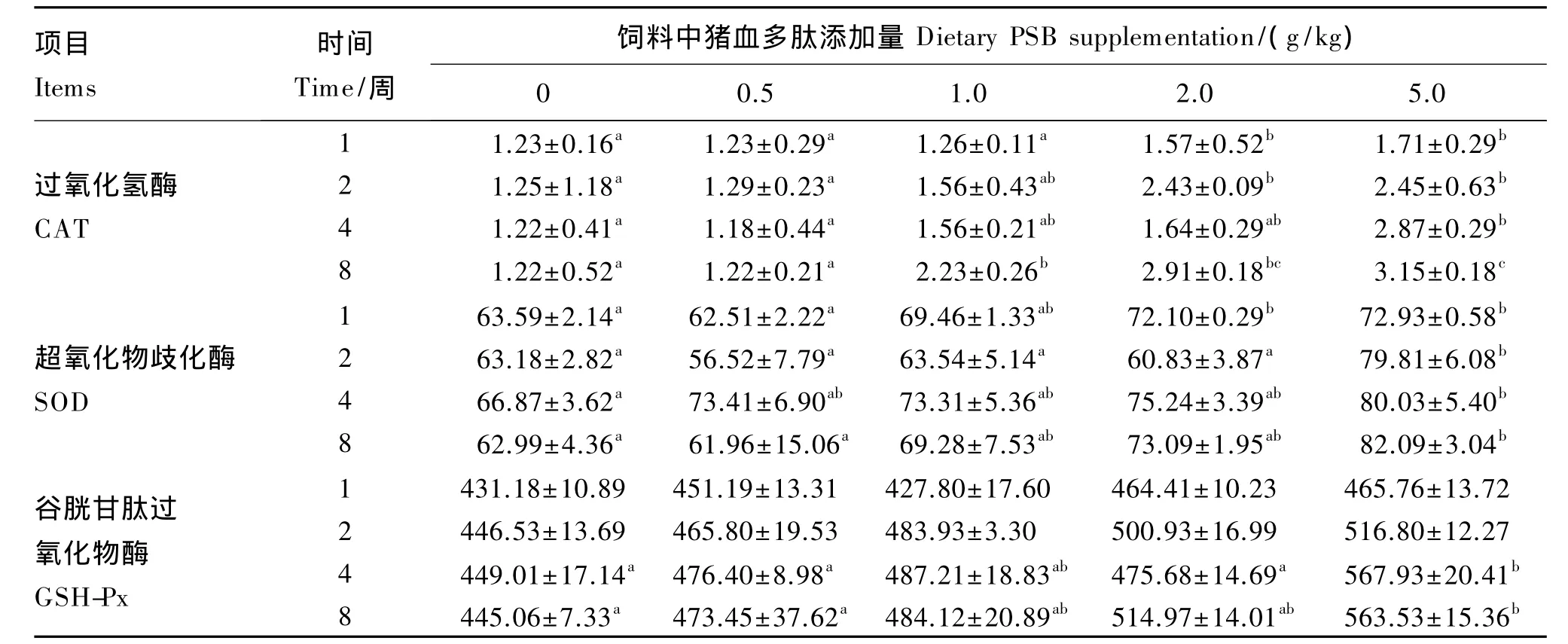
表4 猪血多肽对建鲤血清抗氧化指标的影响Table 4 Effects of PSB on serum antioxidant indices of Jian carp U/mL
2.4 猪血多肽对建鲤血清免疫指标的影响
猪血多肽对建鲤血清免疫指标的影响结果见表5。
与对照组相比,在第1周,各试验组血清中IL-1β含量没有显著变化(P>0.05);在第 2周,PSB2和PSB5组血清中IL-1β含量显著升高(P<0.05);在第4周,PSB5组血清中 IL-1β含量显著升高(P<0.05);在第 8周,PSB2和 PSB5组血清中 IL-1β 含量显著升高(P<0.05)。
与对照组相比,在第1周,PSB0.5组血清中TNF-α 含量显著降低(P<0.05);在第 2 周,各试验组血清中TNF-α含量没有显著变化(P>0.05);在第4和8周,PSB2和PSB5组血清中TNF-α含量显著升高(P<0.05)。
与对照组相比,在第1周,PSB0.5和PSB1组血清中C3含量显著降低(P<0.05),随着猪血多肽添加量的升高,血清中C3含量是逐渐升高的;在第2和4周,各试验组血清中C3含量没有显著变化(P>0.05);在第 8周,PSB2和 PSB5组血清中 C3 含量显著升高(P<0.05)。
与对照组对比,在第1和2周,各试验组血清中C4含量没有显著变化(P>0.05);在第4周,PSB2和PSB5组血清中 C4含量显著升高(P<0.05);在第 8周,PSB1、PSB2和 PSB5组血清中C4 含量显著升高(P<0.05)。
3 讨论
3.1 猪血多肽对体外培养建鲤细胞性能的影响
巨噬细胞被认为是宿主防御系统的重要组成部分,是鱼类最重要的免疫活性细胞之一,在识别、吞噬外来病原体,处理和呈递抗原,激活淋巴细胞启动特异性免疫应答以及分泌淋巴因子等方面发挥重要作用[12-14],其活性与功能是反映和评价鱼类免疫水平的重要指标[15]。巨噬细胞有助于内部环境稳态免受外部环境的干扰,活化的巨噬细胞可以释放多种免疫因子,如一氧化氮(NO)、IL-1β、TNF-α和活性氧中间体等物质,在宿主防御病原体和任何类型的浸润细胞(包括癌细胞)中发挥重要作用[15]。Kim 等[16]认为 NO 是由巨噬细胞分泌的,可以通过格里斯(Griess)反应测定亚硝酸盐浓度。需特别指出的是,由巨噬细胞释放的NO是一种高反应性的自由基,在调节各种免疫应答中起重要作用。
本研究试验结果显示,添加40和80μg/mL猪血多肽可以显著或极显著增强建鲤头肾巨噬细胞氮呼吸爆发和氧呼吸爆发活性。Matar等[17]、Meisel等[18]研究均表明,乳酸菌发酵释放的多肽有助于调节淋巴细胞的增殖,调节某些细胞因子的生产,刺激巨噬细胞的吞噬活动。Migliore-Samour等[19]研究表明,由酪蛋白衍生的免疫肽,在对抗由肺炎克雷伯氏菌(Klebsiella pneumoniae)引起的微生物感染中起显著作用,这种作用已经在小白鼠试验中得到证实。这与本试验结果一致,表明猪血多肽有助于提高头肾巨噬细胞的免疫活性,从而增强建鲤自身的非特异性免疫机能。

表5 猪血多肽对建鲤血清免疫指标的影响Table 5 Effects of PSB on serum immune indices of Jian carp ng/mL
3.2 猪血多肽对建鲤血清生化指标的影响
建鲤血清中ALB和TP含量反映鱼体健康、营养以及代谢状况,同时也间接反映机体非特异性免疫水平的高低[20]。TP主要是由ALB和球蛋白(GLB)组成的,血清TP含量高表明机体蛋白质代谢旺盛,有利于机体对蛋白质的吸收和利用,同时可以降低饲料消耗。ALB是脊椎动物血浆中含量丰富且容易纯化的一种蛋白质,是血液系统的重要成分,能够结合和运输多种内源性以及外源性物质,清除自由基,并在抗凝血以及抑制血小板功能等生理过程中发挥一定功能[21]。本试验中,用添加猪血多肽的饲料饲喂建鲤后,测定结果表明血清TP和ALB含量随着猪血多肽添加量的升高而升高,表明猪血多肽对建鲤机体的新陈代谢是有积极影响的,对建鲤抗氧化能力的提升也具有一定的促进作用。赵红霞等[22]研究发现,在饲料中添加谷胱甘肽(GSH)能够增强草鱼蛋白质的合成作用。李清等[23]研究发现,饲料中添加生物活性肽可以显著降低建鲤血清中尿素氮含量,有利于提高蛋白质的合成效率。叶均安等[24]研究发现,谷氨酰胺二肽对于日本对虾TP合成也具有一定促进作用。
AKP是一种在生物体代谢调控中起重要作用的代谢调控酶,直接参与磷酸基团的转移和钙、磷代谢,在吸收和利用营养物质的过程中起重要作用,AKP可以改变病原体表面结构,从而增强机体对病原体的识别和吞噬能力[25]。本试验中,与对照组相比,饲料中添加5.0 g/kg猪血多肽对建鲤血清中AKP活性有显著的增强作用。锌是合成AKP必需的金属离子,猪血多肽有助于促进AKP活性的增强可能与猪血多肽中含有锌离子有关。郭存荣等[26]研究发现,饲料中添加不同浓度的鱼蛋白多肽-锌配合物可以增加罗非鱼血清中AKP活性,并有随着浓度增加而增加的趋势,从而增强其免疫力。
3.3 猪血多肽对建鲤血清中抗氧化酶活性的影响
抗氧化剂包括酶促和非酶促2个部分,在当前科学研究中,SOD、CAT、谷胱甘肽巯基转移酶(GST)、GSH-Px等逐渐引起重视[27]。机体中由SOD、GSH-Px和CAT等组成的抗氧化酶系统,是防自由基损伤的第1道防线,其活性变化能准确反映机体内的抗氧化状态[28-30]。猪血蛋白经菌株发酵,发酵液过滤后可以得到分子质量在2 ku以下的猪血多肽混合物,这种混合物对部分活性氧自由基具有强力的清除作用。有研究表明,经D-半乳糖诱导衰老ICR小鼠,口服摄入水母复合蛋白酶水解制备的胶原蛋白,可增加小鼠血清SOD和GSH-Px活性,同时伴随血清和肝脏中丙二醛(MDA)含量的大量减少[31]。这与本试验的结果是一致的。在本试验中,用含猪血多肽的饲料饲喂建鲤后,建鲤血清中SOD和CAT活性随着猪血多肽添加量的升高呈逐渐升高的趋势,且PSB5组较对照组显著升高,GSH-Px活性也有不同程度的升高,表明猪血多肽能够提高建鲤体内一些抗氧化酶的活性,有助于提高建鲤的抗氧化能力。
3.4 猪血多肽对建鲤血清中免疫因子含量的影响
血清中存在多种的免疫因子,如白介素、肿瘤坏死因子、C3和C4等,测量血清免疫指标是对机体免疫水平的体现[32-34]。巨噬细胞可以释放多种细胞因子,如 NO、IL-1β、TNF-α 和活性氧中间体等物质;C3是血清中含量最高的补体成分,主要由巨噬细胞和肝脏合成;C4是一种多功能β1-球蛋白,在活化补体、促进吞噬、防止免疫复合物沉着和中和病毒等方面发挥作用[35]。TNF-α、IL-1β对于宿主受损或非正常细胞和组织的恢复起一定重要作用。方俊等[36]研究表明,猪血多肽能够提高正常小鼠以及环磷酸酰胺所致免疫功能低下小鼠的免疫功能,并认为猪血多肽能够从多个方面增强小鼠的免疫功能,其中最主要的是增强小鼠巨噬细胞的机能。刘清海等[37]研究表明,黑鲷口服微生物多肽后,血清中C3和C4含量显著升高,多种免疫球蛋白的含量也显著增加。李清等[23]研究也表明,随着生物活性肽用量的增加,鲤鱼血清中免疫球蛋白M(IgM)和C4的含量显著增加。这与本试验的研究结果是一致的,表明猪血多肽可以促进细胞因子的释放,提高建鲤的免疫功能。
4 结论
① 在体外试验中,猪血多肽浓度在40和80μg/mL时,建鲤外周血白细胞的增殖能力显著提高,头肾巨噬细胞的氮呼吸爆发和氧呼吸爆发活性也显著增强。
② 在体内试验中,饲料中添加5.0 g/kg猪血多肽对提高建鲤的抗氧化能力和免疫功能具有很好的效果。
[1] MÖLLER N P,SCHOLZ-AHRENS K E,ROOS N,et al.Bioactive peptides and proteins from foods:indication for health effects[J].European Journal of Nutrition,2008,47(4):171-182.
[2] 魏宗友,潘晓花,季昀.生物活性肽的制备、功能及在动物生产中的应用研究进展[J].中国饲料,2010(23):22-26.
[3] HATTORI M,YAMAJI-TSUKAMOTO K,KUMAGAI H,et al.Antioxidative activity of soluble elastin peptides[J].Journal of Agricultural and Food Chemistry,1998,46(6):2167-2170.
[4] SUETSUNA K,UKEDA H,OCHI H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J].The Journal of Nutritional Biochemistry,2000,11(3):128-131.
[5] SUETSUNA K,UKEDA H.Isolation of an octapeptide which possesses active oxygen scavenging activity from peptic digest of sardine muscle[J].Nippon Suisan Gakkaish,2000,65(6):1096-1099.
[6] 余奕珂,胡建恩,白雪芳,等.以猪血为蛋白源的生物活性肽的研究进展[J].精细与专用化学品,2005,12(18):10-13.
[7] 孙骞,胡鑫,罗永康,等.猪血红蛋白抗氧化肽的酶法制备及其体外抗氧化活力观察[J].中国农业大学学报,2008,13(4):77-81.
[8] 方俊,卢向阳,蒋红梅,等.猪血多肽成分及其清除活性氧的能力观察[J].中国临床康复,2006,10(17):122-124.
[9] BAYNE C J.Pronephric leucocytes of Cyprinus carpio:isolation,separation and characterization[J].Veterinary Immunology and Immunopathology,1986,12(1/2/3/4):141-151.
[10] 曹丽萍,丁炜东,张柳,等.2种多糖对鲤鱼离体培养免疫细胞活性的影响[J].安徽农业大学学报,2008,35(2):219-223.
[11] YIN G J,JENEY G,RACZ T,et al.Effect of two Chinese herbs(Astragalus radix and Scutellaria radix)on non-specific immune response of tilapia,Oreochromis niloticus[J].Aquaculture,2006,253(1/2/3/4):39-47.
[12] SECOMBES C J.Macrophage activation during experimental allergic orchitis in rainbow trout(Salmo gairdneri)[J].Developmental and Comparative Immunology,1986,10(4):539-546.
[13] 聂品.鱼类非特异性免疫研究的新进展[J].水产学报,1997,21(1):69-73.
[14] WEEKS-PERKINS B A,ELLIS A E.Chemotactic responses of Atlantic salmon(Salmo salar)macrophages to virulent and attenuated strains of Aeromonas salmonicida[J].Fish & Shellfish Immunology,1995,5(4):313-323.
[15] WEEKS B A,WARINNER J E,MASON P L,et al.Influence of toxic chemicals on the chemotactic response of fish macrophages[J].Journal of Fish Biology,1986,28(6):653-658.
[16] KIM J K,CHO M L,KARNJANAPRATUM S,et al.In vitro and in vivo immunomodulatory activity of sulfated polysaccharides from Enteromorpha prolifera[J].International Journal of Biological Macromolecules,2011,49(5):1051-1058.
[17] MATAR C,LEBLANC J G,MARTIN L,et al.Biologically active peptides released in fermented milk:role and functions[J].Handbook of Fermented Functional Foods,2003:177-201.
[18] MEISEL H,FITZGERALD R J.Biofunctional peptides from milk proteins:mineral binding and cytomodulatory effects[J].Current Pharmaceutical Design,2003,9(16):1289-1295.
[19] MIGLIORE-SAMOUR D,JOLLÈS P.Casein,a prohormone with an immunomodulating role for the newborn?[J].Experientia,1988,44(3):188-193.
[20] BAYNE C J,GERWICK L.The acute phase response and innate immunity of fish[J].Developmental and Comparative Immunology,2001,25(8/9):725-743.
[21] 张英霞,张云.血清白蛋白的功能及应用[J].海南大学学报:自然科学版,2007,25(3):315-320.
[22] 赵红霞,曹俊明,朱选,等.日粮添加谷胱甘肽对草鱼生长性能、血清生化指标和体组成的影响[J].动物营养学报,2008,20(5):540-546.
[23] 李清,肖调义,毛华明.生物活性肽对鲤鱼血液生理生化指标的影响[J].长江大学学报:自然科学版,2005,2(5):27-29.
[24] 叶均安,王冰心,孙红霞,等.谷氨酰胺二肽对日本对虾血清生化指标、肝胰腺细胞凋亡及肠粘膜形态的影响[J].海洋与湖沼,2009,40(3):347-352.
[25] 明建华,谢骏,徐跑,等.大黄素、维生素C及其配伍对团头鲂感染嗜水气单胞菌后生理生化指标的影响[J].中国水产科学,2011,18(3):588-601.
[26] 郭存荣,郭清泉,方细娟,等.多肽-锌配合物对奥尼罗非鱼生长性能和血清生化指标的影响[J].中国饲料,2010(23):35-37.
[27] KALAISELVI T,PANNEERSELVAM C.Effect of L-carnitine on the status of lipid peroxidation and antioxidants in aging rats[J].The Journal of Nutritional Biochemistry,1998,9(10):575-581.
[28] OZDEN S,CATALGOL B,GEZGINCI-OKTAYOGLU S,et al.Methiocarb-induced oxidative damage following subacute exposure and the protective effects of vitamin E and taurine in rats[J].Food and Chemical Toxicology,2009,47(7):1676-1684.
[29] FREEMAN B A,CRAPO JD.Biology of disease:free radicals and tissue injury[J].Laboratory Investigation,1982,47(5):412-426.
[30] SIES H.Oxidative stress:oxidants and antioxidants[J].Experimental Physiology,1997,82(2):291-295.
[31] JE JY,LEE K H,LEE M H,et al.Antioxidant and antihypertensive protein hydrolysates produced from tuna liver by enzymatic hydrolysis[J].Food Research International,2009,42(9):1266-1272.
[32] CHOKRI M,FREUDENBERG M,GALANOS C,et al.Antitumoral effects of lipopolysaccharides,tumor necrosis factor,interferon and activated macrophages:synergism and tissue distribution[J].Anticancer Research,1989,9(4):1185-1190.
[33] KELLER R,KEIST R,FREI K.Lymphokines and bacteria,that induce tumoricidal activity,trigger a different secretory response in macrophages[J].European Journal of Immunology,1990,20(3):695-698.
[34] YIM C Y,BASTIAN N R,SMITH J C,et al.Macrophage nitric oxide synthesis delays progression of ultraviolet light-induced murine skin cancers[J].Cancer Research,1993,53(22):5507-5511.
[35] PINTO A V,MARTINS P R,ROMAGNOLI G G,et al.Polysaccharide fraction of Agaricus brasiliensis avoids tumor-induced IL-10 production and changes the microenvironment of subcutaneous Ehrlich adenocarcinoma[J].Cellular Immunology,2009,256(1/2):27-38.
[36] 方俊,卢向阳,邱业先,等.猪血多肽的制备及其生物活性研究[C]//中国农业生物技术学会第三届会员代表大会暨学术交流会论文摘要集.北京:中国农业生物技术学会,2006.
[37] 刘清海,冯静,李健,等.微生物多肽对黑鲷免疫和生长的促进作用[J].海洋科学,2000,24(5):11-13.
