中介素通过经典Wnt信号途径促进肝癌细胞增殖
2014-12-03尚海郝志强傅熙博华向东马作红艾福录冯照强王坤李文心李博
尚海,郝志强,傅熙博,华向东,马作红,艾福录,冯照强,王坤,李文心,李博
(辽宁省肿瘤医院肝胆胰科,沈阳 110042)
原发性肝细胞癌是全世界最常见的恶性肿瘤之一,其发病率在恶性肿瘤中排第3位,恶性程度极高,至今尚无有效的治疗方法,5年生存率较低,仅在30%左右。而肝癌细胞的增殖活性与其发生、发展、侵袭、转移密切相关。小分子生物活性肽具有独特的生物学特性,结构简单、组织分布广泛、生物效应多样,在机体调节中具有十分重要的作用。多种细胞因子和小分子多肽在肝癌的发生、发展中起到重要作用。中介素(intermedin,IMD)属于降钙素基因相关肽(calcitonin gene related peptide,CGRP)超家族,于2004年首先在硬骨鱼中发现[1],之后人们又相继在其他物种cDNA基因克隆中发现该活性肽。IMD在体内分布广泛,在肾上腺皮质肿瘤[2]、直结肠癌[3]中的表达均高于正常组织,还可促进血管新生[4],提示IMD与肿瘤的发生、发展相关。本文探讨了IMD在肝细胞癌中的作用及其相关分子机制。
1 材料与方法
1.1 试剂
重组人IMD(IMD1⁃53)及其受体拮抗剂(IMD17⁃47)购于美国Phoenix Pharmaceuticals公司;CCK⁃8细胞增殖检测试剂盒购于日本同仁化学公司;RNA提取及逆转录试剂盒、萤光素酶报告基因检测试剂盒购于美国Promega公司;Taq酶购于北京天根公司;Evergreen荧光染料购于美国Biotium公司;经典Wnt通路阻断剂IWR⁃1⁃endo购于美国Cayman公司;Wnt信号通路活性检测TOPFlash/FOPFlash质粒购于美国Millipore公司;JetPEI转染试剂购于美国Polyplus⁃transfection公司。
1.2 CCK⁃8检测细胞增殖
将处于对数生长期的HepG2细胞以1×104/100 μL接种于平底96孔板,12 h后更换含不同浓度(1~100 nmol/L)IMD的RPMI 1640培养液,或者加入IMD 17⁃47、IWR⁃1⁃endo处理,以不含IMD的RPMI 1640完全培养液作为对照,于48 h取板,每孔加入10 μL CCK⁃8,孵箱内放置1~4 h,使用酶标仪测定450 nm波长的光吸收值[5]。
1.3 RNA提取
采用Promega公司的Trizol试剂:细胞吸出培养液后PBS洗涤,加入1 mL RNAtrip试剂反复吹打30次;移入EP管中,室温放置10 min;加入氯仿0.2 mL,剧烈颠倒混匀15 s,室温放置5 min;4℃、12 000 g离心15 min;小心吸出上层水相转移到新EP管中,加入等体积异丙醇充分混匀,-70℃沉淀2 h;4℃、12 000 g离心10 min。弃上清;用预冷的1 mL 75%乙醇洗涤沉淀,4℃、12 000 g离心10 min;弃上清,用枪头小心洗去附在管壁上的液滴。待沉淀周围透明、中间稍白时,加适量去RNA酶纯水溶解并定量。
1.4 实时定量PCR
逆转录反应为20 mL反应体系,2 mg RNA起始量,使用Promega公司的逆转录试剂盒进行cDNA第一链的合成。实时定量PCR为25 mL反应体系,逆转录反应混合物1 mL为模板。扩增条件:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火58 ℃ 30 s,延伸72℃30 s,延伸72℃5 min。40个循环。以Strata⁃gene Mx3000软件进行分析。引物序列:人c⁃myc:上游 5′⁃TGCTCCATGAGGAGACACC⁃3′,下游 5′⁃CTTTTCCACAGAAACAACATCG⁃3′;人cyclin D1:上游 5′⁃GAAGATCGTCGCCACCTG ⁃3′,下 游 5′⁃GACCTCCTCCTCGCACTTCT⁃3′;人β⁃actin上游 5′⁃ATCTGGCACCACACCTTC⁃3′,下游 5′⁃AGCCAGGT CCAGACGCA⁃3′。
1.5 荧光素酶活性测定
HepG2细胞种植于12孔板中,以JetPEI试剂转染0.5 μg各种质粒后孵育24 h。之后收获细胞并匀浆。然后以Promega公司的Dual⁃LuciferaseTMRe⁃porter Assay System 检测荧光素酶活性[6]。
1.6 统计学分析
2 结果
2.1 IMD呈剂量依赖关系性诱导HepG2细胞增殖
CCK⁃8检测显示,不同浓度(5~100 nmol/L)的IMD作用48 h均可以显著促进HepG2细胞的增殖(P<0.05)。见图1。

图1 IMD呈剂量依赖性促进HepG2细胞增殖Fig.1 IMD promotes the proliferation of HepG2 cells in a dosedependent manner
2.2 IMD促HepG2细胞增殖的作用呈受体依赖性
进一步研究发现,IMD受体的竞争性拮抗剂IMD 17⁃47(100 nmol/L)可显著抑制IMD(10 nmol/L)的促增殖作用。因此,IMD可以呈剂量依赖性促进HepG2细胞的增殖,并且具有受体依赖性。见图2。
2.3 IMD激活HepG2细胞经典Wnt信号通路
我们进一步探讨了IMD促HepG2细胞增殖的可能机制。Wnt信号传导通路在肿瘤细胞的增殖过程中起着非常重要的作用。我们以TOPFlash为报告质粒,FOPFlash为阴性对照,以pRL⁃TK作内参对照,转染6 h后,以IMD(10 nmol/L)处理24 h后进行双荧光素酶活性检测,结果显示IMD刺激下TOP⁃Flash/FOPFlash比值明显高于对照组(P<0.05,图3A),下游靶基因c⁃myc与cyclin D1 mRNA水平明显上调(P<0.05,图3B)。说明IMD作用下经典Wnt信号途径被激活,转录活性明显增强。
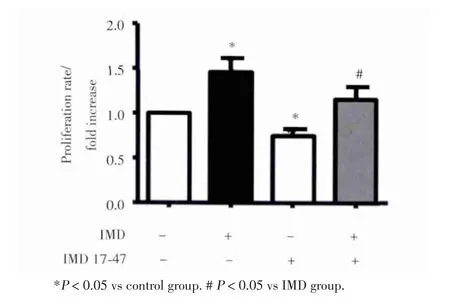
图2 IMD受体拮抗剂抑制IMD对HepG2细胞的促增殖作用Fig.2 The proliferation of HepG2 cells induced by IMD was inhibitedby IMD receptor antagonist
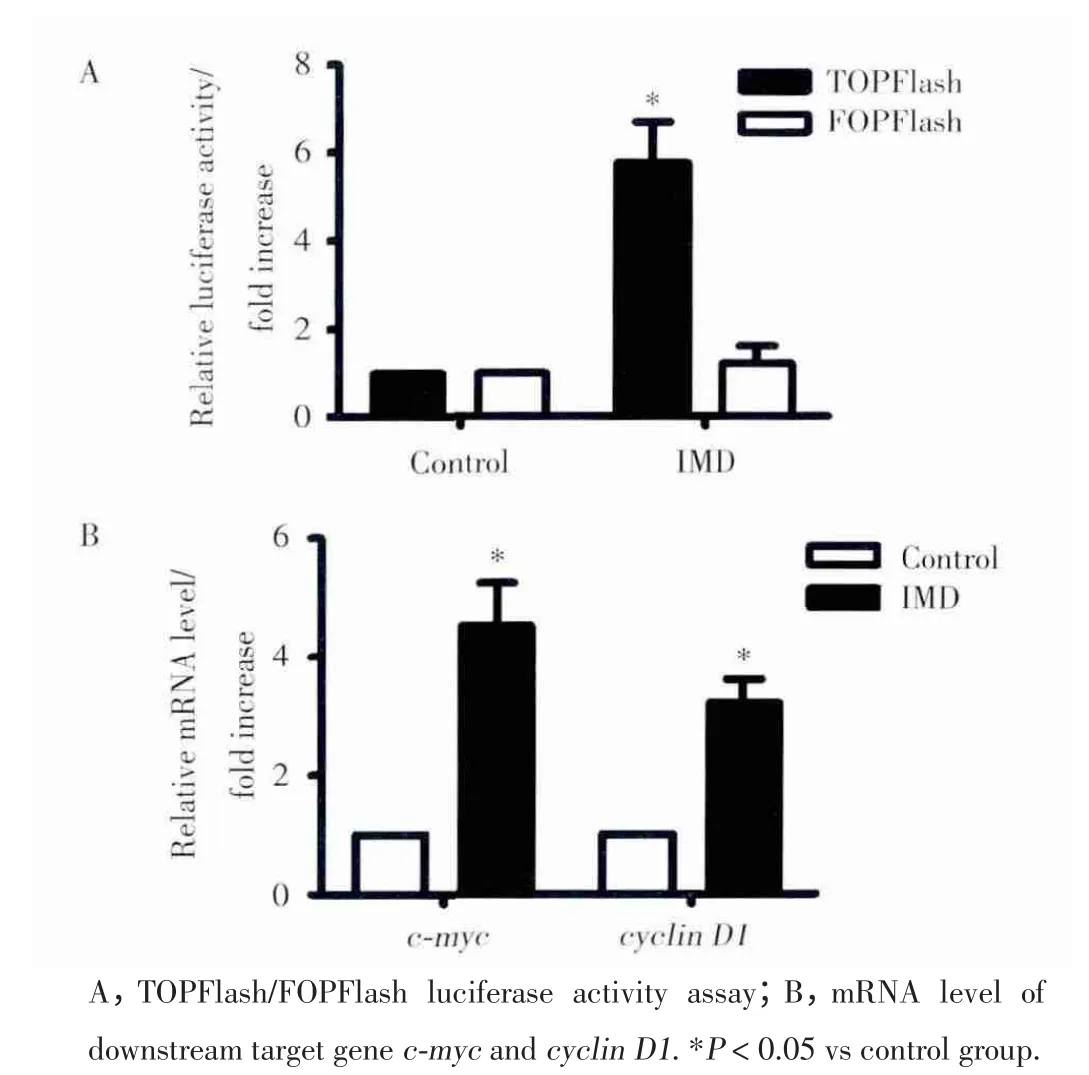
图3 IMD激活经典Wnt信号通路Fig.3 IMD activates classical Wnt signaling pathway
2.4 Wnt信号通路抑制剂IWR⁃1⁃endo可在一定程度上抑制由IMD导致的HepG2细胞增殖
给予Wnt信号通路抑制剂IWR⁃1⁃endo(25 μmol/L)提前处理细胞1 h后,可以显著抑制IMD(10 nmol/L)诱导的HepG2细胞增殖。因此,IMD可能通过Wnt信号通路促进HepG2细胞的增殖。见图4。
3 讨论
本研究首次证实了人IMD可通过经典Wnt信号途径促进HepG2肝癌细胞的增殖。依据如下:(1)IMD处理HepG2肝癌细胞可直接引起其增殖;(2)IMD受体竞争性拮抗剂IMD17⁃47可阻断上述作用;(3)IMD可激活经典Wnt信号转录活性及下游靶基因mRNA水平;(4)阻断Wnt信号途径可在一定程度上抑制由IMD导致的HepG2细胞增殖。
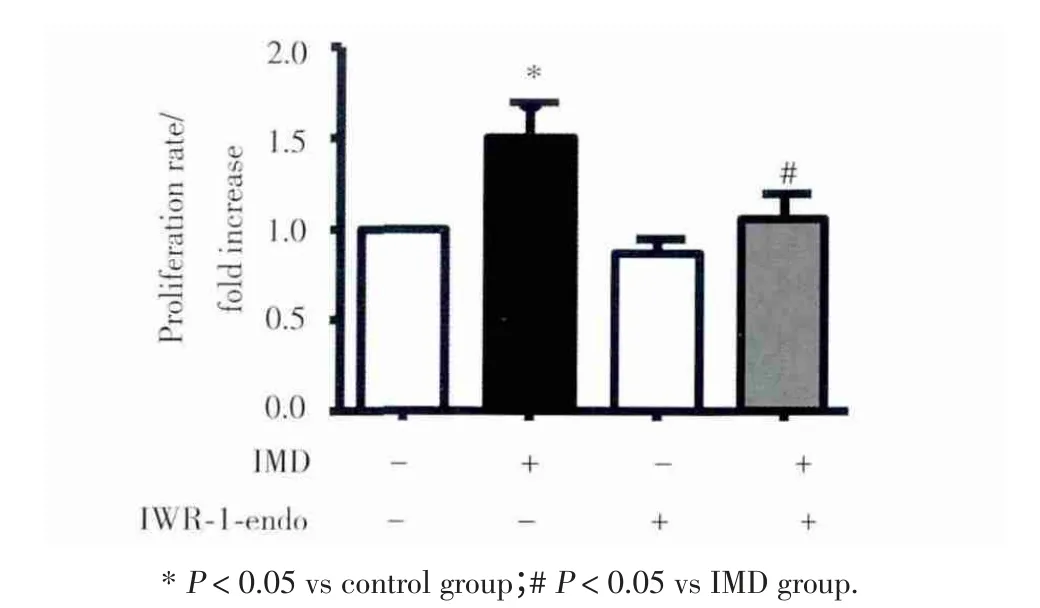
图4 Wnt信号通路抑制剂IW R⁃1⁃endo抑制IMD对HepG 2细胞的促增殖作用Fig.4 Inhibition of Wnt signaling pathway impairs the effects ofIMD⁃induced HepG2 cell proliferation
IMD是CGRP超家族成员,与肾上腺髓质素(ad⁃renomedullin,AM)的氨基酸结构有30%相似性,也被称为AM2。其前体由148个氨基酸残基组成,有多个蛋白酶切位点,在体内可被剪切为IMD 1⁃47、IMD 8⁃47及IMD1⁃53三个活性片段[7]。CGRP家族通过与降钙素受体样受体/受体活化修饰蛋白复合物共同受体(calcitonin receptor⁃like receptor/receptor activity⁃modifying protein receptor complexes,CRLR/RAMPs)相结合发挥效应[8]。CGRP 主要作用于RAMP1,AM作用于RAMP2/3,而IMD无选择性地作用于RAMP1/2/3,因此IMD可能具有更广泛的生物学效应[1]。IMD在内环境稳态调节以及高血压、心肌缺血、心功能衰竭和肾功能衰竭等疾病过程中的作用已有很多研究。虽然研究中发现IMD在肾上腺皮质肿瘤、直结肠癌、胰腺癌、乳腺癌中的表达均高于正常对照组,但是IMD在肿瘤,尤其是肝癌发生发展中的作用,尚不明确。我们的研究表明,IMD有促进HepG2肝癌细胞增殖的作用(图1),且这种作用是通过受体依赖性实现的(图2)。自分泌假说提出,很多肿瘤细胞可通过对其本身分泌的生长因子的反应,从而逃离生长抑制[9,10]。我们的研究也表明,在未给予外源性IMD刺激的条件下,IMD受体拮抗剂IMD17⁃47仍然可以抑制基础水平下HepG2细胞的增殖(图2),提示HepG2细胞本身即可以表达和分泌IMD,与Guo等[11]的研究结果相吻合。
Wnt信号传导通路在肿瘤细胞的增殖过程中起着非常重要的作用,经典Wnt信号通路的激活有赖于β⁃catenin在细胞质中异常蓄积而后入核,通过与T细胞因子/淋巴增强因子(T⁃cell factor/lymphoid en⁃hancing factor,TCF/LEF)形成转录因子复合体,调控下游靶基因如cyclin D1和c⁃myc的转录表达[12,13]。研究表明,30%~40%的肝癌发生Wnt通路的失调或β⁃catenin基因突变;62%~70%的肝癌出现胞质和胞核的β⁃catenin表达,在分化程度较差的肝癌细胞核内可以看到β⁃catenin的表达更明显[14~16]。c⁃myc是第一个被发现的β⁃catenin/TCF复合物的下游靶基因,在细胞凋亡、增殖、代谢、DNA修复以及血管形成等各种生物学过程中发挥关键作用[17];cyclin D1基因是β⁃catenin/TCF途径的另一个直接靶基因,若持续高水平表达,可使细胞停留于细胞周期的S期,过度增殖进而发生恶性转化[18]。我们的研究中,TOPFlash/FOPFlash荧光素酶检测结果表明,IMD可增强β⁃catenin/TCF的转录活性;且Wnt下游靶基因cyclin D1和c⁃myc的转录表达明显上调。提示IMD激活Wnt信号通路,进而促进HepG2细胞的增殖。
总之,本研究发现,作为CGRP超家族成员,IMD通过与受体结合,激活Wnt信号通路发挥其促肝癌细胞增殖作用,为肝癌的治疗提出新的思路。IMD拮抗剂可能作为抗肝癌的治疗手段之一。
[1]Takei Y,Inoue K,Ogoshi M,et al.Identification of novel adreno⁃medullin in mammals:a potent cardiovascular and renal regulator[J].FEBS Lett,2004,556(1⁃3):53-58.
[2]Morimoto R,Satoh F,Murakami O,et al.Expression of adrenomedul⁃lin 2/intermedin in human adrenal tumors and attached non⁃neoplas⁃tic adrenal tissues[J].J Endocrinol,2008,198(1):175-183.
[3]Hikosaka T,Tsuruda T,Nagata S,et al.Adrenomedullin production is increased in colorectal adenocarcinomas;its relation to matrix me⁃talloproteinase⁃9[J].Peptides,2011,32(9):1825-1831.
[4]Smith RS Jr,Gao L,Blesdsoe G,et al.Intermedin is a new angiogen⁃ic growth factor[J].Am J Physiol Heart Circ Physiol,2009,297(3):H1040-H1047.
[5]Xu Y,Pang X,Dong M,et al.Nesfatin⁃1 inhibits ovarian epithelial carcinoma cell proliferation in vitro[J].Biochem Biophys Res Com⁃mun,2013,440(4):467-472.
[6]Zhang Y,Zhang S,Shang H,et al.Basic fibroblast growth factor up⁃regulates adrenomedullin expression in ovarian epithelial carcinoma cells via JNK⁃AP⁃1 pathway[J].Regul Pept,2009,157(1⁃3):44-50.
[7]Bell D,McDermott BJ.Intermedin(adrenomedullin⁃2):a novel counter⁃regulatory peptide in the cardiovascular and renal systems[J].Br J Pharmacol,2008,153 Suppl 1:S247-S262.
[8]Roh J,Chang CL,Bhalla A,et al.Intermedin is a calcitonin/calcito⁃nin gene⁃related peptide family peptide acting through the calcito⁃nin receptor⁃like receptor/receptor activity⁃modifying protein recep⁃tor complexes[J].J Biol Chem,2004,279(8):7264-7274.
[9]Billottet C,Janji B,Thiery JP,et al.Rapid tumor development and potent vascularization are independent events in carcinoma produc⁃ing FGF⁃1 or FGF⁃2[J].Oncogene,2002,21(53):8128-8139.
[10]Di Blasio AM,Cremonesi L,Vigano P,et al.Basic fibroblast growth factor and its receptor messenger ribonucleic acids are ex⁃pressed in human ovarian epithelial neoplasms[J].Am J Obstet Gynecol,1993,169(6):1517-1523.
[11]Guo X,Schmitz JC,Kenney BC,et al.Intermedin is overexpressed in hepatocellular carcinoma and regulates cell proliferation and survival[J].Cancer Sci,2012,103(8):1474-1480.
[12]Moon RT,Bowerman B,Boutros M,et al.The promise and perils of Wnt signaling through beta ⁃catenin[J].Science,2002,296(5573):1644-1646.
[13]Clevers H.Wnt/beta⁃catenin signaling in development and disease[J].Cell,2006,127(3):469-480.
[14]Wong CM,Fan ST,Ng IO.beta⁃Catenin mutation and overexpres⁃sion in hepatocellular carcinoma:clinicopathologic and prognostic significance[J].Cancer,2001,92(1):136-145.
[15]Devereux TR,Stern MC,Flake GP,et al.CTNNB1 mutations and beta⁃catenin protein accumulation in human hepatocellular carci⁃nomas associated with high exposure to aflatoxin B1[J].Mol Car⁃cinog,2001,31(2):68-73.
[16]Hsu HC,Jeng YM,Mao TL,et al.Beta⁃catenin mutations are asso⁃ciated with a subset of low⁃stage hepatocellular carcinoma negative for hepatitis B virus and with favorable prognosis[J].Am J Pathol,2000,157(3):763-770.
[17]Bienz M,Clevers H.Linking colorectal cancer to Wnt signaling[J].Cell,2000,103(2):311-320.
[18]Tetsu O,McCormick F.Beta⁃catenin regulates expression of cyclin D1 in colon carcinoma cells[J].Nature,1999,398(6726):422-426.
