CRK1基因缺失对白念珠菌形态、黏附、生物被膜的影响
2014-09-11赵静刘继勇张海曹永兵郑庆虎吴建华
赵静 刘继勇 张海 曹永兵 郑庆虎 吴建华
(1.上海长海医院皮肤科,上海 200433;2.第二军医大学长海医院药材科,上海 200433;3.第二军医大学肝胆医院药材科,上海 200433;4.第二军医大学药学院药理学教研室,上海 200433;5.解放军153中心医院皮肤科,郑州 450042)
白念珠菌是人体常见的条件致病真菌,可在黏膜上寄生或增殖,引起口腔炎、食道炎、阴道炎等疾病。在免疫力低下的人群中还可侵袭各种黏膜屏障,进入血液循环,引起严重的播散性念珠菌病,常常危及生命[1],因而,与其致病相关的蛋白和基因,如与黏附相关的KRE、ALA、ALS家族等,已成为国内外研究的热点。早在1999年,中科院上海生化研究所陈江野教授及其团队,利用寡聚核苷酸筛选白念珠菌MAPK相关蛋白激酶基因,得到了CRK 1(CDC2-related protein kinase 1)基因,同时利用同源重组原理,敲除了CRK 1双拷贝基因片段,构建CRK 1纯合缺失株,发现CRK 1基因的缺失影响到白念珠菌的生长速度、絮状生长和形态发生[2]。近年来,许多研究表明:白念珠菌的毒力因素包括黏附、侵袭、利于侵入的酶、表型转换及生物被膜的形成等[3]。本文拟在前人研究的基础上,进一步证实CRK 1基因对白念珠菌形态发生的影响,同时研究CRK 1基因对白念珠菌黏附及生物被膜形成的影响,进一步探讨CRK 1基因在白念珠菌发病机制中的作用。
1 材料和方法
1.1 材料
菌株及细胞 本研究所采用的白念珠菌标准株SC5314由第二军医大学药理教研室提供,基因敲除菌Δcrk 1[2]由中科院上海生化研究所陈江野教授馈赠。实验用Caco-2细胞购于中国科学院上海细胞库。
主要试剂 MEM培养基、胎牛血清、PBS(Hyclone公司),胰蛋白酶、青霉素、链霉素、MTT、DMSO(Sigama公司),RPMI-1640液体培养基 (Gibico公司),SDA培养基及YEPD液体培养基根据文献配制和保存。
1.2 方法
白念珠菌菌悬液的制备 将冻存的菌株解冻接种于沙氏培养基复苏、分离纯化,挑取单菌落将其转种于YPED液体培养基中,30℃摇床,200 r/min,培养过夜,取活化后的菌液10 μL,加入YEPD培养基1 mL,30℃摇床培养16 h,收集菌体、PBS缓冲液清洗3次后,根据实验要求稀释,采用血球计数板计数法将菌液稀释成不同浓度。
将处于对数生长期的上述两种菌 (Δcrk 1及SC5314)分别用10%FBS及RPMI-1640培养基稀释成106CFU/mL,分别取200 μL加入玻璃管内,37℃,200 r/min 摇床,2 h 后取出,取10 μL 加入载玻片,再加盖玻片,光学显微镜200倍镜观察,计算每个视野菌丝相和酵母相的数目,每张玻片取5个视野,重复3次,按菌丝形成率=菌丝数/(酵母数+菌丝数)×100%,实验方法参考Jayant等[4]。
CRK 1基因缺失对白念珠菌黏附的影响 肠黏膜模型的建立 将处于对数生长期的Caco-2细胞按1×105cells/mL接种于96孔板上,每孔100 μL,于37℃、5%CO2培养箱中培养 (第1周隔天换液1次,之后每天换液),显微镜下观察细胞生长状态,到第21天形成类似于肠黏膜上皮的紧密连接[5]。
不同时间Δcrk 1菌及标准菌SC5314对体外培养的肠黏膜黏附力的差异 将上述两种菌用MEM培养基 (不含双抗)稀释成105CFU/mL备用,然后将培养好的单层肠黏膜上的培养基吸去,用PBS洗3遍,加入100 μL上述两种菌悬液,于37℃、5%CO2培养箱中分别培养 30 min、60 min、90 min、120 min,用PBS液洗5次,去除未黏附的菌,加入1%TritonX-100 50 μL于各孔,置室温下10 min,当细胞被裂解后,加入50 μL PBS缓冲液终止裂解,混匀各孔悬液,在 60 min、90 min、120 min 各时间点,用PBS稀释4倍后、各取50 μL均匀的涂于SDA培养板上,于37℃培养24 h后,计算菌落数即为黏附数,黏附率=CFU(用Triton处理后的菌落数)/CFU(最初每孔菌落计数)×100%。每个时间点重复5次。
CRK 1基因的缺失对白念珠菌生物膜形成的影响 生物膜的制备[4]取100 μL菌悬液 (1.0×106个细胞)接种于96孔细胞培养板中,37℃培养2 h(黏附阶段)后弃去培养基,PBS洗3次,加入100 μL RPMI-1640培养基,作为培养的0点,37℃继续培养,每24 h更换1次培养基,共培养48 h。同时在倒置显微镜下观察生物膜的形态。
MTT法检测CRK 1基因的缺失对白念珠菌生物膜形成的影响 生物膜在37℃培养48 h后,弃去培养液,PBS洗涤3次,每孔加入100 μL 1 mg/mLMTT,37℃避光孵育4 h后弃去上清,每孔加入150 μL DMSO,15 min后用酶标仪测定其在490 nm波长处的OD值。每组设6个重复孔,重复3次。
结晶紫检测CRK 1基因的缺失对白念珠菌生物膜形成的影响 如前所述:生物膜在37℃培养48 h后,弃去培养液,PBS洗涤3次,加入10 μL 99%甲醇作用15 min后,将上清吸弃,晾干,加入100 μL 0.02%结晶紫作用15 min,蒸馏水洗3次,加入150 μL 33%醋酸溶液,用酶标仪于620 nm处读数。
1.3 统计学处理
实验结果用±s表示,用SPSS 19.0统计学软件包进行分析,两组间比较用成组t检验,P<0.05为差异有显著性意义。
2 结 果
2.1 CRK 1基因的缺失对白念珠菌形态发生的影响(见图1)
与SC5314相比,Δcrk 1菌分别在10%胎牛血清和RPMI-1640培养条件下形成菌丝能力均较弱,两者之间有统计学差异 (P<0.05,见表1)。
2.2 CRK 1基因的缺失对白念珠菌黏附的影响(见图2)
Δcrk 1菌及标准菌SC5314对肠黏膜的黏附数并不是随时间的延长而增多,两种菌均是在60 min黏附数达最高,达到饱和,60 min以后逐渐降低并保持平稳。且在60 min、90 min、120 min时,标准菌SC5314比Δcrk 1菌的黏附数明显增多,具有统计学差异 (P<0.01,见表2)。
金钻明就读的高中——洋泾高级中学也非常注重对学生综合素质和学习兴趣的培养。当时,浦东新区物理教研室组织安排了跨校的物理辅导班,这个辅导班选用新区的物理“尖子老师”来给学生授课,并且不以考试、竞赛为目的,只是为了培养学生的兴趣、开拓视野。因此很多学生都喜欢这个辅导班,金钻明也是受惠者之一。至今让金钻明难忘的是他参加过的一个激光兴趣班,在那里,他参与了激光全息照相,粗略地知道了信息如何能立体地存储下来。在初步感受到激光魅力的同时也埋下了科学的种子,他最终如愿收到了上海大学电子信息科学与技术专业的录取通知书。
2.3 Δcrk 1菌与其标准菌SC5314形成生物膜的
形态学观察(见图3)
在倒置显微镜下观察白念珠菌生物膜形成的情况,标准菌SC5314可见酵母细胞菌和假菌丝在细胞外基质中形成密集的生物膜;CRK 1基因缺失菌生物膜稀疏,主要由芽生孢子组成,见少量芽管样结构,但未形成典型菌丝及假菌丝。
2.4 MTT法及结晶紫法检测CRK 1基因的缺失对白念珠菌生物膜形成的影响
通过MTT法及结晶紫法两种方法证实了,在经48 h培养后,CRK 1基因缺失菌与其标准菌SC5314相比,形成生物膜的能力差,两者比较有统计学差异 (P<0.05,见表3)。

图1 两种菌在不同培养条件下的镜下观 (×200):a,b所示CRK 1基因缺失菌;a.10%胎牛血清37℃、200 r/min、2 h,b.RPMI-1640培养基37℃、200 r/min、2 h;Δcrk 1菌在两种培养条件下,主要以酵母态存在,可见少量的出芽和延伸的菌丝;c,d所示标准菌SC5314;c.10%胎牛血清37℃、200 r/min、2 h,d.RPMI-1640培养基37℃、200 r/min、2 h;标准菌SC5314在两种培养条件下,形成的出芽和菌丝的量多于a,b 图2 黏附于肠黏膜上皮的菌落数(×200):与SC5314(b)相比,在同样的培养时间和条件下,Δcrk 1(a)形成的菌落小且数量也少 图3 培养48 h生物被膜的显微镜下观(倒置显微镜×200):a.Δcrk 1菌,生物膜较为稀疏,可见较多出芽孢子及伸长的假菌丝,互相交错,但未完全铺满基底;b.SC5314,可见大量的酵母细胞菌和伸长的假菌丝在细胞外基质中形成密集的生物膜Fig.1 The Δcrk 1 and SC5314 in different conditions under the microscopic view Fig.2 The Δcrk 1(a)and SC5314(b)adhesion colony count in the intestinal mucosa epithelial Fig.3 Biofilm were observed microscopically(inverted microscope×200)
4 讨 论
白念珠菌(Candida albicans)是一种多态性真菌,能以椭圆形的酵母态、细胞延长形成的假菌丝存在[6]。这些形态在它的生命中均发挥重要的功能。从酵母态向菌丝态转化是白念珠菌的重要特征。对于不同形态在致病中的作用,目前存在争议。但是,大多数学者认为:菌丝态的侵袭力更强[7]。研究发现,多种因素介导了白念珠菌的形态发生,如:血清或葡萄糖、CO2、温度等[8],另外,已有证据表明,有些基因的表达调控直接影响了白念珠菌的形态发生和毒力表现,如:ALS 3、HWP 1、ECE 1和HYR 1等[9]。
大量的研究表明[10]:MAPK(促分裂原活化蛋白激酶)信号通路及细胞周期依赖性激酶在白念珠菌菌丝的形成中发挥了关键作用。早在1996年,中科院上海生化研究所陈江野教授及其团队,在筛选白念株菌MAPK相关蛋白激酶基因的过程中,得到CRK 1(CDC2-related protein kinase 1)基因。研究发现:Crk1蛋白与酿酒酵母的Sgv1蛋白及人类Pk11/Cdk9蛋白相似,在多种培养条件下,如:YPD培养基、Lee培养基等,CRK 1基因敲除菌形成菌丝的能力较野生菌弱[3]。同样,在我们的研究中也发现:在 RPMI-1640培养基、PH7.0、37℃培养条件下,CRK 1基因敲除抑制了菌丝的生成。另外,我们都知道,血清能促进酵母菌向菌丝态的转化,而在我们的实验中发现,在含10%血清的培养基、PH7.0、37℃培养条件下,CRK 1基因敲除菌较野生菌形成菌丝的能力弱。我们的实验结果与陈江野教授[3]的结果一致,即:CRK 1基因敲除菌在多种培养条件下总是抑制白念菌丝的形成,更充分地说明了:CRK 1基因参与了白念菌丝形成的调节。这可能是由于CDC2家族的蛋白激酶在真核生物周期的调控中起着关键作用,CRK 1基因作为CDC2相关的蛋白激酶,可能也参与细胞周期的调控。
表1 Δcrk 1及SC5314在不同培养条件下形成菌丝的差异(±s,n=15)Tab.1 C.albicans Δcrk 1 and SC5314 have different abilities to form hyphae at different conditions

表1 Δcrk 1及SC5314在不同培养条件下形成菌丝的差异(±s,n=15)Tab.1 C.albicans Δcrk 1 and SC5314 have different abilities to form hyphae at different conditions
注:*.与标准菌SC5314比较,P <0.05
组别菌丝形成率(%)10%胎牛血清RPMI-1640 SC5314 48.7 ±4.7 49.7 ±4.5 Δcrk 1 27.5 ±2.8 29.2 ±5.9 P 值 0.034* 0.031*
表2 Δcrk 1及SC5314在不同时间点对肠黏膜的黏附差异(CFU)(±s,n=5)Tab.2 C.albicans Δcrk 1 and SC5314 have different adhensions with human intestinal epithelial cells in vitro at differen time
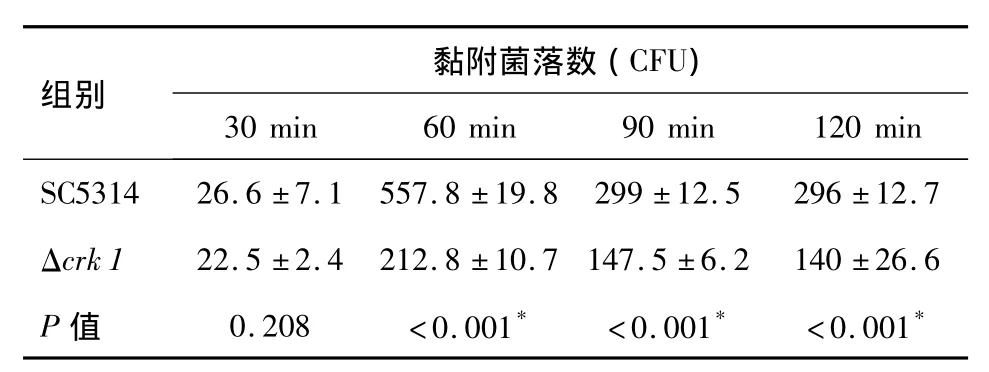
表2 Δcrk 1及SC5314在不同时间点对肠黏膜的黏附差异(CFU)(±s,n=5)Tab.2 C.albicans Δcrk 1 and SC5314 have different adhensions with human intestinal epithelial cells in vitro at differen time
注:*.与标准菌SC5314比较,P <0.001
黏附菌落数(CFU)组别30 min 60 min 90 min 120 min SC5314 26.6 ±7.1 557.8 ±19.8 299 ±12.5 296 ±12.7 Δcrk 1 22.5 ±2.4 212.8 ±10.7 147.5 ±6.2 140 ±26.6 P 值 0.208 <0.001* <0.001* <0.001*
表3 MTT法及结晶紫法比较Δcrk 1菌及标准菌SC5314对白念珠菌生物膜形成的差异(±s,n=18)Tab.3 C.albicans Δcrk 1 and SC5314 have different abilities to form biofilm tested by MTT and crystal violet assay

表3 MTT法及结晶紫法比较Δcrk 1菌及标准菌SC5314对白念珠菌生物膜形成的差异(±s,n=18)Tab.3 C.albicans Δcrk 1 and SC5314 have different abilities to form biofilm tested by MTT and crystal violet assay
注:*.与标准菌SC5314比较,P <0.05
试验分组不同波长的OD值OD490(MTT法) OD620(结晶紫法)SC5314 1.422 ±0.466 0.75 ±0.085 Δcrk 1 1.188 ±0.248 0.302 ±0.034 P 值 0.041* 0.012*
白念珠菌的毒力因素包括黏附、侵袭、利于侵入的酶、表型转换及生物被膜的形成等[11],黏附是其致病的前提,也是形成集落并入侵人体的第一步,因而,我们进一步观察了CRK 1基因对白念珠菌黏附的影响。我们利用Caco-2细胞体外模拟肠黏膜上皮,具有相对简单、重复性好的优点,且大量的实验已证实这个模型与人肠黏膜结构相似[12]。实验结果表明:Δcrk 1菌及标准菌SC5314对肠黏膜的黏附数并不是随时间的延长而增多,两种菌均是在60 min黏附数最高,达到饱和,60 min以后逐渐降低并保持平稳。且在60 min、90 min、120 min时,标准菌 SC5314 比 Δcrk 1菌的黏附数明显增多,具有统计学差异。研究发现,黏附的程度常依赖于微生物、宿主或无生命物质表面的特征,如:微生物细胞表面的疏水结构和细胞壁的组成等,疏水性越强越有利于黏附,白念珠菌菌丝态表面有大量的疏水结构,所以更有利于黏附[11]。推测CRK 1基因可能参与了白念珠菌细胞表面疏水结构的调控。
生物被膜的形成是各种念珠菌潜在的毒力因子,它可通过限制抗真菌药进入生物被膜,从而对药物产生耐药。同时,生物被膜可为病原微生物提供“保护所”,使其免受宿主巨噬细胞的吞噬作用[13]。目前已成为临床亟待解决的关键问题。如上图3所示:CRK 1基因缺失菌形成的生物膜较为稀疏,可见较多出芽孢子及伸长的菌丝,互相交错,但未完全铺满基底。而标准菌SC5314可见大量酵母细胞菌和假菌丝在细胞外基质中形成密集的生物膜。体外实验发现,生物被膜形成的早期,酵母菌黏附于宿主表面并逐渐向菌丝态转化,这是生物被膜形成的关键一步。Nobile等[14]发现,与正常白念珠菌相比,缺乏形成菌丝态的突变株黏附力降低,难于形成空间的三维结构。
以上我们的研究发现,CRK 1基因缺失影响了白念珠菌菌丝态的形成,同时对白念珠菌黏附及生物被膜的形成都有抑制作用。因此,我们可以推测,CRK 1基因在白念珠菌的致病力方面发挥重要的作用,但是,其具体的信号通路值得我们进一步的深入研究。
5 致 谢
感谢上海生化研究所陈江野教授惠赠CRK 1基因敲除菌。
[1]Richter SS,Galask RP,Messer SA,et al.Antifungal susceptibilities of Candida species causing vulvo vaginitis and epidemiology of recurrent cases[J].Clin Microbiol,2005,43(5):2155-2162.
[2]王勤,周颂,陈江野.白色念珠菌CRK1基因的敲除及其功能研究[J].生物化学与生物物理学报,1999,31(5):545-552.
[3]Francois L,Mayer,Duncan Wilson,et al.Candida albicanspathogenicity mechanisms[J]Virulence,2013,4(2):119-128.
[4]Jayant SR,Ravikumar BS,Nitin MC,et al.Terpenoids of plant origin inhibit morphogenesis,adhesion,and biofilm formation byCandida albicans[J].Biofouling,2013,29(1):87-96.
[5]Stetinova V,Smetanova L,Kholova D,et al.Transepithelial transport of ambroxol hydrochloride across human intestinal Caco-2 cell monolayers[J].Gen Physiol Biophys,2009,28(3):309-315.
[6]Berman J,Sudbery PE.Candida albicans:a molecular revolution built on lessons from budding yeast[J].NatRev Genet,2002,3(12):918-930.
[7]Munro CA,Bates S,Buurman ET,et al.Mnt1p and Mnt2p ofCandida albicansare partially redundant alpha-1,2-mannosyltransferases that participate in O-linked mannosylation and are required for adhesion and virulence.[J].J Biol Chem,2005,280(2):1051-1060.
[8]Sudbery PE.Growth ofCandida albicanshyphae[J].Nat Rev Microbiol,2011,9(10):737-748.
[9]Nobile CJ,Solis N,Myers CL,et al.Candida albicanstranscription factor Rim101 mediates pathogenic interactions through cell wall functions[J].Cell Microbiol,2008,10(11):2180-2196.
[10]Chen J,Zhou S,Wang Q,et al.Crk1,a novel Cdc2-related protein kinase,is required for hyphal development and virulence inCandida albicans[J].Mol Cell Biol,2000,20(3):8696-8708.
[11]Camacho DP,Gasparetto A,Svidzinski TI.The effect of chlorhexidine and gentian violet on the adherence ofCandidaspp.to urinary catheters[J].Mycopathologia,2007,163(5):261-266.
[12]Clayburgh DR,Shen L,Turner JR,et al.A porous defense:the leaky epithelial barrier in intestinal disease [J].Lab Invest,2004,84(3):282-291.
[13]Mukherjee PK,Chandra J.Candida biofilm resistance[J].Drug Resist Updat,2004,7(4-5):301-309.
[14]Nobile CJ,Nett JE,Andes DR,et al.Function ofCandida albicansadhesin Hwp1 in biofilm formation[J].Eukaryot Cell,2006,5(10):1604-1610.
