条件启动子pCTR4在隐球菌基因表达调控中的应用
2014-09-11赵静宇法振宗方伟孟云芳张超周兆婧潘炜华廖万清
赵静宇 法振宗 方伟 孟云芳 张超 周兆婧 潘炜华 廖万清
(上海长征医院皮肤病与真菌病研究所全军真菌病重点实验室第二军医大学附属长征医院皮肤科,上海 200003)
新生隐球菌(Cryptococcus neoformans)是临床上最常见的侵袭性真菌感染病原菌之一,可感染免疫功能抑制和免疫功能正常的宿主,主要引发具有致命威胁的脑膜脑炎。近年来,其发病率呈上升趋势,仅在HIV 感染人群中每年全球约有1 000 000例新发病例,对人民健康造成了极大的危害[1]。
随着隐球菌多个致病菌株的全基因组测序工作的完成,其生物学与致病机制研究已迈入了一个全新的研究阶段。鉴于其明确的遗传学背景、健全的分子生物学工具以及强健的动物模型,隐球菌已渐渐发展成为病原真菌分子致病机制研究的模式酵母[2]。条件诱导基因表达系统是病原真菌功能基因组学研究的重要分子生物学工具,对于鉴定致死性关键基因、研究基因表达水平与功能效应关系必不可少。目前,国外同行在半乳糖诱导启动子pGAL7、交配诱导启动子pMFα1以及铜离子抑制启动子pCTR4研究方面取得了重要的研究进展[3-5]。以此为基础,我们通过重建条件启动子pCTR4质粒,应用同源重组方法成功对隐球菌泛素编码基因UBI 1实现了条件诱导性调控表达,填补了国内隐球菌基因调控研究领域的空白,并为相关基因的后续功能研究奠定了基础。
1 材料与方法
1.1 实验材料
菌株与质粒 新生隐球菌格鲁比变种标准株H99(VN I型)由美国John Perfect教授惠赠提供,受体菌大肠杆菌Top10为本实验室保存,重建株ZJY01、ZJY02、 ZJY03 (CTR 4(p)-UBI 1::NEO)为本文中新构建。质粒pJAF-1(含NEO抗性基因)、pNAT/CTR4-2(含铜离子抑制性启动子pCTR4)均由美国 John Perfect教授惠赠[6-7]。
培养基与主要试剂 基础培养基为YPD(隐球菌)和LB(大肠杆菌),以此为基础分别添加遗传霉素G418 200 mg/L、羧苄青霉素100 mg/L作为筛选培养基。山梨醇、硫酸铜、溴烷铵CTAB、浴酮灵二磺酸BCS等主要试剂均购自Sigma-aldrich公司,rTaq、PrimeSTAR 等DNA 聚合酶、DNA ladder等PCR相关试剂购自Takara公司。凝胶回收试剂盒、质粒抽提试剂盒、酵母基因组和RNA抽提试剂盒、TA克隆试剂盒、cDNA合成和Real Time PCR试剂盒购自北京全式金生物技术有限公司。
主要仪器 电泳凝胶成像系统、Eppendorf超速离心机、BioRad基因枪、BioRad PCR仪、分光光度计等。
1.2 条件启动子重组片段及其质粒的构建
套叠PCR构建NEO/CTR4重组片段 第1轮PCR,以质粒pJAF-1为模板,引物1、2合成抗性基因NEO片段;以质粒pNAT/CTR4为模板,引物3、4合成铜离子抑制性启动子pCTR4片段。第2轮PCR,以上两个PCR反应产物纯化后的基因片段(相同摩尔浓度)为模板,引物1、4合成并扩增基因片段NEO/CTR4重组片段(见图1)。所有引物均由Prime3软件设计完成,信息详见表1。

表1 引物列表Tab.1 Primers list
构建重组质粒pNEO/CTR4 将上述PCR反应产物电泳后的目标条带以凝胶回收试剂盒割胶纯化回收,分光光度计测量回收后DNA的浓度。将纯化后的基因片段NEO/CTR4经rTaq酶处理添加"A"尾后,经T-A克隆进入pMD18-T载体 (T-A克隆试剂盒),构建重组质粒pNEO/CTR4。取重组质粒10 μL加入至100 μL大肠杆菌感受态细胞Top10,冰浴30 min后42℃热激45 s,再次冰浴5 min后加入LB培养基890 μL,置入37℃摇床孵育2 h(180 r/min);后以3 000 r/min离心5 min弃上清并加入200 μL新鲜LB液体,悬浮混匀后涂板LA(LB+羧苄青霉素100 mg/L),置入37℃培养箱孵育16 h。
重组质粒验证 挑取LA固体培养基上16个单克隆子,应用引物3、4行煮菌PCR。挑取煮菌筛选正确的单克隆,接种于新鲜LA培养基中,抽提质粒定量,并行测序验证(由上海美吉生物技术有限公司完成)。
1.3 条件启动子在隐球菌基因表达调控中的应用及验证
套叠PCR合成基因启动子同源重组框 第一轮PCR,首先应用CTAB方法抽提获得隐球菌的基因组 DNA[6],以之为模板,应用引物 5、6 合成目的基因上游同源重组片段 (5-Franking Region,5-FR即目的基因启动子所在区域),应用目的基因下游同源重组片段 (3-Franking Region,3-FR即目的基因编码区);以新建质粒pNEO-CTR4为模板,引物1、4合成NEO/CTR4 DNA片段。第二轮PCR:以上述3个产物纯化后的等摩尔浓度为模板,应用引物5、8 PCR合成基因启动子同源重组框,电泳割胶纯化定量。PCR反应体系同说明书,原理见图1。
基因枪转化 挑取隐球菌单克隆,YPD培养基摇床过夜培养后制备感受态细胞,并均匀涂布在YPD+1M山梨醇平板上自然晾干。取纯化定量后的基因启动子同源重组片段 (2 μg/5 μL),依次加入10 μL 金珠 (0.6 μm,美国 Bio-Rad)、10 μL CaCl2(2.5 M)和2.5 μL 亚精胺 spermidine(1 M),振荡混匀、室温静置、无水乙醇重悬后均匀涂布于载粒膜中心并风干。启动基因枪,设置参数后激发开关,将同源重组DNA片段转入隐球菌感受态细胞;30℃培养箱孵育4 h后转移至YPD+G418筛选培养基上孵育1周左右。
阳性克隆的筛选与验证 从筛选培养基上挑出所有单克隆子,应用试剂盒抽提其基因组DNA,分别应用引物9和10、11和12行PCR验证阳性克隆子,并将初测正确的PCR产物送基因测序。经PCR、测序验证正确后的菌株,分别置于含25 μM BCS或25 μM CuSO4的YPD培养基中培养至对数生长晚期,应用试剂盒提取RNA、合成cDNA后,Real Time PCR比较目的基因UBI 1在两种生长条件下的表达水平,管家基因为ACT 1(引物见表1)[8]。具体步骤详见试剂盒。
2 结 果
2.1 隐球菌条件启动子重组质粒的获得
在应用条件诱导性启动子定向调控新生隐球菌的基因表达时,常需应用抗性基因筛选的方法将目的基因的启动子替换为条件启动子。我们首先应用高保真酶PrimeStar行PCR扩增,分别从质粒载体pJAF1和pNAT/CTR4中获得相应的的抗性基因NEO(抗遗传霉素基因)和铜离子抑制性启动子pCTR4片段,而后经第2轮PCR将上述片段融合在一起。PCR产物的电泳结果如图2,NEO、pCTR4及融合DNA片段分别为2 010 bp、674 bp、2 664 bp,电泳条带完全符合预期,提示NEO/CTR4融合片段构建成功。
为了便于抗性基因-条件启动子融合片段长期稳定的保存,我们应用 T-A克隆的方法将重组DNA片段载入 T载体 pMD18T以构建新质粒pNEO/CTR4。由于PrimeStar酶的PCR扩增产物为钝性末端,NEO/CTR4片段经rTaq酶在扩增片段3'端添加"A"尾后,再与T克隆载体相连,转化入大肠杆菌感受态细胞TOP10后获得大量阳性克隆子,而未加DNA片段的T载体转化后结果为阴性。为了检测新构建重组质粒的正确性,随机挑取16个阳性克隆子以引物3、4行菌落PCR检测,所有扩增产物经电泳验证均为674bp,提示我们T-A克隆成功率100%(见图3)。随机选择2号、16号克隆的PCR产物,经基因测序验证完全正确,提示我们pNEO/CTR4重组质粒构建成功。
2.2 隐球菌目的基因UBI 1条件启动子重建株的构建
为了检测铜离子抑制性启动子CTR4在隐球菌基因转录调控应用中的可行性,我们任意选取了隐球菌基因UBI 1(CNAG_00370)为目的基因,通过构建启动子同源重组框和基因枪转化的方法实现启动子置换。经过生物信息学检索,我们发现目的基因CNAG_00370同上游基因CNAG_00371共享同一个启动子。为了不妨碍上游基因的正常表达,我们以UBI 1基因起始密码子为界,其上游约1 kb核苷酸 (含原始启动子)为5FR,起始密码子下游约1 kb核苷酸 (基因编码区)为3FR,应用同源重组原理在两者之间插入条件启动子pCTR4(见图1)。
5FR、3FR以及启动子同源重组框融合片段扩增物的电泳结果见图4,所有条带大小符合预期,提示重组框融合片段构建成功。大量扩增、纯化定量后,将其应用基因枪转化转入隐球菌感染态细胞,经G418抗性培养基筛选后获得数十个阳性克隆子,而阴性对照无菌落,提示操作正确 (见图5)。为了进一步验证阳性菌落条件启动子插入位置的正确性,我们设计引物9-12进行PCR验证,其中引物9、12分别位于5FR和3FR的上游、下游,而引物10、11则位于NEO抗性基因内 (见图1),仅当启动子定向置换成功方可扩增出预期条带。验证PCR结果如图6,条带大小符合预期,而且相应产物经DNA测序、核苷酸比对后完全正确 (结果未展示),提示我们条件启动子置换成功,新生隐球菌重建株ZJY01-ZJY03(CTR 4(p)-UBI 1::NEO)构建正确。
2.3 条件启动子对UBI 1基因在不同条件下转录水平的调控
我们应用实时定量PCR分析检测了pCTR4启动子在铜离子螯合和丰富铜离子两种生长条件下对目的基因UBI 1的转录调控影响。引物设计是决定实时定量PCR结果的重要影响因素,为了避免基因组DNA的干扰影响,通常跨越基因组DNA内含子区域设计引物,我们应用Primer3软件获得跨越内含子S3区域的下游引物 (见图7)。获得隐球菌基因组RNA合成cDNA后,我们首先应用普通PCR检测了RT-PCR引物的可行性,扩增产物电泳结果如图7所示,条带特异无杂带且敏感性较好,符合预期大小 (UBI 1片段为204 bp,ACT 1片段为186 bp),提示引物设计良好。
进一步比较检测了3个隐球菌条件启动子重建株(ZJY01-ZJY03)在诱导性(铜离子螯合剂25 μM BCS)和抑制性 (丰富铜离子25 μM CuSO4)生长条件下目的基因UBI 1的表达情况 (见图8)。较之25 μM CuSO4培养条件,3 个菌株在 25 μM BCS培养条件下生长至对数生长晚期时UBI 1基因的表达水平显著升高约16~27倍 (P<0.001),3个菌株在同一条件下UBI 1基因的表达水平差异无统计学差异。结果符合预期,提示我们已成功应用pCTR4启动子对目的基因实现条件性诱导或抑制。
3 讨 论
在本研究中,我们顺利构建了条件启动子相关质粒pNEO/CTR4,以此为基础进一步论证了该启动子在隐球菌泛素基因UBI 1条件诱导性转录调控应用中的可行性。铜离子抑制性条件启动子来源于高亲和力铜离子转运蛋白基因CTR 4,该基因表达由DNA耦联蛋白Cuf1调控,在低铜离子 (铜离子螯合剂BCS)条件下,Cuf1与pCTR4中的铜离子感应元件CuSE相结合从而显著增强基因CTR 4的转录表达;相反,如果在富含铜离子生长条件下,则Cuf1为外源性铜离子竞争性结合,对pCTR4中CuSE元件亲和力显著下降从而抑制基因的转录表达[4]。
目前,国外学者已先后应用该启动子鉴定证实了隐球菌中苏氨酸、脂肪酸合成通路中相关基因HOM 3、THR 1、FAS 1、FAS 2均为致死性关键基因[7,9]。上述研究均以 pNAT/CTR4 为基础,应用诺尔斯菌素抗性基因NAT作为筛选标记进行启动子同源置换。与之不同的是,本研究对该质粒进行了改造,转而应用遗传霉素抗性基因NEO作为筛选标记重新构建质粒pNEO/CTR4,成功实现了对隐球菌基因的转录调控,首次证实遗传霉素抗性基因对铜离子抑制启动子无功能影响,可作为pCTR4的有效报告基因。较之遗传霉素,诺尔斯菌素价格十分昂贵,而且目前国内尚无同类产品,严重制约了国内隐球菌相关的基因研究,因此新建质粒pNEO/CTR4具有重要的应用前景。
我们在研究中发现,较之高铜离子条件,铜离子螯合后目的基因表达显著升高,最高可达27倍,而文献报道最高可诱导增强表达276倍[4]。这种差异可能源于实验条件的选择,本研究应用25 μM BCS而文献报道中为200 μM BCS,不同浓度铜离子螯合剂的应用可能导致培养基中铜离子残余量上的差异,从而导致Cuf1p对条件启动子pCTR4亲和力的改变最终决定了目的基因的转录水平差异。因此,条件启动子pCTR4除了可以用于鉴定致死性关键基因外,还可用于研究基因表达水平与功能效应关系。国外学者已成功应用该原理,证实了隐球菌转录因子ZNF 1表达水平与菌丝产生水平呈显著的正相关[10]。
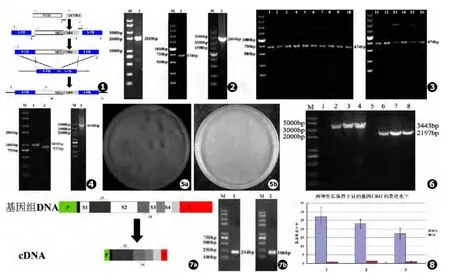
图1 利用套叠PCR构建目的基因条件启动子重建株的示意图 图2 套叠PCR构建NEO/CTR4重组片段:L1.NEO抗性基因片段,L2.pCTR4条件启动子片段,L3.NEO/CTR4融合片段 图3 重组质粒pNEO/CTR4煮菌PCR验证电泳结果 图4 套叠PCR合成基因启动子同源重组框:L1.5'端同源重组区 (5FR),L2.3'端同源重组区 (3FR),L3.5FR+NEO/CTR4+3FR三段融合而成的条件启动子子同源重组框图5 抗性培养基筛选出的阳性克隆:a.条件启动子重组框经基因枪转化后以YPD+G418抗性培养基筛选出来的阳性克隆子;b.H99在抗性培养基中的空白对照 图6 条件启动子重组菌株阳性克隆子的PCR验证:L1,L5.以隐球菌标准株H99基因组DNA为模板,L2,L6.对于重建株ZJY01,L3,L7.对于重建株ZJY02,L3,L7.对于重建株ZJY03;L1~L4为引物11和12的扩增产物,L5~L8为引物9和10的扩增产物 图7 实时定量PCR引物设计与检测:a.引物设计,P为启动子区,T为终止子区,S1~S4为基因组DNA内含子片段;b.引物检测,L1为UBI1片段常规PCR的扩增产物204 bp,L2为管家基因ACT1的扩增产物186 bp 图8 两种生长条件下条件启动子诱导UBI 1基因表达水平的变化。1~3分别为隐球菌重建菌株ZJY01、ZJY02、ZJY03(CTR 4(p)-UBI 1::NEO)。以ACT1为管家基因,三个菌株在铜离子螯合生长条件(BCS)下较之丰富铜离子生长条件下,基因UBI 1均表现为显著上调表达(P<0.001)Fig.1 Sketch map of conditional promoter reconstitutional strain with overlap PCR Fig.2 Construction of fused fragment NEO/CTR4 with overlap PCR Fig.3 Verification of reconstitution vector pNEO/CTR4 via colony PCR Fig.4 Construction of promoter replacement recombination cassette with overlap PCR Fig.5 Positive colonies of Cryptococcus neoformans reconstitution strain in YPD medium plus G418 Fig.6 Confirmation of conditional promoter reconstitution strains via diagnostic PCR Fig.7 Design and quality testing of Real-Time PCR primers Fig.8 Expression of target gene UBI 1 induced by conditional promoter under different growth conditions
除了铜离子抑制性启动子之外,可用于隐球菌基因功能研究的条件启动子还有半乳糖诱导启动子pGAL7和交配诱导启动子pMFα1。pGAL7在葡萄糖存在时表达抑制,而半乳糖存在时表达显著增强[3],然而不同的碳源利用通路对隐球菌致病感染具有重要的影响[11],该条件启动子在隐球菌碳源利用相关的基因功能研究方面存明显受限。而pMFα1仅在 V8交配培养基中方可诱导基因表达[5],然而隐球菌在该培养基上生长速率较慢且可诱导担孢子产生,极大地限制了其作为基因表达调控研究的分子生物学工具。与上述两个条件启动子相似,pCTR4对隐球菌铜离子利用相关基因的表达调控研究存在一定的影响,但除此之外的基因功能研究具有广泛的适用性。因此,三个条件启动子(尤其pCTR4和pGAL7)相互补充,是隐球菌功能基因组学研究的重要工具。
泛素系统是真核生物中普遍存在的重要蛋白修饰机制,主要参与细胞周期、信号转导、应激应答、蛋白质控等多种重要的生物学过程,对隐球菌、念珠菌等多种病原真菌的生长和毒力具有多效调控作用[12-15]。而本研究中的目的基因UBI 1是仅有的两个隐球菌泛素前体蛋白编码基因之一,主要表达单体泛素分子耦联一个核糖体蛋白[16]。前期工作中我们应用同源重组方法多次试图敲除它均未获成功,通过条件启动子pCTR4的同源置换研究,我们首次证实UBI 1基因并非新生隐球菌的致死性关键基因,为后续的基因功能机制研究奠定了良好的基础。
4 致 谢
感谢美国杜克大学医学中心John R Perfect教授为我们提供的菌株和质粒。
[1]Park BJ,Wannemuehler KA,Marston BJ,et al.Estimation of the current global burden of cryptococcal meningitis among persons living with HIV/AIDS[J].AIDS,2009,23(4):525-530.
[2]Idnurm A,Bahn YS,Nielsen K,et al.Deciphering the model pathogenic fungusCryptococcus neoformans[J].Nat Rev Microbiol,2005,3(10):753-764.
[3]Wickes BL,Edman JC.TheCryptococcus neoformansGAL7 gene and its use as an inducible promoter[J].Mol Microbiol,1995,16(6):1099-1109.
[4]Ory JJ,Griffith CL,Doering TL.An efficiently regulated promoter system forCryptococcus neoformansutilizing the CTR4 promoter[J].Yeast,2004,21(11):919-926.
[5]del PM,Toffaletti DL,Rude TH,et al.Cryptococcus neoformansdifferential gene expression detectedin vitroandin vivowith green fluorescent protein[J].Infect Immun,1999,67(4):1812-1820.
[6]Fang W,Price MS,Toffaletti DL,et al.Pleiotropic effects of deubiquitinating enzyme Ubp5 on growth and pathogenesis ofCryptococcus neoformans[J].PLoS One,2012,7(6):e38326.
[7]Chayakulkeeree M,Rude TH,Toffaletti DL,et al.Fatty acid synthesis is essential for survival ofCryptococcus neoformansand a potential fungicidal target[J].Antimicrob Agents Chemother,2007,51(10):3537-3545.
[8]Cox GM,Rude TH,Dykstra CC,et al.The actin gene fromCryptococcus neoformans:structure and phylogenetic analysis[J].J Med Vet Mycol,1995,33(4):261-266.
[9]Kingsbury JM,McCusker JH.Threonine biosynthetic genes are essential inCryptococcus neoformans[J].Microbiology,2008,154(Pt 9):2767-2775.
[10]Wang L,Zhai B,Lin X.The link between morphotype transition and virulence inCryptococcus neoformans[J].PLoS Pathog,2012,8(6):e1002765.
[11]Price MS,Betancourt-Quiroz M,Price JL,et al.Cryptococcus neoformansrequires a functional glycolytic pathway for disease but not persistence in the host[J].MBio,2011,2(3):e00103-00111.
[12]Finley D,Ciechanover A,Varshavsky A.Ubiquitin as a central cellular regulator[J].Cell,2004,116(2 Suppl):S29-32,2 p following S32.
[13]Amerik AY,Hochstrasser M.Mechanism and function of deubiquitinating enzymes[J].Biochim Biophys Acta,2004,1695(1-3):189-207.
[14]Liu OW,Chun CD,Chow ED,et al.Systematic genetic analysis of virulence in the human fungal pathogenCryptococcus neoformans[J].Cell,2008,135(1):174-188.
[15]Leach MD,Stead DA,Argo E,et al.Molecular and proteomic analyses highlight the importance of ubiquitination for the stress resistance,metabolic adaptation,morphogenetic regulation and virulence ofCandida albicans[J].Mol Microbiol,2011,79(6):1574-1593.
[16]Spitzer ED,Spitzer SG.Structure of the ubiquitin-encoding genes ofCryptococcus neoformans[J].Gene,1995,161(1):113-117.
