3个野生毛花猕猴桃居群的SSR多样性分析
2014-08-28杨妙贤潘伟明周玲艳叶婵娟刘胜洪万小荣
杨妙贤, 潘伟明, 周玲艳, 刘 文,2, 叶婵娟, 刘胜洪, 万小荣, 梁 红*
(1.仲恺农业工程学院生命科学学院,广州 510225; 2.华南农业大学农学院,广州 510642)
猕猴桃是猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)植物的总称,为多年生雌雄异株落叶藤本植物.我国乃至世界上的猕猴桃主要栽培品种比较单一,狭窄的遗传基础带来整个产业的脆弱性[1-3],培育新的猕猴桃栽培品种已成为重点关注问题.目前,栽培猕猴桃主要是通过野生类型驯化和芽变枝条选优扩繁而育成的,我国有着丰富的野生猕猴桃资源,自20世纪70年代以来,我国已从野生猕猴桃资源中选育出数百个品种和优良株系[4-6].但随着人口的迅速膨胀和经济活动的不断加剧,森林面积的不断减少,导致野生猕猴桃的原始生活环境遭到破坏,种质资源流失严重.因此,对猕猴桃野生资源的遗传多样性研究,不仅对猕猴桃新品种的选育以及对种质资源的收集和保存都有着极其重要的意义.
国内外对猕猴桃的相关研究主要集中在资源圃的种质遗传基础与背景的评价[7-8]、猕猴桃属植物的分子系统学研究[9-11]以及栽培品种(株系)的遗传多样性检测与分子指纹鉴定等[12],而对于猕猴桃野生居群的研究极少.微卫星(micro satellite)DNA,即简单重复序列(simple sequence repeat,SSR),是以1~6个碱基为基本单元的多次串联重复序列.它们广泛存在于各类真核生物基因组以及不同物种中,含量以及占优势的微卫星序列类型各不相同,在基因组中表现出高度的长度多态性.在日益发展的众多分子标记技术中,以其广泛分布于基因组、共显性、重现性好、多态性丰富等特点,广泛应用到植物分子生态、系统发育与进化、种质资源鉴定和评价等领域[13].毛花猕猴桃别名毛桃、毛阳桃、毛冬瓜,主要分布于广东、广西、江西、湖南、福建、贵州等海拔250 m以上的山区,耐湿、耐热性很强且具有较高的营养价值,因此,其除果实具有育种利用价值外,还可用作中华猕猴桃和美味猕猴桃的耐湿、耐热砧木,在我国南方具有较大的发展利用前景.本研究对野生毛花猕猴桃居群遗传多样性进行分析,可丰富猕猴桃野生资源的遗传相关信息资源,为猕猴桃属植物的种质资源保育提供参考,同时也为猕猴桃的新品系选育、种质资源保存、品种鉴定等各方面提供基础数据.
1 材料与方法
1.1 植物材料
从广东省河源市和平县上陵镇高峰和羊石、上陵镇桃源村及热水镇3个居群采集不同单株(每个居群41个样本)的野生毛花猕猴桃叶片.采集的样本用冰盒运回广州后放入-70 ℃冰箱中保存备用.
1.2 基因组DNA提取及PCR扩增
基因组DNA提取采用改良 SDS 法[14-15],用9对稳定性好、多态性高的 SSR 引物[11](表1)进行扩增.扩增反应体系为:DNA样品0.5 μL(30 ng),10×PCR buffer 2 μL,Mgcl2(25 mmol/L) 1.2 μL,dNTPs (10 mmol/L) 0.5 μL,上游引物 (10 μmol/L) 0.4 μL,下游引物 (10 μmol/L) 0.4 μL,Taq 酶(0.5 U/ μL) 1 μL,ddH2O 15.6 μL.扩增程序为:95 ℃预变性5 min,94 ℃变性50 s,55~57 ℃退火45 s,72 ℃延伸50 s,35个循环,72 ℃延伸10 min.扩增在Mastercycle Gradient PCR仪(Eppendorf Germany)上进行.扩增产物采用含7 mol/L尿素的6%变性聚丙烯酰胺凝胶电泳分离,银染检测.

表1 SSR引物序列及其退火温度Table 1 Primer sequences of SSR and their annealing temperatures
1.3 数据分析
根据样品电泳条带的有无,在Excel表格上构建0, 1矩阵图,多态性位点百分比(Percentage of Polymorphic Band,简称PPB)按照下面公式计算:
多态性百分率(PPB)=多态性位点数量/总位点数量×100%.
等位位点频率的计算方法参考等位基因的频率计算方法[16]:等位位点频率p=位点数量/总位点数量.计算出等位位点频率后用PIC_Calc软件计算位点的多态性信息量(Polymorphism Information Content, 简称PIC).
2 结果与分析
2.1 基因组DNA的提取
猕猴桃是多年生大型木质藤本植物,幼叶中含有大量的多糖及胶类物质,这些物质的存在会影响基因组DNA的提取效果,多糖污染的DNA呈粘稠胶状,对反应体系中的酶活性会产生抑制作用,最终影响PCR的效果.本实验采用了NaAc-HAc高盐低pH体系(pH 3.0~3.5)的DNA提取液,图1的电泳图谱中可见清晰的基因组DNA条带,表明所提取的猕猴桃基因组DNA较完整,可用于PCR扩增.

1~17:不同居群的野生毛花猕猴桃
图1 野生毛花猕猴桃基因组DNA的提取
Figure 1 Genomic DNA isolated from wildActinidiaerianthaBenth
2.2 PCR扩增产物的电泳检测
选用9对SSR引物对3个野生毛花猕猴桃样本DNA进行PCR扩增,所有样品和引物扩增产物经电泳后均获得了清晰的图谱(图2~图4),说明所采用的SSR引物稳定性好,适合猕猴桃的遗传多态性分析.
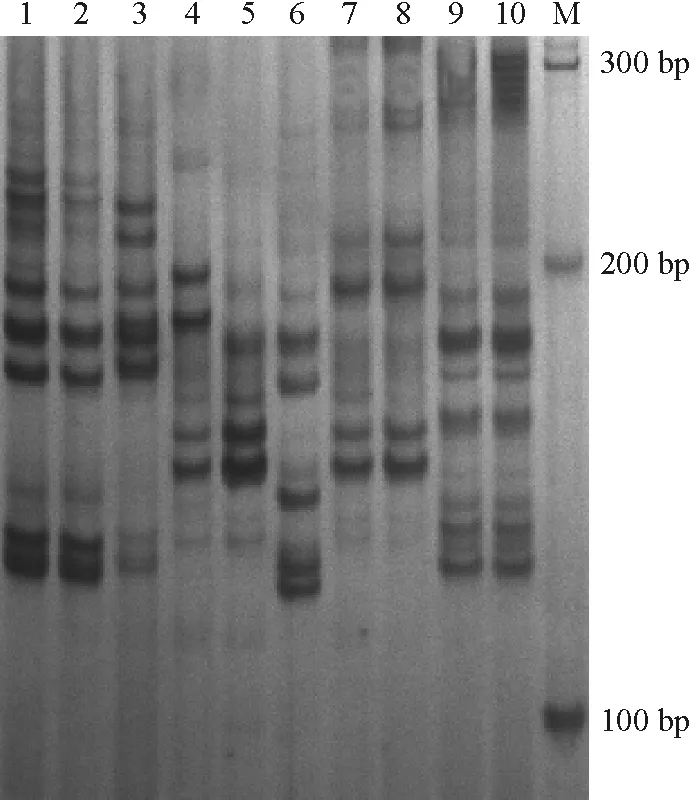
图2 引物UDK96-013对和平县热水镇毛花猕猴桃样本的扩增
Figure 2 SSR amplificates of wildActinidiaerianthaBenth from Reshui town, Heping county with primer UDK96-013
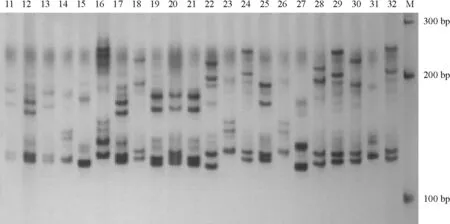
图3 引物UDK96-019对和平县上陵镇高峰和羊石多花猕猴桃样品的扩增
Figure 3 SSR amplificates of wildActinidiaerianthaBenth from Gaofeng and Yangshi in Shangling town, Heping county with primer UDK96-019
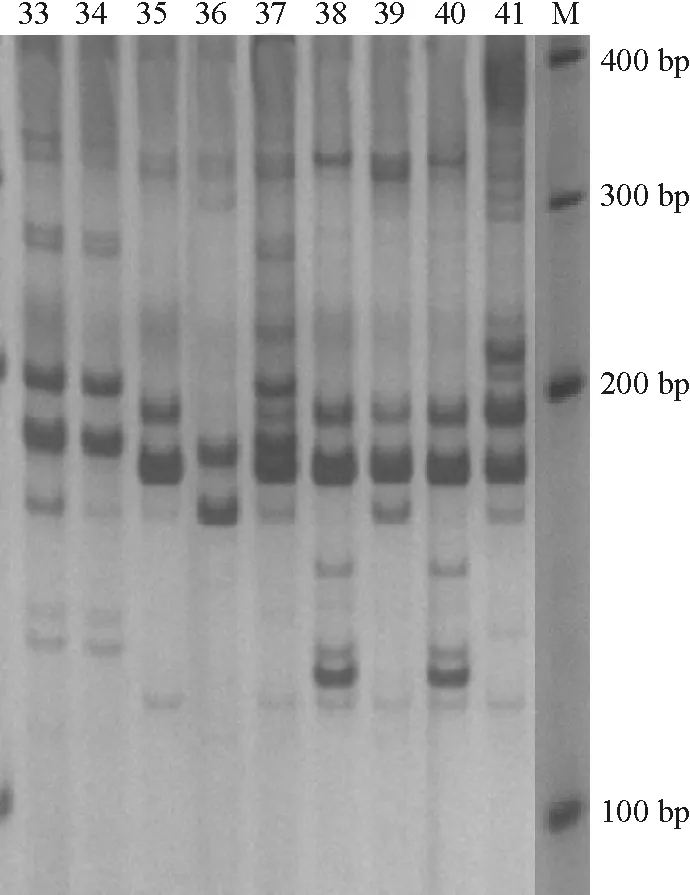
图4 引物UDK96-009对和平县上陵镇桃源村毛花猕猴桃样品的扩增
Figure 4 SSR amplificates of wildActinidiaerianthaBenth from Taoyuan village, Shangling town,Heping county with primer UDK96-009
2.3 不同居群毛花猕猴桃的多态性分析
按每个样品电泳条带的有无,将引物扩增的等位基因作为“l”或 “0” 赋值,构建[0 1]数据矩阵作为分析数据,再根据按 PIC计算公式,应用PIC_Calc软件计算其PIC值.结果表明,通过所选用的9对SSR引物对3个居群的猕猴桃样本均扩增出多态性(图2~图4,表2).其中,9对引物在和平县热水镇共10个样品间共检测到484个等位基因,平均每个多态性位点3.4个等位基因,9对引物多态信息量PIC值在0.661~0.951之间;和平县上陵镇高峰和羊石共22个样品共检测出881个等位基因, 平均每个多态性位点4.9个等位基因,9对引物多态信息量PIC值在0.670~0.949之间;上陵镇桃源村共22个样本共检测出1 104个等位基因,平均每个多态性位点7.7个等位基因,9对引物多态信息量PIC值在0.560~0.916之间(表2).说明和平县3个居群野生毛花猕猴桃具有极高的多态性.
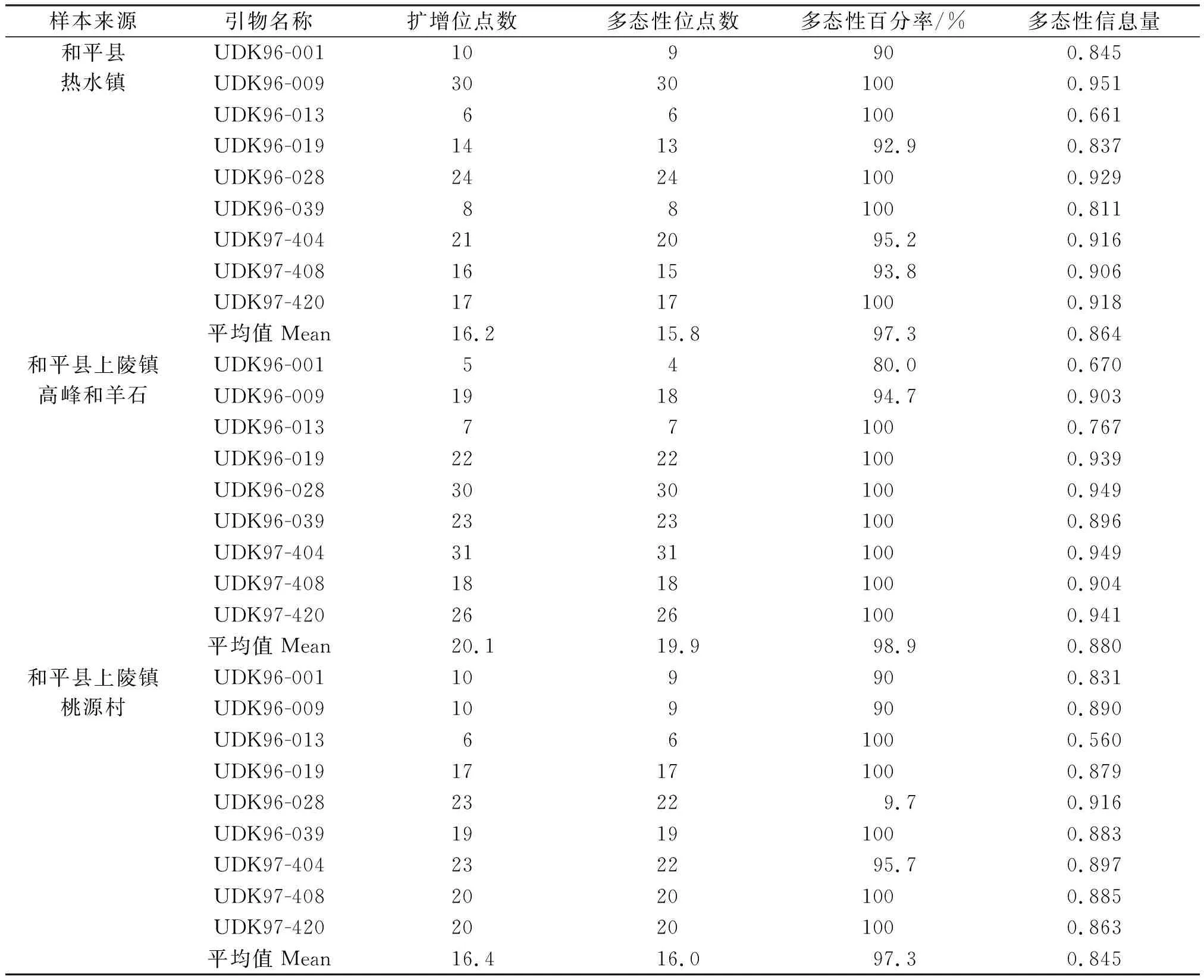
表2 和平县3个居群野生毛花猕猴桃SSR多样性分析Table 2 SSR polymorphism analysis of wild Actinidia eriantha Benth from three populations in Heping county
多态性位点分析数据表明,9对SSR引物在和平县热水镇样本中共检测出142个多态性位点,平均每对引物检测出15.8个多态性位点,9对引物的平均多态性位点百分率为96.9%,平均PIC值为0.864;和平县上陵镇高峰和羊石样本中共检测出179个多态性位点,平均每对引物检测出19.9个多态性位点,9对引物平均多态性百分率为97.2%,平均PIC值为0.880;和平县上陵镇桃源村样本共检测出144个多态性位点,平均每对引物检测出16个多态性位点,9对引物的平均多态性位点百分率为96.9%,平均PIC值为0.845.其中平均多态性百分率最大的是和平县上陵镇高峰和羊石样本,为97.2%,热水镇和上陵镇桃源村两地的样品平均多态性百分率均为96.9%,与和平县上陵镇高峰和羊石样品差距为0.3%;平均PIC值最大的为和平县上陵镇高峰和羊石样本(0.880),最小的上陵镇桃源村样本(0.845),与和平县上陵镇高峰和羊石样品差距为0.035(表2).说明3个居群的野生毛花猕猴桃的居群之间多态性差异不是很明显,相对多态性较高的为和平县上陵镇高峰和羊石样品,较低的为上陵镇桃源村样品.
3 讨论
遗传变异是生物体内遗传物质发生变化而造成的一种可以遗传给后代的变异.遗传变异在居群内的分布包括遗传变异的大小、时空分布及其与环境之间的关系等.居群内遗传变异的分布体现了植物居群中的生态与进化过程[17].
猕猴桃属的广泛自然种间、种内杂交,必然使其后代具有丰富的变异类型.栗琪等[18]对我国猕猴桃9个天然居群的遗传多样性进行的初步分析结果显示,我国猕猴桃野生居群具有极高的遗传多样性,居群PIC值达0.87~0.96.刘亚令等[17]采用9对引物对中华猕猴桃和美味猕猴桃在2个居群中的168株样本进行的多态性分析结果表明,中华猕猴桃居群PIC值平均达0.812,美味猕猴桃居群PIC值平均达0.83,也显示出猕猴桃自然居群遗传的多态性.毛花猕猴桃是雌雄异株,后代均为雌雄之间杂交产生,比较容易产生变异.
本研究通过9对SSR引物对3个居群的自然居群猕猴桃遗传多样性分析结果表明,3个居群的野生毛花猕猴桃均表现出极高的多态性,平均PIC值均在0.845~0.880,说明从野生猕猴桃资源中选出的猕猴桃品种也具有高度遗传多样性.SSR多态性及其精确的片段大小与SSR 指纹图谱相结合,便可建立每一品种的标准图谱,迅速构建我国猕猴桃品种的SSR 遗传指纹图谱,将为今后推广优良品种、调整猕猴桃产业的品种种植结构、制定品种资源的保育策略以及新品种的登记注册和产权保护奠定基础和提供科学依据[19].同时对人工栽培种与野生种杂交选育新品系,丰富猕猴桃种质资源也有着重要的指导意义,通过猕猴桃野生资源遗传多态性的研究,结合亲缘关系及遗传变异的空间相关性研究,可以为猕猴桃野生种质资源的保存,遗传多样性的保护提供指导,有助于猕猴桃物种保护工作的顺利开展.
参考文献:
[1] Huang H W, Ferguson A R. Kiwifruit (ActinidiachinensisandA.deliciosa) plantings and production in China[J]. New Zealand Journal of Crop and Horticultural Science, 2003, 31: 197-202.
[2] Huang S X, Ding J, Deng D J, et al. Draft genome of the kiwifruitActinidiachinensis[J]. Nature Communications, 2013, 4: 2640.
[3] 黄宏文. 猕猴桃驯化改良百年启示及天然居群遗传渐渗的基因发掘[J]. 植物学报, 2009, 44(2): 127-142.
Huang H W. History of 100 years of domestication and improvement of kiwifruit and gene discovery from genetic introgressed populations in the wild[J]. Chinese Bulletin of Botany, 2009, 44 (2): 127-142.
[4] 黄宏文. 猕猴桃属 分类 资源 驯化 栽培[M]. 北京:科学出版社,2013: 3-10.
[5] 黄贞光.我国猕猴桃品种结构、区域分布及调整意见[J]. 果树科学, 1998, 15(3): 193-197.
Huang Z G. Some ideas about the adjustment of kiwifruit variety structure and growing areas in China[J]. Journal of Fruit Science, 1998, 15(3): 193-197.
[6] 陈启亮,陈庆红,顾霞,等. 中国猕猴桃新品种选育成就与展望[J]. 中国南方果树,2009, 2(38):70-76.
Chen Q L, Chen Q H, Gu X, et al. The achievement and prospect on new varieties breeding and selecting of kiwifruit in China[J]. South China Fruits, 2009, 2(38):70-76.
[7] Atkinson R G, Cipriani G, Whittaker D J, et al. The allopolyploid origin of kiwifruit,Actinidiadeliciosa(Actinidiaceae)[J]. Plant Systematics and Evolution, 1997, 205: 111-124.
[8] Testolin R, Cipriani G. Paternal inheritance of chloroplast DNA and maternal inheritance of mitochondrial DNA in the genusActinidia[J]. Theoretical and Applied Genetics, 1997, 94: 897-903.
[9] Huang H W, Li Z Z, Li J Q, et al. Phylogenetic relationships inActinidiaas revealed by RAPD analysis[J]. Journal of the American Society for Horticultural Science, 2002, 127: 759-766.
[10] Li J Q, Huang H W, Sang T. Molecular phylogeny and infrageneric classification ofActinidia(Actinidiaceae)[J]. Systematic Botany, 2002, 27: 408-415.
[11] Chat J, Jauregui B, Petit R J, et al. Reticulate evolution in kiwifruit (Actinidia,Actinidiaceae) identified by comparing their maternal and paternal phylogenies[J]. American Journal of Botany, 2004, 91: 736-747.
[12] Zhen Y Q, Li Z Z, Huang H W. Molecular characterization of kiwifruit (Actinidia) cultivars and selections using SSR markers[J]. Journal of the American Society for Horticultural Science, 2004, 129: 374-382.
[13] 曾莉娟, 郑成木. SSR技术及其应用[J]. 热带农业科学, 2001, 3(91): 56-59.
Zeng L J, Zheng C M. SSR technology and its application[J]. Tropical Agriculture Science, 2001, 3(91): 56-59.
[14] 刘文, 柯辉鹏, 梁红. 动植物总核酸提取试验[J]. 仲恺农业技术学院学报, 2008, 21(3): 17-21.
Liu W, Ke H P, Liang H. A broad-suitable method for total nucleic acid extraction from plants and animals[J]. Journal of Zhongkai University of Agriculture and Technology, 2008, 21(3): 17-21.
[15] 刘胜洪, 刘文, 刘明峰,等. 一种高效提取猕猴桃DNA和RNA的方法[J]. 生物技术通报,2011(9): 171-175.
Liu S H, Liu W, Liu M F, et al. An efficient method for extracting DNA and RNA from kiwifruit leaves and flower buds[J]. Biotechnology Bulletin, 2011, (9): 171-175.
[16] Richard F, Jonathan D B, David A B. 保育遗传学导论[M]. 北京: 科学出版社, 2005: 48.
[17] 刘亚令, 李作州, 张鹏飞, 等. 猕猴桃自然居群SSR遗传变异的空间自相关分析[J]. 生物多样性,2006, 14(5): 1421-1434.
Liu Y L, Li Z Z, Zhang P F, et al. Spatial genetic structure in natural populations of two closely relatedActinidiaspecies (Actinidiaceae) as revealed by SSR analysis[J]. Biodiversity Science, 2006, 14(5): 1421-1434.
[18] 栗琪, 李作洲, 黄宏文. 猕猴桃野生居群的 SSR分析初报[J]. 武汉植物学研究,2004, 22(2): 175-178.
Li Q, Li Z Z, Huang H W. Preliminary study on SSR analysis in natural populations ofActinidia[J]. Journal of Wuhan Botanical Research, 2004, 22(2): 175-178.
[19] 郑轶琦, 李作洲, 黄宏文. 猕猴桃品种SSR分析的初步研究[J]. 武汉植物学研究, 2003, 21(5): 444-448.
Zheng Y Q, Li Z Z, Huang H W. Preliminary study on SSR analysis in kiwifruit cultivars[J]. Journal of Wuhan Botanical Research, 2003, 21(5): 444-448.
